Otitis Media Aguda
MEDICINA FAMILIAR
EDUCACIÓN CONTINUADA PARA EL MEDICO GENERAL
Definición
Es una inflamación infecciosa del oído medio, que incluye la cavidad del oído medio, la trompa de Eustaquio y en algunos casos la mastoides.
Epidemiología
Es una entidad con incidencia alta y constituye uno de los motivos más frecuentes de consulta pediátrica; es más común entre los 6 y 36 meses de edad con un pico menor entre los 4 y 7 años.
Factores de riesgo
Infección previa por neumococo; presentación de la enfermedad por primera vez durante el primer año de vida; posición supina en particular durante la alimentación con biberón; exposición a humo de cigarrillo, principalmente dentro de la casa; condiciones de atopia personal (dermatitis, componente urticariforme, rinitis, conjuntivitis alérgica, alergias gastrointestinales); hipertrofia adenoidea; hacinamiento; guarderías; sexo (los hombres son más susceptibles); anormalidades anatómicas craneofaciales (paladar hendido); variaciones climáticas.
Etiología
La etiología de estas infecciones es variada. La primera causa es viral, ya que se asocia con las rinofaringitis o gripas, pero se considera que más o menos 55% se infectan con bacterias dentro de las cuales, las más importantes son: S. pneumoniae 35%; H. influenzae 25%; M. catarrhalis 15%; S. aureus 2%; S. pyogenes 8%; otros 2%; negativos 13%. En estudios realizados en Medellín por H. Trujillo se encontró H. influenzae y S. pneumoniae en 63%, S. epidermidis, S. aureus, Enterobacter sp, M. catarrhalis, S. pyogenes y otros en 11%.
Cuadro clínico
Los síntomas comprenden dolor en el oído, fiebre y disminución de la agudeza auditiva, se puede presentar con o sin secreción ótica, en los niños se pueden asociar otros síntomas generales como irritabilidad, anorexia y vómito.
Diagnóstico
La técnica diagnóstica es la otoscopia: suele encontrarse una membrana timpánica eritematosa o amarilla, opaca, prominente o retraída, a veces puede haber presencia de bulas y en ocasiones se observa una perforación espontánea del tímpano y otorrea. Idealmente se debe realizar una otoscopia neumática donde además se evidencia disminución de la motilidad de la membrana timpánica, permitiendo una mayor precisión diagnóstica.
Se considera que la infección del oído es aguda cuando esta tiene una evolución inferior a dos semanas.
Otitis media con efusión: se caracteriza por ser una efusión asintomática del oído medio que se puede presentar 3 a 16 semanas después del diagnóstico de una otitis aguda.
Hay disminución en la motilidad de la membrana y puede haber algún grado de retracción de la misma. Si persiste por mas de 16 semanas se clasifica como una otitis media con efusión pesistente. Otitis media aguda recurrente (OMAR): tres o más episodios de otitis claramente definidos como nuevos episodios en un período de seis meses o cuatro o más en uno año.
Otitis media crónica supurada (OMCS): es la inflamación crónica del oído medio con otorrea persistente o recurrente con tímpano perforado.Otitis media sin respuesta: está caracterizada por sintomatología clínica y hallazgos otoscópicos de inflamación de la membrana timpánica que persiste más de 48 horas después de haber sido iniciada la terapia antibiótica.
Una membrana timpánica roja con movilidad normal está en contra del diagnóstico de otitis media. Puede ser debida a infección viral del tracto respiratorio superior, llanto del paciente, o esfuerzos para remover el cerumen.
Tratamiento
Para otitis media aguda: amoxacilina: 80 – 90 mg/kg/día cada 8 horas durante 7 días. Alternativas: a) Trimetoprim sulfa: 10 mg de trimetoprim y 45 mg de sulfa por kg/día cada 12 horas durante 7 a 10 días. b) Eritromicina sulfa: 40 mg de eritromicina y 150 mg de sulfa por kg/día cada 6 horas durante 7 a 10 días.
Para otitis media recurrente: amoxacilina: 20 mg/kg/día en una o 2 dosis por 3 a 6 meses. Alternativa: sulfisoxasol: 75 mg/kg/día en una o 2 dosis por 3 a 6 meses.
Para otitis media con efusión: agente antibiótico: igual que para la otitis media aguda, pero durante 14 a 21 días. Corticoide: prednisolona 1 mg/kg/día dividido en 2 dosis por 5 días.
Otras consideraciones terapéuticas: diez por ciento de los pacientes presentan una OMA que no responde al tratamiento inicial. En estos casos aunque son medicamentos no aceptados aun en el listado básico de medicamentos, se debe considerar esquema con amoxacilina – clavulanato o eritromicina sulfa o trimetoprin sulfa (sí la elección inicial fue amoxicilina). Si no hay mejoría con este segundo tratamiento se recomienda realizar una timpanocentesis para aislar el gérmen y realizar el antibiograma. Igualmente se recomienda timpanocentesis si el paciente luce séptico.
Ante la sospecha de una cepas de S. pneumoniae con resistencia intermedia es útil usar amoxacicilina al doble de las dosis recomendadas (80-90mg/kg/día).
Existen otras alternativas: amoxicilina-clavulanato, claritromicina, azitromicina, cefuroxima-acetil o cefproxil, pero son medicamentos que no hacen parte del listado básico de medicamentos aprobados para el POS, por lo que es indispensable realizar un análisis individual que justifique su formulación. Para las cepas totalmente resistentes, la elección del antibiótico depende del aislamiento del gérmen y estudios de sensibilidad. Si hay una gran preocupación por la adherencia al tratamiento podría usarse una dosis IM de ceftriaxona.
El manejo de la OMCS requiere el uso de antibióticos efectivos contra Pseudomonas aeruginosa, S. aureus y otros microorganismos.
Cultivo y antibiograma del material obtenido del oído medio, además de la limpieza dos a tres veces al día con introducción cuidadosa varias veces, de pequeña porción de tela no lanosa, entorchada, hasta lograr que dicha tela salga totalmente seca. En general una de las mejores opciones de antimicrobianos para esta situación es trimetropin sulfa a 5 mg/kg/día dosis unica durante 3 meses.
Prevención
Lactancia materna exclusiva durante los primeros 6 meses de vida; alimentación complementaria adecuada y buen nivel de nutrición; inmunizaciones especialmente vacunas del sarampión, triple viral, DPT, Haemophilus influenzae y BCG.
Educación en signos de peligro para que la madre o el cuidador sepa cuando debe regresar al servicio de salud.
Si el niño toma biberón desestimular su uso o enseñar la técnica adecuada.
Anemia ferropénica
El hierro es el elemento más importante en la formación y maduración de la hemoglobina (Hb), los requerimientos de los otros nutrientes son menores. Dependiendo de la causa específica de la anemia se puede encontrar alteración en el tamaño, la forma y la coloración de los glóbulos rojos (GR). El bajo contenido de hierro produce anemia, microcítica e hipocrómica, el bajo contenido de B12 y ácido fólico produce anemia macrocítica e hipercrómica, si la membrana celular esta deformada se encontrará un componente hemolítico con reticulocitos elevados y puede ser macro o microcítica.
Deficiencia de hierro: la deficiencia de hierro continua siendo la causa más común de anemia nutricional en el mundo a pesar de que su prevalencia ha disminuido en los últimos años en los países industrializados por la lactancia materna y la fortificación de las fórmulas infantiles y cereales con hierro. Sin embargo en el resto del mundo no se ha experimentado ésta disminución. En la edad pediátrica además de ésta se ha observado alteraciones a nivel cognitivo y de comportamiento en niños con déficit de hierro, la fatiga y disminución de capacidad de trabajo en adultos y adolescentes y asociación con prematurez, mortalidad perinatal y bajo peso al nacer en hijos de madres gestantes con ésta deficiencia. Ocurre en varios estadios. Primero se sucede la depleción de los depósitos de hierro en el organismo, éste estado es dificil de diagnosticar por pruebas de rutina; luego viene la anemia o disminución de la Hb con un VCM normal inicial (promedio del tamaño de los GR) como la deficiencia continua, la eritropoyesis se disminuye significativamente y el diagnostico se hace mas evidente y obvio con hipocromia, microcitosis y otras manifestaciones no hematológicas.
Un tercio de los requerimientos de hierro del lactante provienen de la dieta y el resto es reciclado de la destrucción de las células rojas; esto cambia con el tiempo y en la vida adulta la mayoría del hierro proviene de éste proceso de reciclaje que de la dieta.
El recién nacido (RN) a término nace con 75 mg/kg de hierro el cual es 70 a 80 % en forma de Hb. Cualquier problema perinatal que implique pérdida de sangre fetal o neonatal afecta significativamente la suplencia de hierro. Al nacer el RN tiene un gran número de reticulocitos y una concentración media de Hb alta. La Hb incrementa durante los primeros días y luego la eritropoyesis disminuye en médula ósea y espacios extramedulares llegando a su más bajo nivel entre la 6a y 8a semana, entonces la eritropoyesis se estimula y la Hb aumenta a 12,5 mg/dl nivel medio durante la infancia. El RN pretérmino tiene una disminución más dramática de la Hb con una media de 9 mg/dl en el punto más bajo y luego durante la recuperación aproximadamente al sexto mes de vida tiene los niveles del recién nacido a término.
El contenido de hierro del feto y el peso se incrementa proporcionalmente con la edad manteniendo una constante de hierro de 75 mg/kg. Un mg de Hb contiene 3,4 mg de hierro elemental. En circunstancias normales, 66 a 75% del hierro del RN está en los GR.
Una vez que los GR representan el mayor reservorio de hierro del RN, cualquier complicacion perinatal que implique pérdida sanguínea llevará a disminución del hierro del bebé.
La deficiencia de hierro en la madre no se correlaciona con anemia ferropénica en el hijo.
Definiciones
Deficiencia de hierro
Se refiere al déficit que es lo suficientemente severo para restringir la producción de Hb.
Anemia por deficiencia de hierro
Condición más avanzada que ocurre cuando la concentración de Hb se disminuye <95% del rango para la edad y el sexo.
Deficiencia de hierro sin anemia
O déficit en la producción de Hb, déficit de hierro donde la concentración de Hb es baja pero no lo suficiente para hacer el diagnóstico de anemia.
(Lea También: Estrategias para Mejorar el Hierro en la Nutrición)
Requerimientos de hierro
Son dependientes de la edad. Es raro que un RNAT presente deficiencia de hierro antes de los cuatro meses, pero el prematuro puede empezar a ser deficiente a los dos o tres meses de edad por su relativo crecimiento más rápido y menores depósitos de hierro al nacer.
El Comité de Nutrición de la Academia Americana de Pediatría hizo la siguiente recomendación basándose en una absorción del 10% del hierro administrado: 1. RNAT 1mg/kg con un máximo de 15 mg/día iniciando a los cuatro meses. 2. RNPT 2 mg/kg a un máximo de 15 mg/día iniciando a los dos meses. 3. Niños menores de 10 años, 10 mg/día. 4. Niños mayores de 10 años, 12 mg/día para niños y 15 mg/día para niñas. 5. Mujeres embarazadas 30 mg/día.
Las causas de deficiencia de hierro son: baja ingesta, poca asimilación, baja dilución (crecimiento rápido) pérdida sanguínea. Durante los períodos de crecimiento rápido: lactancia y adolescencia la dieta es baja en hierro o con un alto contenido de hierro no absorbible; además en los lactantes que ingieren leche entera de vaca las pérdidas sanguíneas por el tracto gastrointestinal (TGI) están aumentadas.
A partir del cuarto mes de vida se da un cambio gradual en la abundancia de hierro durante éste período de crecimiento rápido. Esta transición se debe principalmente a las grandes cantidades de hierro requeridas para mantener la concentración de Hb durante un período crecimiento rápido y que corresponde con el aumento del volumen sanguíneo.
Entre los 4 a 12 meses un promedio de 0,8mg de hierro/ día se absorben de la dieta proveyendo 0,6 mg/día para el crecimiento y 0,2 mg/día para el balance de las pérdidas basales.
Manifestaciones no hematológicas de la deficiencia de hierro:
1. Déficit del crecimiento
2. Membranas y mucosas: koiloniquia, estomatitis angular, glositis
3. Tracto gastrointestinal: anorexia, disfagia con membranas pos-cricoideas, aclorhidria gástrica, mala-absorción, enteropatía exudativa y sangrado oculto
4. Sistema nervioso central: irritabilidad, trastorno de atención, bajo rendimiento en test de desarrollo, apneas
5. Intolerancia al ejercicio
6. Respuesta inmune: respuesta mitógena del linfocito deficiente, disminución de la actividad bactericida.
Diagnóstico
La deficiencia de hierro es usualmente sospechada por la historia clínica o detectada por pruebas de rutina para la anemia. Estos exámenes se deben tomar de rutina entre los 9 y 12 meses de edad para los niños a término y entre los 2 y 6 meses para los niños pretérminos.
Si ha existido una enfermedad reciente se sugiere retardar las pruebas ya que la infección es la causa más común de anemia. La medida de la Hb es la prueba de laboratorio más útil para la detección de anemia por deficiencia de hierro, ya que ésta refleja la cantidad de hierro esencial más abundante del organismo.
Entre los seis meses y los cuatro años de edad un valor de VCM
Las pruebas que confirman el diagnóstico de deficiencia de hierro son: a) ferritina sérica la cual parece ser la prueba más precisa ya que se disminuye únicamente ante la deficiencia de hierro; se puede ver elevada en procesos inflamatorios e infecciosos. b) La protoporfirina eritrocitaria: sus valores altos reflejan disminución en la producción de Hb y se presenta en la deficiencia de hierro, infección reciente o concurrente e intoxicación con plomo. c)
La saturación de transferrina fácilmente disponible es una medida fluctuante durante el día.
La transferrina sérica y el hierro bajo pueden verse disminuidos en la deficiencia de hierro o en infección reciente o concurrente. Una medida más efectiva es la medición de los receptores de transferrina los cuales se elevan en la deficiencia de hierro. Así pues una Hb baja + ferritina baja + receptores de transferrina elevados = Anemia por deficiencia de hierro.
Pruebas diagnósticas: ferritina < 10 µg/l; Protoporfirina eritrocitaria >2,5 µg/gm Hb VCM < 72; Frotis de sangre periférica: puede ser normal inicialmente pero luego progresa a hipocromia,microcitosis y anisocitosis, ocasionalmente algunos eliptocitos pueden ser vistos; Hb: anemia cuando Hb < 95% para la edad.
Biopsia de médula ósea: normalmente el 10 a 20% de los precursores deben contener gránulos de hierro. En deficiencia de hierro pocos a ninguno los tiene.
Tratamiento
Debe iniciarse inmediatamente. La forma ferrosa del hierro es más fácilmente absorbida que la férrica y el tratamiento usualmente se da como sulfato ferroso. Los prematuros requieren de vitamina E debido a la poca ingesta, disminución de depósitos y poca absorción de la misma.
Una vez que el hierro inhibe la absorción de la vitamina E esta deficiencia se debe corregir antes de iniciar el hierro. La dosis de hierro para lactantes y niños es de 4-6 mg/kg de hierro elemental dependiendo de la severidad de la anemia en dos a tres dosis/día.
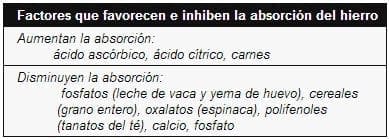
La absorción del hierro en el estómago vacío es aproximadamente el doble que en estómago lleno por lo cual se recomienda que se administre al menos una hora antes de comer. La duración del tratamiento es de dos a cuatro meses después que la Hb ha retomado sus valores normales.
La respuesta al tratamiento es evidente por un aumento en los reticulocitos en 5 a 10 días post-tratamiento. La falla de la terapia puede ser secundaria a absorción deficiente, diagnóstico incorrecto, perdidas actuales de sangre aumentadas, menor regeneración de Hb, dosis inadecuada, preparación inadecuada de hierro, enfermedad asociada (inflamatoria o maligna), no adherencia al tratamiento, por dolor abdominal, mal sabor y tinción de los dientes.
Efectos adversos por sobredosificación de hierro: dos conceptos importantes se deben tener en cuenta en el exceso de hierro: la deficiencia de vitamina E que puede resultar de la administración de hierro o fórmulas fortificadas para prematuros < 1500 g y la intoxicación por hierro por la ingesta accidental en niños con niveles de 300 µg/dl que producen diarrea, vómito, leucocitosis, hiperglicemia, lo cual se debe manejar con un lavado gástrico con una solución de bicarbonato al 1 ó 5% y administrar deferoxamina como agente quelante.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO