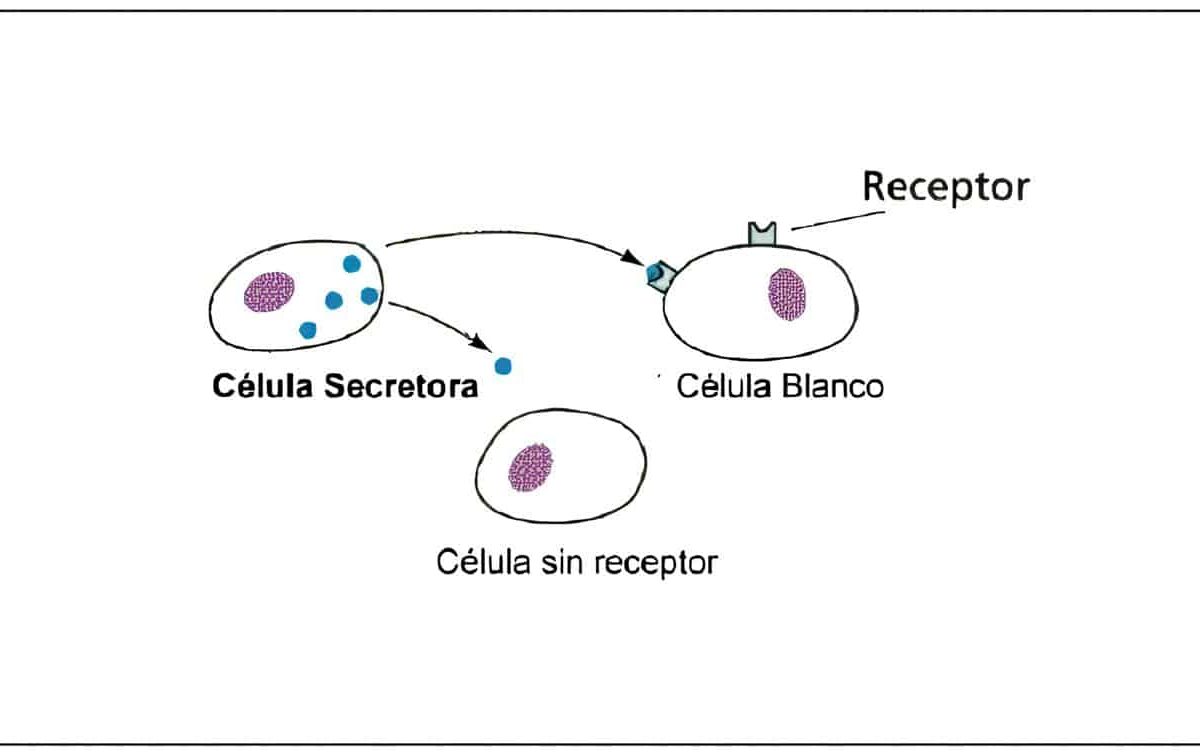
Capítulo XI
Dr. Germán Barón Castañeda, M.D.
TERCERA PARTE: Las Hormonas a lo Largo de la Vida
Buena parte del embarazo se encuentra bajo el control hormonal de la unidad feto-placentaria.
Desde el punto de vista endocrino las principales funciones comprenden la producción de hormonas por parte de las glándulas suprarrenales, las gónadas, la glándula tiroides y el páncreas fetales y por la placenta; la síntesis de hormonas peptídicas por la unidad hipotálamo-hipofisiaria del feto y por la placenta y la producción de hormonas en la glándula tiroides y el páncreas fetal.
Se cree que la placenta, como órgano productor de esteroides, tiene un sistema incompleto, motivo por el cual depende del adecuado aporte de precursores provenientes de las circulaciones materna y fetal. En la placenta el colesterol es convertido a pregnenolona y luego en forma rápida a progesterona. La producción de progesterona se aproxima a los 250 mg diarios hacia el final de la gestación. Para la síntesis de estrógenos, posee una capacidad de aromatización importante por lo cual utiliza como precursores andrógenos circulantes provenientes especialmente del feto, aunque también de la madre; el principal andrógeno utilizado es el sulfato de dehidroepiandrosterona (DHEAS) producido en las glándulas suprarrenales del feto. Una de las enzimas presentes en gran cantidad en la placenta es la sulfatasa, por medio de la cual la DHEAS es convertida en dehidroepiandrosterona (DHEA); el metabolismo continúa hacia la formación de androstendiona, testosterona y finalmente estrona y estradiol.
Durante el embarazo el principal estrógeno producido no es el estradiol sino el estriol:
Su concentración aumenta a lo largo de la gestación y varía desde aproximadamente 2 mg diarios en la semana 26 hasta 35 o 45 mg diarios en el embarazo a término. Se encuentran niveles elevados de estriol tanto en el líquido amniótico como en la circulación materna. En el suero materno su concentración es de 8 a 13 ng/dl.
La DHEAS en la placenta forma estrona y estradiol; es muy pequeña la cantidad de estos estrógenos que es convertida a estriol. Parte es 16-a-hidroxilado en el hígado fetal y en cantidad limitada en las suprarrenales. El sulfato de 16-a-DHEA así formado llega a la placenta, donde gracias a la acción de la sulfatasa lo aromatiza para formar estriol que es secretado hacia la circulación materna. En el hígado es conjugado para formar sulfato de estriol, glucosiduronato de estriol y un conjugado mixto, el sulfo-glucosiduronato de estriol, forma en la cual es excretado en la orina materna.
Progesterona
Se ha sugerido que la progesterona es la hormona esencial del embarazo, debido a su capacidad para inhibir la respuesta inmune que interviene en el rechazo de los tejidos. Esta hormona es producida en grandes cantidades por el cuerpo lúteo hasta la décima semana de gestación; después de un período de transición entre las siete y diez semanas, la placenta asume el control de su producción, con niveles que aumentan progresivamente, llegando al término a una concentración que varía entre 100 y 200 ng/ml; se calcula que la producción placentaria es alrededor de 250 mg diarios.
La mayor parte de la progesterona producida en la placenta ingresa a la circulación materna; su producción es independiente de la cantidad de precursor disponible, de la perfusión útero-placentaria, el bienestar fetal e incluso de la presencia de un feto vivo.
Esto se debe a que el feto no produce ningún precursor, sino que la mayoría es derivada del colesterol materno. El colesterol es transportado al trofoblasto en forma de LDL e ingresa a la célula por un proceso de endocitosis que se encuentra aumentado durante el embarazo por los estrógenos. Aunque no es claro el papel que juegan las hormonas tróficas, se ha sugerido que la HCG debe estar presente.
La decidua y las membranas fetales también sintetizan y metabolizan la progesterona pero no a partir del colesterol:
Posiblemente el sulfato de pregnenolona es el precursor más importante. Esta esteroidogénesis local puede tener un papel importante en la regulación del parto. La concentración de progesterona en el líquido amniótico es máxima entre las 10 y las 20 semanas, luego disminuye en forma progresiva. Los niveles en el miometrio son alrededor de tres veces superiores a los del plasma materno en el embarazo temprano, llegando a concentraciones similares en el embarazo a término.
En el embarazo temprano los niveles de 17-hidroxiprogesterona aumentan, marcando la actividad del cuerpo lúteo; hacia las 10 semanas regresan a su nivel basal, lo cual indica que la placenta tiene poca actividad de 17-hidroxilasa. Después de las 32 semanas aumenta en forma gradual debido a la utilización placentaria de precursores fetales.
Hay dos metabolitos activos de la progesterona que aumentan en forma significativa durante el embarazo: la 5-a-pregnane-3-20-diona que aumenta 10 veces y que contribuye al estado refractario de la gestación a la acción de la angiotensina II y la concentración de deoxicorticosterona que también aumenta 1200 veces respecto al estado no grávido, en parte debido a la elevación en la globulina transportadora de cortisol, pero en su mayoría por incremento de la 21-hidroxilación de la progesterona circulante en el riñón; hasta el momento no hay ningún dato concreto que explique la acción fisiológica de este aumento.
La progesterona tiene varias acciones durante el embarazo; es importante su intervención en el parto. Además se ha sugerido que es fundamental su efecto inmunomodulador, suprimiendo la respuesta materna a los antígenos fetales. Sirve también como sustrato para la síntesis de gluco y mineralocorticoides por la suprarrenal fetal.
Estrogenos
Los precursores básicos de los estrógenos son los andrógenos de 19 carbonos. Hay una ausencia virtual de la 17 hidroxilación y de la actividad de la 17,20 desmolasa (P450c17) en la placenta; como resultado los productos de 21 carbonos, progesterona y pregnenolona, no pueden ser convertidos a esteroides de 19 carbonos. El estrógeno producido en la placenta por el sistema de la P450arom debe derivarse de precursores provenientes de otras fuentes.
En la primera mitad del embarazo los precursores androgénicos son derivados de la circulación materna; posteriormente, los principales son de origen fetal. Aproximadamente el 90% del estriol es derivado de la DHEAS producida en la suprarrenal fetal.
El papel del estriol durante la gestación es bastante discutido, ya que es un estrógeno débil, con aproximadamente 0.01 veces la potencia biológica del estradiol. Parece ser muy efectivo en la capacidad de aumentar el flujo sanguíneo útero-placentario y este efecto a su vez parece depender de la estimulación de prostaglandinas.
La Suprarrenal Fetal
La glándula suprarrenal tiene gran tamaño durante el embarazo, en parte debido al desarrollo de la llamada zona fetal interna que constituye aproximadamente 80% de toda la glándula. El resto de la corteza consta de la zona definitiva externa o adulta destinada a formar la corteza suprarrenal del adulto. Este desarrollo es evidente hacia las siete semanas de gestación.
Los dos principales esteroides producidos son la DHEAS y el cortisol. La DHEAS es producida por la zona fetal, mientras que el cortisol lo es por la zona adulta. El precursor más importante en la síntesis de DHEAS parece ser el colesterol transportado por la LDL; puede provenir de la conversión directa de otros sulfatos de esteroides sin la pérdida de la cadena lateral de sulfato.
En la circulación fetal la concentración media de DHEAS en un embarazo a término es de 130 mg/dl, mientras que la de cortisol es más baja y varía entre 35 y 44 mg/dl. La concentración de cortisol en la sangre fetal y el líquido amniótico aumenta de forma progresiva durante las últimas semanas de gestación.
La ACTH regula la producción de cortisol por la zona definitiva, pudiendo también estimular la síntesis de DHEAS en la zona fetal. Durante el embarazo temprano no es indispensable la presencia de la ACTH, ya que la producción de la suprarrenal también es regulada por la HCG.
A partir del nacimiento la zona fetal involuciona rápidamente, encontrándose ausente hacia el segundo o tercer mes de vida. Las observaciones en animales sugieren que esta zona puede transformarse en la zona fasciculada del adulto.
Los corticoides parecen tener un papel importante durante la gestación.
Pueden inducir el desarrollo y la maduración de múltiples sistemas enzimáticos en el hígado, incluyendo enzimas relacionadas con la síntesis de glucógeno hepático, tirosina-amino-transferasa, aspartato-amino-transferasa, arginina – sintetasa y fosfoenol-piruvato-carboxilasa.
La evidencia experimental en animales muestra que también pueden estimular la maduración de las células ß del páncreas, inducir la maduración del epitelio y la actividad de la fosfatasa alcalina en el intestino delgado, actuar en el cambio de la hemoglobina fetal a la del adulto. En los pulmones inducen la diferenciación de las células alveolares tipo II y estimulan la síntesis de surfactante pulmonar.
Se postula que las glándulas suprarrenales también pueden tener papel en la iniciación del trabajo de parto, ya que en ovejas se ha demostrado que el aumento de cortisol lo anticipa. Se sabe que antes del trabajo de parto hay cambios importantes en la tasa de secreción de estrógenos y progesterona, papel mediado posiblemente por el cortisol fetal.
La placenta impide el ingreso de corticoides maternos a la circulación fetal, convirtiendo rápidamente el cortisol a cortisona, gracias a la actividad de la 11-b-hidroxiesteroide deshidrogenasa, estimulada por el estrógeno placentario.
(Lea También: Hormonas Proteicas de la Decidua, la Placenta y las Membranas Fetales)
La esteroidogénesis de la suprarrenal tiene control autocrino y paracrino.
La suprarrenal puede producir inhibina, cuya subunidad a es preferencialmente aumentada por la ACTH. La activina aumenta la esteroidogénesis mediada por ACTH, mientras que inhibe la mitogénesis en las células suprarrenales del feto; este efecto no está presente en las células del adulto; in vitro lleva a un cambio en las células adrenales, aumentando la producción de cortisol y disminuyendo la de DHEA, efecto similar al observado después del nacimiento.
Los factores de crecimiento similares a la insulina también son importantes en mediar los efectos trópicos de la ACTH. La producción de IGF-II en la suprarrenal fetal es muy significativa y estimulada por la ACTH; se cree que tiene importancia en el crecimiento prenatal.
Las características especiales de secreción de la glándula suprarrenal fetal son debidas en forma exclusiva al medio rico en estrógenos, lo cual ha podido ser comprobado plenamente en estudios in vitro.
Las Gonadas Fetales
En el testículo, la testosterona es producida en las células intersticiales; es hormona indispensable para el desarrollo de los genitales masculinos. Los testículos tienen capacidad para sintetizar testosterona de novo durante la vida intrauterina. Gracias a la acción de la testosterona se desarrollan los genitales internos y su metabolito activo, la dihidrotestosterona es necesaria para el desarrollo de los genitales externos.
Además los testículos secretan una sustancia encargada de inhibir el desarrollo de los conductos de müller; esta hormona anti-mülleriana es producida en las células de Sertoli, sitio en el cual también se produce una proteína fijadora de andrógenos y de inhibina. Se ha postulado que la HCG puede regular la secreción testicular de testosterona.
Se sabe menos acerca de la función de los ovarios fetales. No está bien definido, pero se ha postulado que la producción de esteroides de 21 y de 19 carbonos es limitada dentro del ovario fetal. La inhibina es producida en el feto hacia la mitad de la gestación en las células de Leydig del testículo y en las de la granulosa en el ovario.
Metabolismo de los Esteroides
Una parte importante del metabolismo de los esteroides en el feto es la formación de productos conjugados con sulfato; este paso ocurre en varios órganos, incluyendo el pulmón, el intestino, el hígado y las suprarrenales. En las suprarrenales se forman diversos sulfatos de esteroides, entre ellos el sulfato de pregnenolona, el sulfato de 17-a-hidroxipregnenolona y la DHEAS.
El papel de estos sulfatos no está establecido, pero pueden servir como precursores de estrógenos placentarios y como reservorios de substratos disponibles para la síntesis de hormonas activas; se cree que también sirve como mecanismo protector, bloqueando la acción biológica de los esteroides presentes en grandes cantidades.
La placenta posee una gran cantidad de sulfatasa, lo cual le permite clivar los sulfatos de esteroides, dejando el esteroide libre. Cuando hay deficiencia de la sulfatasa placentaria hay disminución marcada de la excreción de estriol. Este trastorno es más frecuente en hombres, ya que se transmite como una característica recesiva ligada al X. Puede asociarse con la aparición de ictiosis. La evolución de los recién nacidos es satisfactoria, por lo cual se cree que no constituye una amenaza para la salud del lactante.
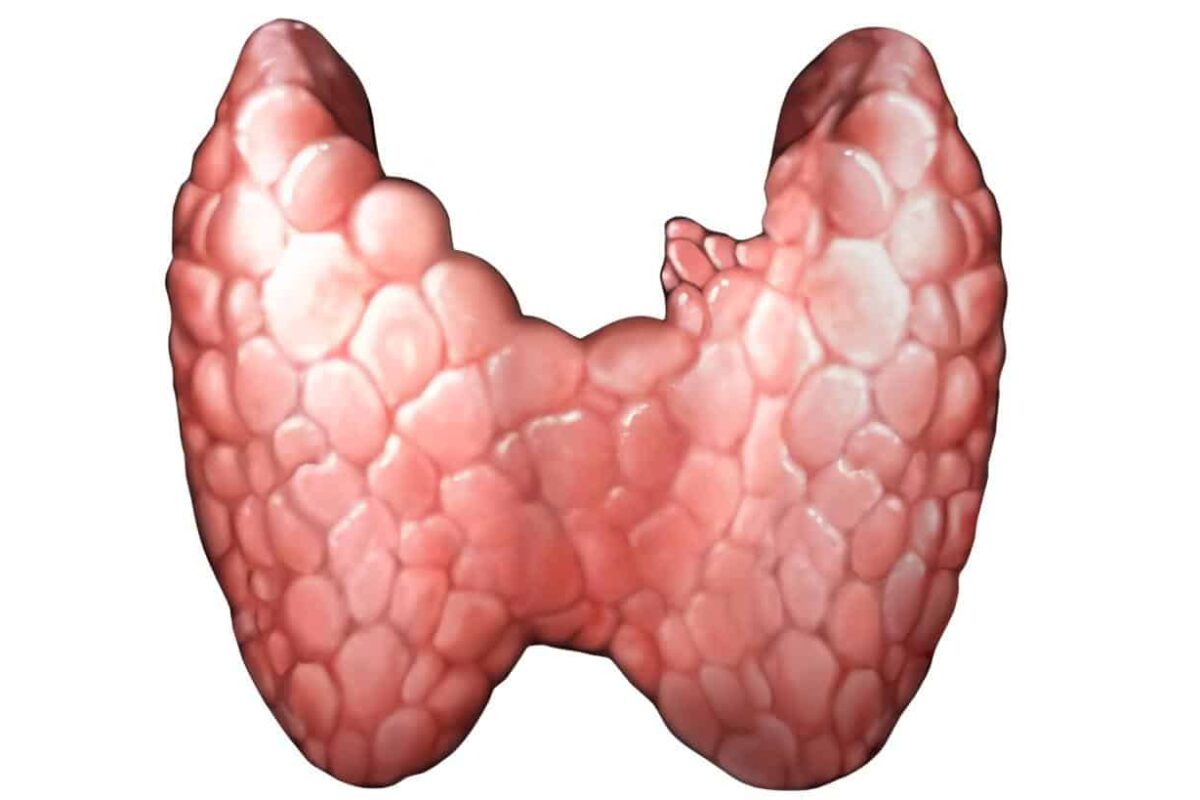
La Tiroides Fetal
En el feto la glándula tiroides adquiere su característica morfológica y la capacidad para concentrar yodo y sintetizar yodotironinas entre las 10 y las 12 semanas de gestación. Para la misma época aparecen los tirotropos en la hipófisis y puede encontrarse TSH en la hipófisis y circulante en el suero.
La función tiroidea permanece en estado basal hasta la mitad del embarazo, momento en el cual aumenta la actividad secretora y la concentración sérica de T4. La concentración máxima de TSH se encuentra al comienzo del tercer trimestre y no aumenta más hasta el término.
La concentración sérica de T3 no se puede medir hasta las 30 semanas de gestación, a partir de entonces aumenta a un nivel medio de 50 ng/dl hasta el término; este aumento es progresivo semanas antes del parto y puede estar relacionado con el aumento en la concentración de cortisol. Inmediatamente después del nacimiento el nivel de T3 circulante aumenta hasta 3 o 6 veces las concentraciones observadas in útero.
Por el contrario, la T3 reversa se encuentra elevada al comienzo del tercer trimestre y disminuye en forma progresiva hasta el término; permanece casi inalterada durante la vida extrauterina temprana.
La TSH hipofisiaria se eleva en forma rápida cuando el feto a término es expuesto al medio extrauterino; esto lleva a un aumento en la liberación de las hormonas tiroideas. La concentración máxima de TSH se encuentra 30 minutos después del nacimiento; a partir de entonces disminuye rápidamente durante el primer día y luego en forma más lenta durante los dos siguientes. Los niveles séricos de T4 y T4 libre llegan a un pico en 24 horas y luego disminuyen con lentitud durante las primeras semanas de vida.