La hipótesis básica en relación con la génesis de este síndrome es que la DCT es una propiedad intrínseca del sistema nervioso central producida por cambios en las conductancias iónicas intrínsecas dependientes de voltaje a nivel de las neuronas talámicas de relevo, a saber, la deinactivación de los canales de calcio tipo T por la hiperpolarización de la membrana celular.
El resultado de tal deinactivación es una oscilación talámica continua debido a la producción de las salvas de espigas de calcio de bajo umbral que sintonizan la porción afectada de los circuitos tálamo-corticales en un “attractor” de resonancia de baja frecuencia.
La continua recurrencia de frecuencias lentas disfacilita la corteza a la que proyectan generando los síntomas negativos de la DTC (parálisis en el Parkinson, sordera en los acúfenos, inatención en la psicosis).
Esta frecuencia baja, además, desinhibe los circuitos corticales anatómicamente relacionados dando lugar a una actividad de banda gamma, el “efecto borde”, y a la generación de síntomas positivos (temblor en el Parkinson, acúfenos, delirios y alucinaciones en la psicosis). (Lea también: Fisiología de la Cognición, Introspección, Realidad, Emulación y Cognición)
Cuando la causa es talámica, el mecanismo disrítmico es “ascendente” (bottom-up), del tálamo a la corteza.
En otras situaciones como la epilepsia o dolor neurogénico central, o en algunos trastornos neuropsiquiátricos de origen cortical, el mecanismo de la disritmia es “descendente” (top-down), y sería desencadenado por una reducción de la entrada córtico-talámica.
Ambas situaciones (ascendente o descendente) resultan en un exceso de inhibición a nivel talámico o disfacilitación, generando hiperpolarización de membrana y oscilación de baja frecuencia.
La propuesta es que el mismo mecanismo que es responsable de la génesis de la consciencia puede generar trastornos neuropsiquiátricos cuando se altera su organización y temporalidad.
En ambos casos se genera un atractor de baja frecuencia asociado a otro de alta frecuencia.
En conclusión, la cognición, propiedad de los ritmos tálamo-corticales, funcionaría en base a la coherencia temporal.
Cambios en esta dinámica resultan en estados neurológicos y psiquiátricos que pueden entenderse y abordarse clínicamente mediante administración de fármacos y en caso de estadios fármacorresistentes, mediante cirugía estereotáxica, con el fin de implantar electrodos para estimulación eléctrica profunda o microlesiones de puntos específicos en el circuito tálamocortical.

Placa 1.A. Imágenes de la actividad eléctrica de tajadas de corteza cerebral de roedores utilizando tinciones de fluorescencia voltaje sensitivas in vitro.
El color de la imagen representa el potencial de membrana de las neuronas teñidas cuando están despolarizadas (rojo) e hiperpolarizadas (morado) [ver barra de colores a la derecha]. Las líneas punteadas indican el borde cortical superior e inferior de la tajada.
Los puntos blancos representan la posición de los electrodos bipolares de estimulación en la sustancia blanca sub-cortical. Paneles superiores: Respuestas corticales promediadas a 5 ms (panel izquierdo) y 10 ms (panel derecho) después de la estimulación eléctrica sub-cortical repetida a 10 Hz. Paneles Inferiores.
Paradigma experimental igual a la de los paneles inferiores derecho e izquierdo pero con estimulación eléctrica a 40 Hz. Nótese que a los 10 ms de iniciada la estimulación a 10 Hz, la actividad cortical se difunde ampliamente sobre la corteza (izquierda, superior) mientras que, a 40 Hz, la activación cortical se convierte en columnar, lo cual demuestra que la geometría de la activación cortical es frecuencia dependiente (modificado de [12].
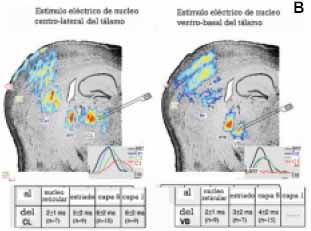
Placa 1.B. Imagen voltaje sensitiva de la actividad tálamo-cortical en una tajada cerebral de roedor in vitro.
Promedio de una serie de estímulos eléctricos aplicados sobre los núcleos talámicos CL (Centrolateral) [panel de la izquierda] y VB (Ventrobasal) [panel de la derecha]. La imagen generada por la conducción de la actividad evocada por la estimulación del CL y VB.
Esta imagen fue luego superpuesta directamente sobre la tinción de Nissl de la tajada cerebral una vez terminado el experimento para relacionar la imagen eléctrica con la anatomía de la tajada.
Tanto la estimulación CL como la VB activaban el núcleo reticular (NRT) y después el cuerpo estriado (ES). Las dos diferentes estimulaciones talámicas producen direntes activaciones corticales.
Así, mientras que la estimulación VB activaba las capas 4, 2/3 y 5, la estimulación CL activaba las capas 6, 5 y 1. Los recuadros de la izquierda y derecha corresponden, respectivamente, a perfiles individuales de píxeles que, tras la estimulación CL y VB, se activan sobre el núcleo reticular (líneas negras), en el cuerpo estriado/putamen (líneas azules), y en las capas 5 (líneas verdes) y 1 (líneas rojas), lo que ilustra las diferentes latencias de las respuestas a cada nivel.
El intervalo promedio entre el sitio de la estimulación y el punto del registro (medido como el intervalo entre el estímulo y el comienzo de las respuestas individuales de píxeles) se ilustra en la tabla adjunta bajo cada tajada (modificado de 17). Nótese la geometría de la actividad tálamo-cortical en la cual CL y VB activan capas alternantes de la corteza, especialmente en su porción superior.

Placa 1.C. Imagen del voltaje de la unificación temporal tálamocortical en una tajada de cerebro de roedor.
Esta imagen representa el mismo paradigma descrito en B. En este caso la respuesta a diez estímulos eléctricos repetidos a frecuencia gamma sobre los núcleos talámicos CL (panel superior), al VB (panel del medio) y tanto al VB como al CL (panel inferior).
Nótese la marcada suma de las respuestas cuando se estimula simultáneamente los núcleos CL y VB. A la derecha se muestran los perfiles de un píxel aislado tomado de la capa 5 durante las tres condiciones de estimulación. La suma es supralineal (modificado de 17).
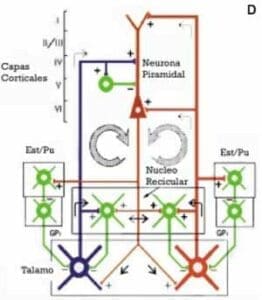
Placa 1.D. Diagrama de los dos sistemas tálamo-corticales.
Los núcleos específicos sensoriales o motores (azul) proyectan a la capa IV de la corteza produciendo una oscilación cortical debida a la activación directa y a la inhibición pre-alimentante generadas por las inter-neuronas que disparan a 40 Hz (verde). Los colaterales de estas proyecciones producen un efecto inhibitorio de retroalimentación a través del núcleo reticular tálamico (verde).
La vía de retorno (flecha circular izquierda) devuelve esta oscilación a los núcleos talámicos específicos y al núcleo reticular a través de las células piramidales de la capa VI (marron). La segunda retroalimentación (flecha circular derecha) muestra cómo los núcleos intralaminares inespecíficos proyectan a la capa más superficial de la corteza, con colaterales al núcleo reticular.
Las células piramidales de la capa V devuelven la oscilación a los núcleos talámicos inespecíficos y al núcleo reticular estableciendo así un segundo circuito resonante. Se propone que la conjunción de recurrencias específicos y no específicos genera la unificación cognitiva temporal.
Placa 2.A. Imágenes de MEG de un paciente con DTC Psiquiátrico. Gráficas de los espectros de energía en fTesla (paneles izquierda) y de coherencia de frecuencias (paneles de fondo azul a la derecha). Las gráficas superior izquierda: ilustran espectros de energía/frecuencia contra frecuencia promediados de seis sujetos control (azul) y de un registro típico de paciente con DTC (rojo).
En contraste a los registros en control, los pacientes con DTC demuestran un cambio de frecuencia con un ápice de energía/ frecuencia en el dominio theta y un aumento en las bandas theta y beta.
La gráfica a la derecha de la anterior ilustra el espectro de un paciente esquizoafectivo crónico farmacoresistente, antes (rojo) y después de la micro ablación selectiva MAS (azul) [25]. Los paneles de la derecha (fondo azul) ilustran el análisis de coherencia espectral de frecuencias entre 0 y 40 Hz.
El panel de la izquierda muestra los resultados de un sujeto control. Los paneles del medio y de la derecha ilustran los cambios en la coherencia espectral antes y después de una intervención quirúrgica tipo MAS (Modificado de [29]).
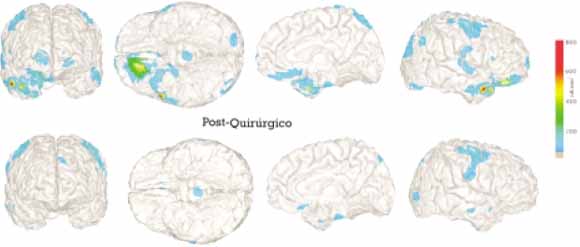
Placa 2.B. Localización de la fuente del MEG en un paciente esquizoafectivo tras AMS. Localización de la fuente del MEG en un paciente esquizoafectivo. Proyección de la actividad a 4-10 Hz en una imagen de RM de todo el cerebro antes (4 imágenes superiores) y después de una intervención tipo MAS (4 imágenes inferiores).
La DTC de este paciente se localizó en el dominio paralímbico derecho que comprendía áreas del polo temporal, y áreas parahipocámpica anterior, orbitofrontal y prefrontal basal medial bilateral. Estos focos de baja frecuencia desaparecen después de la intervención. (Modificado de [29]).
