La respuesta del TNF-a depende directamente de la unión a sus receptores. Esta citoquina cuenta con dos receptores estructuralmente diferentes denominados receptor tipo I (TNF-RI; p55 o p60) (Figura 8) y el receptor tipo II (TNF-RII; p80 o p75) (Figura 9).
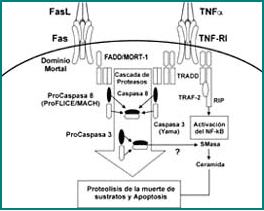 Figura 8. Cascada de señales intracelulares para el receptor tipo I del TNF-α.
Figura 8. Cascada de señales intracelulares para el receptor tipo I del TNF-α.
La cascada de señales intracelulares para el TNF-RI es compartida con el complejo Fas/Apo1. La unión del TNF-a homotrimérico al TNF-RI genera el reclutamiento de algunas proteínas de señal intracelular, tales como el TRADD y el TRAF-2. Estas proteínas representan la bifurcación de las señales del TNF-RI: la generación de señales apoptóticas a través de la caspasa-8 y la liberación de las propiedades proinflamatorias de los factores NIK y NF-kb.
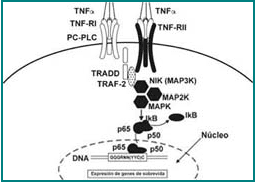 Figura 9. Cascada de señales intracelulares para el receptor tipo II del TNF.
Figura 9. Cascada de señales intracelulares para el receptor tipo II del TNF.
Contrario al TNF-RI, las señales para el TNF-RII no parecen involucrar dominios mortales, ni activación de apoptosis por la vía de las caspasas. Sin embargo, la unión del TNF-α al TNF-RII conduce a la activación de señales dependientes de los factores NIK y NF-kb.
Ambos receptores son glicoproteínas transmembranales y hacen parte de los 21 miembros de la familia de receptores TNF. Esta familia se caracteriza por tener múltiples regiones ricas en cisteinas, principalmente a nivel de su dominio extracelular N-terminal además de la presencia de dominios mortales dentro de su estructura. Estos receptores presentan una alta promiscuidad molecular con respecto a sus ligandos. Los dos receptores para el TNF están presentes en todos los tipos de células, excepto en eritrocitos. Generalmente, la distribución del TNF-RI es mucho más amplia que la del TNF-RII. La expresión del TNF-RI es generalmente constitutiva en muchos tipos de células, mientras que la expresión del TNF-RII se da en forma inducida. Ambos receptores se conocen por mediar en forma cooperativa o independiente, un amplio rango de respuestas celulares, como es el caso de proliferación, diferenciación, citotoxicidad o apoptosis celular. Además se han identificado formas solubles de ambos receptores (sTNF-R) en fluidos biológicos que parecen afectar de alguna manera la actividad biológica y la biodisponibilidad del TNF-α nivel sistémico3, 25.
Las funciones y la cinética de los dos receptores para el TNF-α parecen diferir significativamente. Hasta el momento se ha podido establecer que el TNF-RII responde principalmente a la forma transmembrana del TNF, lo que le confiere un papel principal en la respuesta inflamatoria local, sin embargo la función del TNF-RII es considerada como auxiliar en cuanto al control de la respuesta celular, mientras que el TNF-RI presenta una función dominante en la respuesta celular del TNF. De esta manera se encontró que sólo un estímulo adecuado de ambos receptores es capaz de causar una actividad citotóxica adecuada26. En cuanto a la cinética de interacción ligando-receptor para el TNF se encontró que los dos receptores difieren significativamente en cuanto a su afinidad de unión al TNF-α, a pesar de que la unión ligando-receptor se lleva a cabo con una alta afinidad y una rápida cinética de asociación. Sin embargo, se observa que la unión al TNF-RI es irreversible, mientras que la unión al TNF-RII presenta una asociación muy baja y una cinética bastante rápida27, esto ha llevado a explicar posibles diferencias en cuanto a la función de los receptores para el TNF-α.
Recientemente se ha planteado la posibilidad de que el TNF-RII pueda comportarse como un “paseador del ligando” ya que se ha observado que puede ligar el TNF-α y luego pasarlo al TNF-RI para potenciar la unión ligando-receptor y por ende la acción del TNF-α, cuando las concentraciones de éste son muy bajas3, 25-27 (Figura 10).
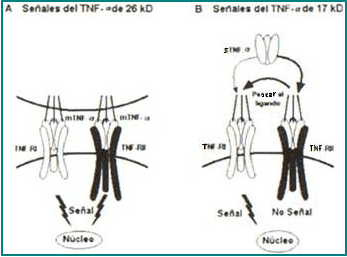 Figura 10. Paso del ligando del TNF-a.
Figura 10. Paso del ligando del TNF-a.
(A) El TNF-a de membrana se asocia al TNF-RII, el cual puede enviar una señal al núcleo celular y obtener la respuesta respectiva. (B) De otra parte, el TNF-a soluble, a bajas concentraciones, también puede estimular el TNF-RII al pasar el TNF-a desde el TNF-RI.
La actividad in vivo e in vitro del TNF-RI se ha asociado primordialmente con la respuesta inflamatoria por intermedio del TNF-α soluble (sTNF-α), bastante mayor que la que se presenta por intermedio del TNF-RII; además el receptor de p60 participa de forma importante en los procesos apoptóticos, mediados por las señales de dominio mortal, y por la vía de las moléculas Fas-FasL. De otra parte los dominios intracelulares del TNF-RI se unen a proteínas de interacción con receptores (RIP) que con la ayuda de las proteínas de dominio mortal asociadas al receptor TNF-RI (TRADD) pueden generar una bifurcación en las vías de acción bien sea hacia apoptosis o hacia la vía de señales proinflamatorias por intermedio del factor NF-kB, así mismo el TNF-RII también está involucrado en los procesos apoptóticos del TNF-α, aunque por una vía diferente a la del p60, ya que en éste caso participan las moléculas TRAF3.
En resumen, la función principal del TNF-RI es la de interactuar con la forma soluble de 17 kD del TNF-α y regular los procesos proinflamatorios y apoptóticos de esta citoquina. El TNF-RII, en cambio, tiene su interacción principal con la forma de membrana del TNF-α (26 kD), cumpliendo un papel clave en la respuesta tisular local, como es el caso de la artritis reumatoidea. Además, este receptor tiene también participación en la unión del sTNF-α, aunque de forma menos significativa y es el encargado de generar un intercambio de ligando para potenciar la acción del TNF-RI.