Dra. Susana Murcia.
Profesora Titular de Patología Departamento de Patología. Facultad de Medicina Universidad Nacional de Colombia.
Hospital de la Misericordia Bogotá
Historia Clínica
Paciente masculino, natural y procedente de área rural de Caquetá. Consulta a los dos meses por tos húmeda sin fiebre y se le administra oxacilina, ceftriaxona, nebulizaciones con beta2 y metilprednisolona con mínima mejoría.
Antecedentes: Producto de quinto embarazo, madre joven con amenaza de aborto a los 4 meses, parto a las 37 semanas. Un hermano fué hospitalizado al 5 día de nacido, por diarrea y deshidratación; vacunas ninguna.
A los tres meses de edad se hospitaliza por exacerbación de su cuadro respiratorio y deposiciones diarréicas (6 al día, de un día de evolución); se encuentra paciente de 3.5Kg; FR:67 x min; FC: 126x min; TA: 127/63; mala perfusión, hipoactividad, deshidratación II, dificultad respiratoria, cianosis, roncus diseminados, murmullo vesicular disminuido, hígado palpable a 2cm PDRCD. Se inicia ventilación asistida, se administra vancomicina, imipenem y soporte inotrópico y se remite. Llega en precarias condiciones, con distensión abdominal y se pasa a UCI, los exámenes de laboratorio muestran Hb: 10g/dl.; Glóbulos blancos: 12.000; N: 65%; Linfos: 34%; Cayados: 3%; secreción traqueal negativa para BK. Por persistencia del cuadro bronco-obstructivo se intuba.
Presenta petequias, por plaquetonia de 50.000, y se maneja con plasma y heparina. Hace intolerancia a la vía oral y se inicia tratamiento con nutrición parenteral. El cultivo de secreción traqueal es positivo para Serratia Marcasens, y Pseudomona y se añade ciprofloxacilina. Se reliza iontoforesis y el valor fue de 55 meq. Al cuarto día se retira tubo endotraqueal, tolerando mal este procedimiento; se realiza broncoscopia que muestra endobronquitis y traqueitis severas, se añaden corticoides sistémicos.
Al octavo día por mejoría se retira el tubo traqueal nuevamente y se traslada a piso. El control de tórax muestra atelectasia apical e hiperinsuflación del pulmón derecho, se pasa a dieta enteral por sonda nasogástrica, pero continúa presentando diarrea; se añade trimetoprín-sulfa, teofilina, salbutamol y beclometasona inhaladas y terapia respiratoria. Hay mejoría parcial y se da salida.
Reingresa 25 días después con fiebre, edad 4 meses, peso de 3.3Kg; FC: 186 x min.; FR: 42 x min.; dificultad respiratoria severa, Rx con atrapamiento aéreo; se inicia oxacilina y ceftazidime; por cuadro de anemia se trasfunden glóbulos rojos empaquetados; presenta vómito frecuente y se hace gastrostomía, pero presenta episodios de distensión abdominal y pobre intolerancia a la vía enteral.
El cuadro respiratorio 20 días después permanece inmodificable; requiere nuevamente manejo en UCI; se cubre con vancomicina, cefepime y fluconazol durante 8 días, con mejoría parcial. Presenta nuevamente deshidratación severa por diarrea y se sospecha infección por hongos, por lo que se añade Anfotericina B. Presenta sangrado digestivo, se administra omeprazol y nutrición parenteral total. A los 10 días hace ictericia y cuadro de hipertensión arterial que requiere nitroprusiato. Se detecta cuadro séptico con diarrea severa, sangrado digestivo, bradipnea, acidosis respiratoria severa, hipoglicemia de 50mg. Se da soporte inotrópico y no responde falleciendo con taquicardia ventricular y asistolia.
Diagnósticos Clínicos Finales. Shock Séptico, Sepsis de origen pulmonar y gastrointestinal. Bronconeumonía, Enfermedad isquémica intestinal, Neumopatía crónica por secuelas de Bronquiolitis, Desnutrición severa. Desequilibrio ácido base. Fibrosis quística.
Resultados de la Autopsia: El paciente de 7 meses de edad presentaba un estado avanzado de caquexia, marcada hipotrofia de masas musculares, peso 3.4Kg y talla 57cm, sin ictericia, gran distensión abdominal, hidrotórax cetrino bilateral de 80 cc a cada lado, ascitis 50cc, hemorrágica, sin malformaciones congénitas a ningún nivel; en aparato respiratorio, laringotraqueitis con membranas amarillentas en la mucosa, tapones mucopurulentos densos en los bronquios, pleuritis fibrinosa, adenomegalias mediastinales hasta de 2cm de diámetro, pulmones hipocrepitantes con múltiples nodulaciones de centro blanco en todos los lóbulos, que al corte corresponden a abscesos que drenan material purulento; en tracto digestivo, asas intestinales dilatadas, violáceas con serosa opaca, hepatomegalia con mínimo cambio graso, páncreas pequeño, y firme.
El estudio histológico confirma un severo cuadro de bronquiectasias y bronquioloectasias, con bronconeumonía abscedificada multilobar. En el páncreas, atrofia de acinos reemplazados por tejido fibroso, ductus dilatados con tapones eosinófilos.
En las asas intestinales delgadas, cambios de isquemia de la mucosa, con marcada vasodilatación submucosa y mínima respuesta inflamatoria; en el testículo se encuentra un epidídimo mal desarrollado con unos conductos hipoplásicos, separados por un estroma fibroso abundante.
Diagnósticos Definitivos
1. Fibrosis quística (mucoviscidosis) con: atrofia pancreática severa, bronquiectasias y bronquioloectasias, bronconeumonía abscedificada, epidídimo hipoplásico, tapones mucosos en glándulas mucosas de múltiples órganos (Fig, 1, y 2).
2. Desnutrición marasmática mixta severa
3. Enterocolitis necrosante
4. Esofagitis de reflujo
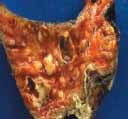
Fig. 1 Aspecto macroscópico de las lesiones abscedificadas del pulmón.
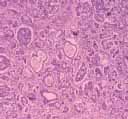
Fig. 2 Aspecto microscópico del páncreas con atrofia importante que explica la insuficiencia del órgano.
Comentarios
El cuadro de infecciones respiratorias de aparición muy temprana acompañadas de diarreas a repetición, infección por Pseudomona y la falla en la ganancia de peso soportan clínicamente el diagnóstico de «Fibrosis quística», que se comprueba con los hallazgos histológicos de bronquiectasias, de fibrosis del páncreas y de cambio quístico de los conductos de ésta glándula; la negatividad de la iontoforesis puede explicarse por el severo estado de desnutrición del paciente.
Las causas de muerte se relacionan con cuadro de choque séptico y falla respiratoria, el proceso infeccioso broncopulmonar sobreagregado y la enterocolitis necrosante que aparece como resultado de hipovolemia, hipoperfusión e hipoxia de muy difícil control en los últimos días de vida del paciente.
La fibrosis quística es un trastorno metabólico autosómico recesivo causado por mutaciones de un gene localizado en el brazo largo del cromosoma 7. El producto de esta mutación es un gene denominado «regulador de la conductancia transmembrana de la fibrosis quística de 1480 aminoácidos» que participa en el transporte de electrolitos a través de las membranas de las células epiteliales y probablemente a través de las membranas intracelulares. Existen cerca de 1.000 mutaciones del gene y la más frecuente es la deleción que ocasiona la pérdida de tres nucleótidos que codifican la fenilalanina, en la posición delta F508; esta mutación se encuentra en el 70% de los pacientes de raza caucásica y en Colombia se ha detectado en el 48% de los pacientes con la enfermedad.1,2
Mundialmente se ha establecido que la rata de portadores es de 5-6% y la incidencia de 1:1500-2500 nacidos vivos; muy rara vez aparece en la raza negra 2,3. De las formas homozigota o heterozigota, va a depender la severidad del cuadro clínico1; cada uno de los hijos de un portador tiene una probabilidad de 1:4 de desarrollar la enfermedad.
En el paciente afectado, la secreción muy disminuida de cloro, bicarbonato y agua, afecta todas las glándulas exocrinas y en consecuencia, el jugo pancreático y todas las secreciones glandulares contienen moco muy espeso con poca agua y gran contenido de proteínas, dificultándose el drenaje libre de esos productos. Los órganos con mayor compromiso son el páncreas, los bronquios, el tracto gastrointestinal, los conductos genitales masculinos y femeninos, el hígado y las vías biliares. El páncreas tiene pérdida gradual de su forma y su aspecto seudo-lobulado, se vuelve pequeño, firme y pálido. La obstrucción de los conductos produce retención de secreciones atrofia y fibrosis con desaparición de la porción exocrina.
En el aparato respiratorio el tórax está ensanchado, hay adherencias pleurales, el parenquima pulmonar muestra enfisema, áreas de hemorragia, consolidación, abscesos, bronquiectasias y bronquioloectasias en todos los lóbulos, siendo más frecuentes en los lóbulos superiores. Se ven tapones mucopurulentos adherentes en el árbol traqueobronquial, en donde se cultiva muy frecuentemente Seudomona aureoginosa, Estafilococo aureus, Hemofilus influenzae y Burkolderia cepácia1.
En los senos paranasales hay sinusitis, en las fosas nasales pólipos, detectables desde los dos años de edad. En el tracto gastrointestinal se ven secreciones espesas en la luz, glándulas mucosas de todo el intestino desde el duodeno, dilatadas con aumento de células caliciformes. Otras complicaciones encontradas son atresias intestinales, íleo meconial, peritonitis por meconio, apendicitis, cuadros seudo-obstructivos con dolor abdominal recurrente, mayor tendencia al RGE, vólvulus, prolapso rectal, neumatosis intestinal, enterocolitis necrosante, y colonopatía fibrosante.
En el hígado y en las vías biliares se ve: metamorfosis grasa, tapones de moco y de bilis en los conductos biliares, inflamación periductal, leve fibrosis temprana que puede evolucionar a cirrosis biliar secundaria, vesícula biliar hipoplásica, con cálculos arenosos y bilis muy espesa o moco. En los órganos genitales masculinos el epidídimo es hipoplásico, los canales eferentes ciegos, hay ausencia de conductos deferentes o sin luz y las vesículas seminales hipoplásicas y de difícil identificación.
En la mujer, tapones mucosos en el cuello y en la trompa uterina.
La clínica depende de los órganos afectados y generalmente el tracto respiratorio y el digestivo son los más sintomáticos.
El diagnóstico debe hacerse con base en la historia clínica por medio de:
• La prueba del sudor o iontoforesis con estimulación con pilocarpina; ésta detecta niveles anormales de electrolitos en sudor con cifras superiores o iguales a 80 mmol/l que se consideran fuertemente positivos; niveles inferiores hasta 40 mmol/l pueden verse en pacientes con la enfermedad.3-5 Los falsos negativos se presentan en muestras muy escasas de sudor, pacientes desnutridos o con severo edema, en tratamiento con esteroides y diuréticos, en los sometidos a dietas hiper o hiposódicas.
Los falsos positivos se ven por mala técnica con evaporación de la muestra o error de cálculo, en la primera semana de la vida, en los desnutridos, en enfermedades metabólicas como glucogenosis tipo I, mucopolisacaridosis y fucosidosis, en trastornos endocrinos como hipotiroidismo, hipoparatiroidismo, insuficiencia suprarrenal y diabetes insípida, en la dermatitis, atópica, en infecciones respiratorias agudas por epiglotitis, difteria o neumonía viral o en trastornos respiratorios crónicos severos por déficit de Alfa-1-antitripsina y displasia broncopulmonar.
• La determinación del Genotipo por si sola no establece el diagnóstico. Se dispone de algo mas de 70 pruebas para detectar una buena parte, (90%), de las múltiples mutaciones. además se sabe que un 1% de los pacientes no tiene mutación detectable y en un 18% hay mas de una mutación y en estos pacientes puede dar normal ella prueba del sudor2,3.
• Análisis de ADN buscando dos de las mutaciones conocidas causantes de enfermedad en un paciente con una clínica característica.1
• Medición del defecto electrofisiológico epitelial por diferencia de potencial nasal (Knowles citado por Orenstein.1
• La cuantificación de albúmina en el meconio: en estos pacientes tiene una concentración superior a los 3 mg/g de meconio.
• La Medición de enzimas pancreáticas: tripsina, amilasa y lipasa en aspirado duodenal, las cuales están bajas.
• Las imágenes que muestran en la placa simple calcificaciones, engrosamiento de pliegues duodenales y yeyunales defectos de llenado, mucosa redundante y dilatación. En la ultrasonografía, la TAC y la RM se rastrea el progreso de la enfermedad: el páncreas aparece pequeño, con atrofia difusa y cambio graso.
• Las pruebas prenatales se recomiendan en la familia con un miembro afectado ; se determina en celulas fetales en muestreo de las vellosidades coriónicas desde las 10 semanas o por amniocentesis entre 15 y 18 semanas
El Tratamiento se basa en la reposición de enzimas pancreáticas, la sustitución de las vitaminas y la solución de los problemas secundarios, en especial la prevención de la infección pulmonar o el tratamiento oportuno de ésta y de la obstrucción bronquial. El transplante del pulmón se ha empleado para enfermedad pulmonar terminal6.
Referencias
1. Orenstein DM, Winie GB, Altman H: Cystic fibrosis : A 2002 update. J Pediat 2002;140:156-164.
2. Keiyeux G, Sanchez D, Garavito P et al: Estudios moleculares en pacientes colombianos con fibrosis quística. Acta Med Col 1997; 22:167.
3. Kerem E Corey M Kerem BS et al: The relation between genotype and phenotype in cystic fibrosis. Analisis of the most common mutation delta f508. N Eng J Med 1990:327: 1517.
4. Sarmiento F, Echeverri. J., Ardila MC., et al: Manifestaciones clínicas poco frecuentes de la fibrosis quística. Pediatría 2000; 35: 268- 270.
5. Stafford RJ, Grand RJ, Hereditary diseases of the exocrine pancreas. Clin Gastroenterol 1982; 12: 141.
6. López MJ, Grand RJ; Trastornos del páncreas hereditarios y de la infancia en Sleisenger M et al: Enfermedades Gastrointestinales. Fisiopatología Diagnóstico y Tratamiento. México, Panamericana 1994: 613.
