La lesión primaria causa daño histológico en el parenquima renal y las alteraciones y adaptaciones de las nefronas restantes causan cicatrices y más pérdidas de nefronas, lo cual perpetúa el círculo vicioso que conlleva a la insuficiencia renal terminal. Las características genéticas del individuo y la fisiopatología de la entidad modifican la progresión de esta.
El parénquima renal tiene una gran reserva y, una vez se pierde la actividad de uno de los riñones, el otro aumenta su capacidad de filtración de manera compensadora. A los 2 a 3 meses se ha incrementado el tamaño en la mitad y la y la filtración glomerular residual es un 10 a 20 % más de lo inicial. Para que se produzca IRC se requiere que se pierda más del 50% de las nefronas funcionantes con una lesión asociada en el parénquima. Según el porcentaje de nefronas funcionantes se presentan las manifestaciones de la IRC. Con el 50% de nefronas se tiene una FG entre 80-100% sin representación clínica, hasta menos del 5% en la cual la FG es <10% con ERET. Tabla 103,5,14.
(5)Tabla No. 10. Estadios de la insuficiencia renal

Como factores genéticos que incrementan la progresión de lesión en el parénquima se encuentra el HLA DR3 de los caucásicos que se asocia a mayor esclerosis en el parénquima asÍ como enfermedades sistémicas de base con compromiso renal como Diabetes Mellitus y LES3,14.
Factores asociados: Hipertensión: La hipertension sistémica acompaña a la insuficiencia y es resultado y causa de la enfermedad renal terminal acelerando la IRC. La tensión arterial sistémica es regulada en las arteriolas aferente y eferente. La adaptación inadecuada frente a lesiones glomerulares conlleva a hiperfiltración, glomeruloesclerosis, hiperplasia e hipertrofia de las nefronas perpetuando el ciÍrculo vicioso. Los manejos que aumentan la presión capilar como erytropoietina, corticoesterioides o dietas hiperprotéicas aumentan la glomeruloesclerosis, así como nefritis de base junto con uninefrectomía. Las células mesangiales son sometidas a períodos de relajación, contracción, los cuales producen citoquinas que afectan la proliferación de células glomerulares y de la matriz. Se han postulado los inhibidores de la ECA (enzima comvertidora de angiotensina I a II) como protectores al disminuir la presión capilar, dilatar la arteriola eferente, inhibir la kinasa y activar la bradiquinina. Sin embargo se ha observado que la hipertensión y la hiperperfusión no se correlacionan directamente con el grado de daño glomerular y se ha visto que la glomeruloesclerosis se puede desarrollar sin hipertensión. El aumento en la presión de la pared endotelial combinado con un aumento de las presiones intrarrenales llevan a la glomeruloesclerosis, lo cual sucede a lo largo de los capilares sin afectar el diametro de estos y este fenomeno es modulado por la Tensión Arterial sistémica9.
Factores de crecimiento: Después de la pérdida inicial de nefronas los factores de crecimiento se producen y actúan en los glomérulos restantes. Se han propuesto la hiperlipidemia, alteraciones hemodinámicas, aumento del metabolismo glomerular, hipercoagulabilidad y depósito mesangial macromolecular como factores que aceleran la proliferación mesangial (crecimiento centripeto y diferenciación). Se han implicado el factor de crecimiento derivado de plaquetas (PDGF), factor beta de crecimiento transformante (TGF b), TGF alfa, factor 1 de crecimiento semejante a insulina (IGF-I) , hormona de crecimiento, factor de crecimiento epidérmico (EGF), interleukinas (IL 1 y 6), factor alfa de necrosis tumoral (TNF a), angiotensina-II, factor de crecimiento de fibroblasto básico (FGF), endotelina, como aceleradores del crecimiento mesangial y la esclerosis. Estudios recientes en niños tratados con hormona de crecimiento han mostrado un incremento en la esclerosis secundaria a la activación de la función de los linfocitos T y B y su secreción de citoquinas. Se ha observado que la angiotensina II regula la expresión de los otros factores de crecimiento sobre todo FGF, PDGF y TGF b, asi como induce la activación del inhibidor del plasminógeno (favoreciendo la trombosis). Por lo anteriormente expuesto se explica el efecto benéfico de los inhibidores de la ECA y del receptor antagonista de angiotensina I (AT-1) en el manejo de la IRC. La angiotensina II tiene efecto directo vascular al promover la migracion endotelial y de músculo liso vascular, así como hipertrofia e hiperplasia de músculo liso y células mesangiales. Esta sustancia se encuentra en los monocitos por lo cual también regula la respuesta inmune. Recientes hallazgos han implicado el receptor de angiotensina II (AT-2) en la inhibición del crecimiento y apoptosis en la lesión vascular y remodelación, por lo tanto el efecto neto depende del balance entre AT-1 y AT-2. Los factores de crecimiento también son producidos localmente por estímulos como aumento de presión hidráulica, radicales libres de O2, alteración del metabolismo de lípidos, depósito mesangial de macromoléculas y hemostasis anormal9.
Progresión de las células glomerulares: En la remodelación de la matriz no solo intervienen los factores de crecimiento, también actúan activadores e inhibidores del plasminógeno así como colagenasas. Las células endoteliales por si mismas liberan citoquinas que afectan el tono vascular y moléculas de adhesión para las células circulantes. Normalmente las células endoteliales inhiben la migracion de músculo liso y proliferación, pero cuando son lesionadas liberan los factores de crecimiento anteriormente mencionados que estimulan la proliferacion de la matriz lipoproteinas y acumulación de colesterol. Así mismo las células son blanco de anticuerpos y de reacciones inmunes en las glomerulonefritis mediadas por este tipo de reacción. La limitada respuesta de la célula para la hiperplasia lleva al daño celular y áreas denudadas en la formación de cicatriz. La célula visceral glomerular produce una sustancia similar a la heparina la cual inhibe la proliferacion del mesangio, esta sustancia se encuentra disminuida en la IRC. También produce factor de crecimiento del endotelio vascular (VEGF) que estimula la angiogénesis y la permeabilidad vascular. La interacción entre las integrinas de las células epiteliales y los anticuerpos contra las b integrinas llevan a agrandamiento de los poros e incrementan la proteinuria. La esclerosis finalmente produce obliteración de los capilares y es secundaria a todos los cambios del mesangio que responde igual que las células epiteliales con hiperplasia e hipertrofia regulada por angiotensina II, PDGF, IGF-I y TGF b9.
Factores dietarios: La dieta rica en proteínas acelera la progresión a enfermedad renal por aumento en la actividad de los genes del sistema renina- angiotensina-aldosterona, así como el calcio, sodio, fosfato y grasas. Las dietas bajas en proteínas alteran la función de los linfocitos T, disminuye la migración de macrófagos, la precipitación de calcio y fosfato que producen daño tubular, proteinuria y radicales libres de O2. Las dietas bajas en sal disminuyen la presión arterial sistémica y por lo tanto se atenúa la proliferación glomerular y la esclerosis9.
Lípidos e hiperlipidemia: Son moduladores de la esclerosis en estudios realizados en ratas, por disminución de lecitin colesterol acil trasferasa y apolipoproteina E. Se ha postulado que los niveles elevados de colesterol favorecen al migración de macrófagos como paso inicial para la glomeruloesclerosis. Los ácidos grasos esenciales protegen contra este efecto. Así mismo la proteinuria entre mas severa en la enfermedad glomerular produce mas daño tubular e inflamación del intersticio9.
Trombosis y fibrinolisis: Los anticoagulantes e inhibidores de la agregación plaquetaria inhiben in vivo la esclerosis y proliferación de células mesangiales. Este efecto se debe a la prevención de microtrombos, e inhibición de la activación de monocitos y plaquetas impidiendo la liberación de citoquinas. El plasminógeno es el principal factor degradador de glucoproteinas de la matriz y remodelacion vascular y el aumento de las concentraciones de inhibidor del plasminógeno (PAI-1), aumenta la glomeruloesclerosis en los modelos animales. También se ha observado que la angiotensina II incrementa los niveles de (PAI-1), por lo tanto el uso de inhibidores de la ECA modularia la actividad trombótica/fibrinolítica y la remodelación9.
Adaptación a la Pérdida de Masa Renal
Glomerular: Con la pérdida de masa renal el tejido restante sufre cambios con hipertensión capilar intraglomerular hipertrofia, e hiperfiltación que pueden ser deletereos.en la evolución a largo plazo de la función renal3,5.
Electrolitos: En condiciones normales más del 99% del sodio filtrado es reabsorbido, el 1% restante es excretado. Al disminuir la filtración glomerular se reabsorbe cada vez menos y se excreta más gracias a la producción tubular de urodilatina (peptido natriurético urinario) la cual compensa la incapacidad del riñón por lesión tubular a excretar por si mismo la sobrecarga de sodio. También con la administración de cargas de sodio aumenta su concentración en el líquido extracelular (LEC), las cuales se tratan de eliminar con la producción de peptidos natriuréticos13. En cuanto al potasio, normalmente el 90% de la ingesta diaria es eliminada en la orina y su equilibrio se mantiene hasta una velocidad de filtración glomerular (FG) < 10%. En la IRC con aumento de la secreción de aldosterona se activa la bomba de Na-K ATPasa incrementando las pérdidas de este ion en túbulo distal y colon. Si la IRC cursa con hipoaldosteronismo hiporreninémico hay tendencia a la hiperkalemia, la cual es mayor si se administran inhibidores de la ECA o diuréticos ahorradores de K. La acidosis metabólica es común en los pacientes con IRC cuando la FG es menor del 50%. El equilibrio ácido base se mantiene por la reabsorcion de bicarbonato en el túbulo proximal y secreción de hidrogeniones en el túbulo distal (2-3 mEq/kg/dia). En IRC disminuye la reabsorción de bicarbonato, aumenta la liberación de iones hidroxilo (los cuales aceptan hidrogeniones) y calcio con la resorción ósea y disminuye la síntesis total de amonio por lo cual se llega a la alteración en el estado ácido-base. La alcalosis metabólica es rara si se mantiene el LEC porque la excreción renal de bicarbonato se mantiene. Solo si la FG disminuye a valores muy bajos y se administra oralmente bicarbonato se puede ocasionar alcalosis. En la mayoría de los casos el balance de agua se mantiene hasta las etapas finales. La capacidad de concentrar se limita por destrucción del tejido intramedular secundario a hidronefrosis o displasía, o diuresis inducida por la úrea. En la IRC disminuye la capacidad para retener agua y evitar la deshidratación o para eliminar, evitando la sobrecarga, por lo tanto el volumen urinario depende de la carga osmótica. Un niño con una ingesta elevada de sal y proteínas presentará poliuria, y para disminuir su diuresis se baja la ingesta de sal y proteínas5. Tanto la ingesta como la excreción de calcio están disminuidas en la IRC. La absorción neta de calcio a nivel intestinal esta disminuida por descenso en los niveles de 1,25 dihidroxivitamina D3 (producción renal). Así mismo de forma compensatoria aumenta la liberación de PTH llevando a liberación de calcio óseo y reabsorción renal de calcio. A medida que aumenta la IRC es mayor la excreción fraccionada de calcio renal y puede ocurrir hipercalciuria e hipercalcemia, cuando se administra calcio y metabolitos activos de la vitamina D para la prevención de la osteodistrofia renal. La ingesta de fósforo y la liberación ósea se mantienen elevadas en pacientes con IRC, así como aumenta la eliminación renal de fosfatos. De forma compensatoria a la hiperfosfatemia disminuye el calcio sérico y aumenta la PTH. Se ha observado que limitando la ingesta de fósforo disminuye la excreción de fosfatos y aumentan los niveles plasmáticos de 1,25 dihidroxivitamina D3 y es independiente de la PTH5. Los niveles séricos de úrea aumentan proporcionalmente a la disminución de la FG. La depuración de la úrea subestima la FG por la reabsorción medular de úrea3,5.
Toxinas Metabólicas: La elevación de los niveles séricos de urea se correlaciona con toxicidad. Si los niveles de BUN son mayores de 100 mg/dl se presenta letargia, parestesias y hemorragia por disfunción plaquetaria. Tambien se ha demostrado incremento sérico de numerosas sustancias tóxicas como PTH, guanidinas, metilaminas, fenoles y poliaminas que se suman a la toxicidad por úrea3,5.
Adaptación metabólica: La IRC se asocia con hiperinsulinemia periférica y resistencia periférica a esta en músculo y tejido adiposo. La resistencia es intracelular porque la unión al receptor es normal, no se afecta la entrada de potasio ni de aminoácidos a la célula y la gluconeogénesis es normal. Se ha asociado el hiperparatiroidismo a disminución en la secreción de insulina5.
La síntesis de proteínas en IRC no cambia, disminuye en estado basal y este descenso es aún mayor en estados de estrés metabolico. Los niveles de leucina se usan para medir el recambio protéico y se elevan con la diálisis crónica y están bajas antes de diálisis . La síntesis de proteínas también disminuye debido a la resistencia periférica a la hormona de crecimiento y al hiperparatiroidismo de manera indirecta y su efecto en la secreción de insulina5. La acidosis metabólica incrementa la degradación protéica activando los proteasomas dependientes de ATP y al corregir la acidosis se ha observado mejoría en la magnitud de degradación protéica, síntesis de albúmina, degradación de miofibrillas protéicas y mejor balance nitrogenado. La acidosis también disminuye los niveles de GH/IGF-I (factor de crecimiento 1 semejante a la insulina) alterando aún más el crecimiento. Los niveles de aminoácidos se alteran debido a la disminución de la secreción o a la uremia per se. Los aminoacidos esenciales en especial los ramificados disminuyen y los no esenciales aumentan. Las concentraciones intracelulares también se afectan y la concentración de valina en músculo constantemente está disminuida. El manejo dietario tratando de corregir estas alteraciones no ha dado resultados3,5.
Metabolismo de Lípidos: En los pacientes con IRC son frecuentes la hipertrigliceridermia e hipercolesterolemia, con disminución de HDL. Las alteraciones de las apolipoproteínas incluyen diminución de los niveles de A-I y A-II, principales componentes del HDL, así como incrementos en las apolipoproteínas C-II y C-III. También disminuyen la lipoproteinlipasa y la lipasa hepática de triglicéridos, sin embargo la lipoproteinemia es un factor de riesgo independiente para desarrollar arteriosclerosis 3,5 y sus niveles aumentan en IRC antes y después de diálisis5. Sin embargo los niveles séricos de lípidos no se correlacionan con el riesgo de enfermedad cardiovascular3,5.
Anemia: La anemia es característica de la IRC debido a una disminución en la secreción de erytropoietina (producida en las células peritubulares intesticiales en la corteza interna y médula externa),adicionalmente hay disminución en la sobrevida de los eritrocitos, inhibición en la médula osea, pérdidas sanguíneas intestinales y asociadas con la diálisis y deficiencia de hierro. La anemia aparece en niños cuando la FG esta entre 20-35 ml/min por 1,73 m2 de S.C. Antes de la erytropoietina se manejaba con transfusiones las cuales llevaban a sobrecarga corporal total y aumentaban las concentraciones finales de hierro sérico, infecciones y exposición a antígenos de H.L.A. Actualmente se maneja con erytropoietina mejorando no solo la anemia sino también el apetito, la actividad física, libido y rendimiento escolar. Los efectos secundarios más frecuentes relacionados con la erytropoietina son la hipertensión y el déficit de hierro3,5.
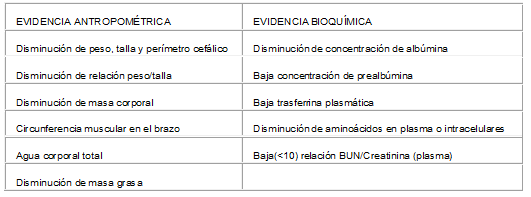
Crecimiento y desarrollo: Los niños con insuficiencia renal crónica tienen hiporexia de origen central así como alteración en el sentido del gusto, cuando los requerimientos diarios de calorías caen por debajo del 80% causando retardo en el crecimiento. La IRC los hace usar las calorías menos eficientemente que los niños normales y según la nefropatía de base la pérdida de proteinas asocidas aumenta el deterioro nutricional. En el desarrollo neurológico presentan mas incidencia de microcefalia, convulsiones, atrofia mental y retardo3,5. En el NAPRTCS se presentó una incidencia de anemia significante (hemtocrito <30%) en el 62,9% de los casos y se observó que las mujeres y los pacientes con peor función renal tenían un mayor deterioro en su crecimiento15. (Tabla 11) y a menor edad en inicio de enfermedad renal mayor deterioro en su crecimiento5.
(5)Tabla No. 11. Evidencia que sugiere desnutrición en pacientes con IRC
Transtornos endocrinos: Los niveles de ciertas hormonas se incrementan como insulina, proinsulina, glucagón, PTH y calcitonina secundarios a alteración en la eliminación renal y la prolactina aumenta debido a un estímulo en la secreción. Los niveles de ertropoietina y 1,25 diOH D3 disminuyen por alteración en la producción renal, asi mismo la testosterona y el estradiol son más bajos por alteración en la producción extrarrenal. La acción normal de IGF-I, T4, T3, LH, Prolactina, somatomedinas, GH e Insulina se altera por aumento de las proteínas tranportadoras (IGF, GH), aumento de la vida media por disminución de la depuración y síntesis aumentada (LH, Prolactina, ACTH, DHEAS – dehidroepian – drosterona sulfato), aumento de la eliminacion renal (T3, T4), o resistencia periferica y/o mutación del receptor (Insulina, GH)3,5.
Tratamiento
Dieta y electrolitos: Se administran dietas con 0.8(adolescentes) a 2(lactantes) gr de proteínas por Kg y es más efectivo que la administración de suplementos, así se mantiene un adecuado aporte calórico, se limita la ingesta protéica, se previene la depleción del LEC y la acidosis metabólica. Así mismo se ha demostrado disminución en la hiperperfusión y la hipertrofia glomerular, en los niveles de lípidos, en la activación del sistema inmune y en los factores de crecimiento celular con la restricción protéica. También se ha observado que los pacientes que reciben dietas bajas en proteínas con un mayor aporte de aminoácidos esenciales y sus alfa hidroxicetoanálogos presentan mejoría en la relación BUN/Creatinina. El aporte de sodio solo se limita en los pacientes con hipertensión, sobrecarga hídrica y glomerulonefritis. Los lactantes con IRC secundaria a lesión renal estructural son a menudo perdedores de sal y este elemento es necesario para mantener el volumen intravascular. A veces se requiere incrementar el aporte de cloruro de sodio junto con bicarbonato para prevenir la acidosis metabólica. Las necesidades varían entre 1 a 3 meq/kg/dia. La ingesta de agua debe ser monitorizada debido a que estos niños son incapaces de concentrar la orina, la administración de grandes volúmenes debe ser por vías especiales como gastrostosmia o SNG. Al restaurar el volumen plasmático, las perdidas urinas de bicarbonato aumentan por lo tanto se requiere suplencia adicional. Se inicia a 2 mEq/kg/dia como HCO3 y mantener niveles de bicarbonato sérico mayores de 20. Los niveles de calcio deben mantenerse entre 10-11 mg/dl por lo cual se requiere suplencia frente a las pérdidas por competencia con el fósforo y disminución de absorción por alteración en la síntesis de vitamina D3. Los niveles por encima de 11.5 mg/dl se deben evitar puesto que aumentan la excreción urinaria y deteriora la función renal. La ingesta de fósforo debe limitarse, en la mayoría de casos se requieren quelantes que contengan calcio. No se recomienda la administración continua de quelantes con aluminio por el riesgo de toxicidad caracterizado por encefalopatía progresiva, osteomalacia (niveles >200mg/L) y anemia. Esta es secundaria al deterioro de la función renal (más del 95% es excretado por la orina). La intoxicación con aluminio se maneja con deferoxamina. La elevación en los niveles de potasio es rara en la IRC leve a moderada pero es frecuente en la severa y los estados terminales. Se requiere manejo con dietas bajas en este elemento, se suprimen las frutas cítricas, banano, chocolate, tomate y papas. Si persiste la hiperkalemia se administran resinas como Kayexelate, Salbutamol o Glucosa-Insulina-Bicarbonato5,8,17.
Vitaminas: Se requiere suplemento de vitaminas hidrosolubles y vitamina D, no de vitaminas liposolubles, teniendo en cuenta el riesgo de hipercalciuria y mayor deterioro de la función renal con esta última5.
Anemia: Se acepta como apropiado un hematocrito de 35% y se administra erytropietina para lograrlo bien sea por vía IV, SC (subcutanea) o intraperitoneal. La vía SC se usa con más frecuencia por tener una vida media más prolongada que disminuye su dosis total semanal y puede aplicarse varias veces por semana1, 2 o 3. Se usa como dosis inicial de 30-300 U/kg por semana y mantenimiento 60-600 U/kg. La mayoría de niños responden con niveles entre 100-200 U/kg. El marcador para medir la respuesta es la ferritina y se requiere una saturación de hierro mayor de 20%. Su uso actual es del 44.1% disminuyendo la utilización de transfusión15. La admimnistracion de hierro oral se usa en niños que no reciben hemodiálisis y es mejor cuando el PH gástrico es ácido, no se debe administrar en las 2 horas siguientes a la comida o con quelantes de fosfato5,8.
Terapia para falla en el crecimiento: Aún con un control adecuado nutricional, del estado hidroelectrolítico, metabolismo óseo y corrección de la anemia, la mayoría de los niños con IRC progresiva no crecen con respecto a su potencial genético; en estos pacientes, su crecimiento puede mejorar con la administración de RhGH, administrada diariamente con una dosis total administrada de 0,35 mg/kg o 30 U/m2 por semana, incrementado la velocidad del crecimiento antes y después del transplante. Su uso no esta reservado para niños con Insuficiencia renal crónica y estatura corta marcada (talla menor de 2 desviaciones estándar). Se ha observado un incremento hasta lograr una talla estimada del 50% (aumenta la velocidad de crecimiento un 73%) en niños puberes antes del desarrollo de ERET o de requerir transplante, al suspender su administración se detiene el crecimiento, el cual se reanuda al reiniciar la medicación. Si se suspende posterior al transplante, no se logra un deterioro notorio en la ganacia de talla. Sin embargo en algunos niños trasplantados el uso de GH aumenta el riesgo de rechazo y deteriora aún más la función renal debido a atrofia tímica, reducción de la síntesis de anticuerpos, disminucion de la actividad de los natural killer, disminución de la actividad de barrera de la piel asi como deterioro en la respuesta leucocitaria. Por lo anterior se requiere una inmuno modulacion adecuada del paceinte para evitar estos efectos indeseables5,18,19.
Antihipertensivos: Los estudios a largo plazo mustran el beneficio de la reducción de tensión arterial en la progresión de la insuficiencia renal. Los inhidores de la ECA son los mas efectivos en evitar la progresión al inhibir la síntesis de algunos de los factores de crecimiento y disminuir la tensión intraglomerular. Los bloqueadores de los canales de calcio protegen la función renal al disminuir la vasoconstricción, aumentar la inmunosupresión incrementando los niveles de ciclosporina y por sus efectos antiproliferativos. 5,17. El uso de antihipertensivos se incrementa asi mismo con la edad y deterioro de la funcion renal del 12% (
Quelantes de fosfatos: Se usa hidroxido de aluminio 30 mg/kg/dia, pero de forma ideal se debe utilizar citrato o carbonato de calcio para disminuir la toxicidad por ingesta de aluminio5.
Vitamina D : El implemento de calcitriol no debe exceder 0.9 gr/dia para evitar la hipercalcemia. Se realizan controles plasmáticos de Ca, P, PTH. (5,8)
Diálisis: Se indica en casos de uremia, hiperkalemia, sobrecarca hídrica, acidosis refractaria al manejo, depuración de creatinina 9-14 sml/min/1.73 m2 de S.C. Se selecciona el método mas seguro y adecuado para el paciente (CAPD o hemodiálisis). En el NAPRTCS (estudio colaborativo de transplante renal pediátrico en Norteamérica) de el 82% de los pacientes requirieron diálisis, 63% peritoneal y el 36,7% hemodiálisis. El 22% correspondían a raza negra. La principal patología asociada era GESF 27.6%. La peritonitis asociada se presentó en el 25.8% generalmente por gram positivos5,16.
Bibliografía
- GORDILLO, PG. Insuficiencia renal crónica en Gordillo PG. Nefrología Pediátrica.1ª.ed. Mosby-Doyma libros. Madrid. 1996 pp. 374-400.
- LAGOMARSINO E., VALENZUELA , A., CAVAGNARO F., SOLAR, E. Chronic renal failure in pediatrics 1996. Chilean survey. Pediatr Nephrol. 1999; 13: 288-291.
- WASSNER JS. Conservative Management of chronic renal insufficiency. En Holliday AM, Barratt TM, Avner ED. Pediatric Nephrology. 3a. ed. Williams- Wilkins. Baltimore. 1994. pp. 1314 – 1317.
- GORDILLO, PG.; MOTA, HF:, VELÁSQUEZ, JL.; Administración de medicamentos en pacientes con deterioro de la función renal. En Gordillo PG, Mota HF, Velásquez JL. Diagnóstico y terapéutica de trastornos renales y electrolíticos en niños. 2a ed. Ediciones Médicas del Hospital Infantil de México. México. 1981, pp. 506.
- WASNER, JS.; BAUM, M. Chronic renal failure, Physiology and management. En Barratt TM, Avner ED, Harmon WE. Pediatric Nephrology. 4ª ed. Lippincott Williams Wilkins. Baltimore. 1999. pp 1156.
- GASTELBONDO, R.; IRAGORRI, S.; POMBO, L.; CUERVO, E. Estado actual de la insuficiencia renal crónica en pediatría. En Memorias 10º Congreso Colombiano de Nefrología e Hipertensión, Medellín. Octubre de 1997. pp. 9
- MARTÍNEZ, SJ.; OCHOA, AB.; PIEDRAHITA de M.V. Insuficiencia renal crónica en pediatría. En Grupo de trasplantes Universidad de Antioquia. Insuficiencia renal diálisis y trasplantes. La ed. Salvat Editores Colombiana S.A. Barcelona. 1984. pp. 81-107
- FOREMAN, WJ.; CHAN, JCM. Chronic renal failure. J. Pediatr. 1988; 113: 793 – 799.
- FOGO, A.; KON, V. Pathophysiology of progressive renal disease. En Holliday AM, Barratt TM, Avner ED. Pediatric Nephrology. 4ª. ed. Williams Wilkins. Baltimore. 1999. pp. 1183 – 1196.
- EL RESAHID K.; KAPOOR, MM.; NAMPOORY, NRN; EL RESHAID, W.; JOHNY, KU. Pediatric dialysis and renal transplantation in Kwait oveer past 11 years. Pediatr Nephrol. 1999; 13: 259.
- DOS SANTOS – COIMBRA, M.; VELÁSQUEZ, JL.; MOTA, HF.; GORDILLO, PG. Causas de insuficiencia renal crónica en niños. Bol Med Hosp. Inf. 1976; 33: 801-819.
- GASTELBONDO, AR.; CANO GUZMÁN, AM. Guía de manejo conservador en niños con insuficiencia renal crónica. Pediatría. Org of Soc Col Ped. 1998; 33: 233 – 240.
- SEEMAN, T ; MEYER, M ; SCHMITT. C.P. Urinary excretion of urodilatin in healthy children and children with renal disease. Pediatric Nephrology. 1998 ; 12 : 55-59.
- KHER, K. Chronic renal failure. En Kher, K ; Makker, S. Clinical Pediatric Nephrology. McGraw Hill Inc. New York. 1992. pp. 501-541.
- FIVUSH, B ; JABS, K ; NEU, A. Chronic renal insufficiency in children and adolescents : the 1996 annual report of NAPRTCS. Pediatric Nephrology. 1998 ; 12 : 328-337.
- WARADY, B ; HEBERT, D ; SULLIVAN, K. Renal transplantation, chronic dialysis, and chronic renal insufficiency in children and adolescents. The 1995 Annual Report of the North American Pediatric Renal Transplant Cooperative Study. Pediatric Nephrology. 1997 ; 11 : 49-64.
- KHER, K. Conservative management of chronic renal failure. En Kher, K ; Makker, S. Clinical Pediatric Nephrology. McGraw Hill. New York. 1992. pp 543-558.
- FINE, R ; BROWN, D. Growth after discontinuation of recombinat human growth therapy in children with chronic renal insufficiency. The Journal of Pediatrics. 1996 ; 129 : 883-891.
- BENFIELD, M ; KOBAUT, E. Growth hormone is safe in children after renal transplantation. The Journal of Pediatrics. 1997 ; 131 : 28-31.
- ORTA-SIBU, N. Aspectos epidemiologicos de insuficiencia renal crónica en los niños en paises latinoamericanos. Archivos Venezolanos de Puericultura y Pediatria. V Congreso de Latinoamericano de Nefrología Pediatrica (ALANEPE) Valencia Venezuela. 1999 ; 131 : 83.

