La terapia inmunosupresora es esencia en la prevención del rechazo al transplante renal y es la que va a favorecer una adecuada aceptación del injerto. El receptor debe estar consciente de la necesidad del uso a largo plazo de estos medicamentos.
La respuesta inmunológica del receptor al injerto esta mediada por los linfocitos T activados, participando en el reconocimiento de los antígenos del HLA, así pues T4 reconocen la clase II, mientras que los T8 reconocen la clase I.
La estimulación de los linfocitos T4 por los antígenos HLA II producen un estimulante para los macrófagos y la formación de receptores de insulina, transferrina, IL 1 y 2. Los linfocitos citotóxicos activados por la clase II forman IL1, posteriormente los macrófagos activados producen IL 1 y 2, la cual actúa en sus receptores estimulando la síntesis de DNA y la proliferación clonal de células portadoras de receptores. La IL2 produce la salida de IFN-gamma que activa macrófagos y linfocitos B. Al activarse los linfocitos T4 se produce la salida de linfoquinas que actúan sobre macrófagos, linfocitos T y B. El rechazo se origina en el efecto de los linfocitos T, los macrofagos y sus productos.
Dentro de los fármacos empleados para la inmunosupresión tenemos:
- Azatioprina
- Corticoides
- Ciclosporina A
- Preparaciones antilinfociticas.
1. Azatioprina
Se dispone desde 1961. Es un análogo de las purinas cuyo metabolito hepático es la 6-mercaptopurina. Sus metabolitos se incorporan al DNA celular inhibiendo la síntesis y el metabolismo del nucleotido de la purina y alterando la función del RNA. De esta manera inhiben la proliferación clonal de los linfocitos B y T.
Se utiliza la prevención mas no para tratamiento de rechazo.
Generalmente se usa asociada a otras drogas como corticoides y ciclosporina A. En combinación con prednisona desde hace mas de años ha tenido una buena rata de efectividad inmunossupresora en transplantes renales.
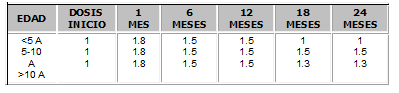
La dosis de inmunosupresión es de 2 mg/Kg/día y en Pediatría se recomiendan las dosis expuestas en la Tabla No. 1.
Tabla No. 1. Dosis de azatioprina para inmunosupresión en Pediatría (mg/Kg)16.
Al igual que inmunosuprime la proliferación celular de linfocitos T, también actúa a nivel de las células hematopoyeticas, disminuyendo su producción, por lo cual su dosis debe ser regularizada dependiendo del numero de neutrofilos (menores de 1500/mm3) o si se alteran las pruebas de función hepáticas.
2. Corticoides
Inhiben en forma directa los linfocitos T generados por los antígenos del injerto, indirectamente inhiben la producción de IL-2. Se utilizan tanto para la prevención como para el tratamiento del rechazo al transplante. A dosis altas pueden producir linfolisis.
Los mas empleados en inmunosupresión son la prednisona, a dósis de 2 mg/Kg (mínimo 20 mg), que se disminuye progresivamente hasta 0.25 mg/Kg, y la metilprednisolona que se utiliza en el periodo operatorio a 10 mg/Kg.
Este medicamento potencia la acción de la Ciclosporina A, por lo cual se pueden usar asociados.
El efecto colateral que se observa con mayor frecuencia es el retardo pondoestatural.
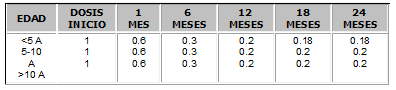
Se recomiendan las dosis expuestas en la Tabla No. 2.
Tabla No. 2. Dosis de corticoides para inmunosupresión en Pediatría (mg/Kg)16.
3. Coclosporina A
Metabolito micótico, extraído del hongo Tolypocladium inflatum, endecapéptido cíclico que surgió como uno de los principales avances de la terapia inmunosupresora anti-rechazo en la década de los 80.
Su mecanismo de acción es similar al de los corticoides, bloqueando la acción de los linfocitos T activados, al bloquear la transcripción de los genes de la linfocinas (IL-2 e interferón gamma), inhibiendo la activación de las células citotóxicas y células B.
En cuanto a las bases moleculares se ha visto que la ciclosporina actúa ligándose a las proteínas (ciclofilinas), las cuales se unen en forma selectiva y con gran afinidad. Se encuentran en el tejido linfoideo14.
Su empleo ha permitido una mayor supervivencia del injerto en un 15 a 20% a un año con donante cadáver. Se debe tener en cuenta los efectos de nefro y hepatotoxicidad, que se han visto menos frecuentes con el uso de ciclosporina G15.
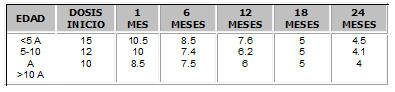
Su administración se debe iniciar teniendo en cuenta creatininas menor de 2 mg/dl, con dosis recomendadas en pediatría según la Tabla No. 313,14.
Tabla No. 3. Dosis de ciclosporina A para inmunosupresión en Pediatría (MG/Kg)16.
Esta dosis son mas elevadas que las utilizadas en los adultos ya que como la absorción del medicamento es intestinal y los niños poseen un intestino delgado más corto aunado a un más alto metabolismo y eliminacion17.
Las ampollas se utilizan en el post-operatorio inmediato cuando el transplantado no puede tomar por boca; por esta vía se da 1/3 de la dosis oral. Después de 24 horas se administra por vía oral. Sus máximas concentraciones plasmáticas se alcanzan entre 12 y 16 horas; por ello se recomienda la toma cada 12 horas.
La capacidad de absorción del medicamento por el intestino es variable para cada individuo, por ello es recomendable cuantificar los niveles plasmáticos para reajustes en la dosis. Sus niveles se determinan en sangre extraída en ayunas, aproximadamente a las 12horas de la ultima toma. Los niveles séricos del medicamento deben mantenerse en el perioperatorio entre 200-250 ng/dl y sobre los primeros 6 meses posttransplante hasta 50-125ng/dl.
Desde el primer día post-operatorio se utiliza globulina antimicótica (o antilinfocítica) como tratamiento de inducción a dosis de 15 mg/Kg IV por un máximo de 12 horas.
La ciclosporina debe administrarse en forma oral en dos dosis, bajo las siguientes condiciones:
Se debe tomar la dosis recomendada con la ayuda de la pipeta dosificadora y mezclarla en un vaso de vidrio con una bebida a base de chocolate, leche o zumo de la fruta (preferiblemente naranja o manzana), a temperatura ambiente, agitarlo bien y tomarlo sin dejarlo reposar. A continuación añadir un poco mas de diluyente al paso para recuperar la pequeña cantidad de medicamentos que pueda quedar en el y tomarlo. La pipeta se ha de limpiar con un pañuelo de papel y guardarla en su estuche; no utilizar agua, alcohol ni otro liquido para limpiarla. Una vez abierto el envase, no utilizarlo pasados dos meses18.
El uso de la ciclosporina en un esquema de inmunosupresión secuencial se ha asociado con mejoría en el pronóstico del haloinjerto a uno, dos y tres años, en un 91, 86 y 83% de sobrevida respectivamente.
La ciclosporina se ha asociado a un sin numero de efectos colaterales como:
- Hepatotoxicidad.
- HTA.
- Hipertricosis.
- Gingivitis.
- Nefrotoxicidad: Potenciación del daño isquémico que se acompaña de disfunción temprana de injerto, azoemia reversible relacionada con altos niveles sanguíneos de ciclosporina y compromiso renal crónico indolente.
- Hipomagnesemia.
- Hipercalcemia.
- Neurotoxicidad: Convulsiones, lesiones corticales, ceguera, ataxia, afasia, tremores.
- Hiperlipidemia.
- Sensación de quemazón en los dedos de manos y pies.
- Perdida de apetito, nauseas y vomito.
La nefrotoxicidad relacionada con la ciclosporina, se ha atribuido a una acción vasoconstrictora a nivel de la arteriola aferente, considerándola como el factor etilógico primario en la toxicidad aguda y reversible La injuria tubulo intersticial crónica se ha relacionado con la isquemia secundaria a dicha vasoconstricción, que podría deberse a un incremento en el tono simpático renal, aumento en las catecolaminas, activación del sistema reninaangiotensina, e incremento en la relación tromboxano/postaciclina.
4. Preparaciones antilinfocíticas
Puede agruparse dentro de los agentes policlonales y monoclonales. Los policlonales pueden dirigirse a un numero de antígenos de los linfocitos, pero el anticuerpo preciso que causa la depleción linfocitaria no esta identificado, dentro de estos se encuentran el antisuero heterologo contra linfocitos y la globulina antitimonocitica o la globulina antilinfocitica. Los monoclonales son anticuerpos producidos en ratón dirigidos contra antígenos específicos presentes en la membrana celular de los linfocitos T activados.
El más empleado es el OKT3 que produce la desaparición de los linfocitos T de la circulacion2. Se ha utilizado tanto para inducir tolerancia como para el tratamiento del rechazo renal agudo inicial o para el corticorresistente en dosis de 1-2,5 mg/Kg/día endovenoso durante 10 a 14 días. Dentro de sus efectos secundarios se ha descrito fiebre, escalofrío, disnea, dolor torácico, vomito, nauseas, temblor, cefalea, meningismo, edema cerebral o pulmonar; para contrarrestar estos efectos se ha utilizado la administración previa de acetaminofen 10mg/Kg/dosis vía oral, difenhidramina 1 mg/Kg/dosis vía oral y metilprednisolona 10 mg/Kg endovenosos (20 minutos de colocar el OKT3), asociado a succinato de hidrocortisona 2 mg/Kg endovenoso (30 minutos después de colocar el OKT3).