A pesar de haber sido descrita desde 1967, los criterios diagnósticos del Síndrome de dificultad respiratoria del adulto (SDRA) solo fueron establecidos hasta 1994. De lo anterior podría inferirse el carácter polimórfico de la enfermedad y su etiología variada.
Una posible definición del SDRA, bajo el anterior contexto incluiría lo que hoy se conoce como lesión pulmonar aguda (LPA) y se entiende como una fase más leve y precoz de ese continuum que tiene como característica principal la de ser la forma más severa de falla respiratoria hipoxémica.
La incidencia de LPA/SDRA en Estados Unidos oscila entre 56 y 82 casos por 100.000 personas/año. Su tasa de mortalidad se asimila a la de enfermedades tan graves como el cáncer de seno y el complejo VIH/ SIDA.(24) Desde el perfil de morbilidad es preciso anotar que la sepsis severa (de origen pulmonar o extrapulmonar) se constituye en el evento precedente en la aparición de LPA/SDRA en Norteamérica y Europa.(25)
Pese a esa propiedad y al alto perfil de morbimortalidad que conlleva (30% a 40%),(26) la etiología del evento LPA/SDRA permanece oscura. Su tratamiento, por lo tanto, solo está dirigido a brindar el soporte ventilatorio y no ventilatorio que, de otra manera, conllevaría a la muerte.
El soporte nutricional en SDRA tiene cabida porque muchos de estos pacientes presentan ayuno prolongado (entre 5 y 10 días) que se agrava por el estado hipermetabólico desencadenante del SDRA (en general trauma o sepsis).
Sin embargo, en los últimos 10 años se han introducido los fármaco-nutrientes, específicamente las fórmulas enterales con alta proporción de ácidos grasos omega 3 por su potencial modulador de la cascada inflamatoria característica de esta patología.(27)
SDRA presenta una etiología muy variada
Aunque, como se ha observado, el SDRA presenta una etiología muy variada, es posible que todo pueda reducirse a un factor común etiológico: una respuesta inflamatoria de carácter agudo que ocasiona daño a las células endoteliales y epiteliales, alteraciones del complejo alvéolo-capilar y edema pulmonar secundario.(28,29)
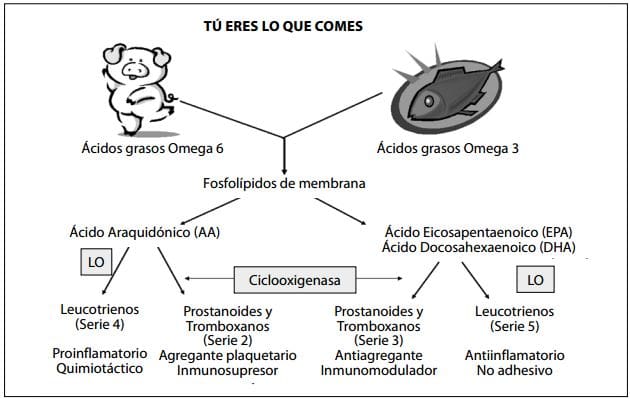
La figura 3 presenta en forma resumida el ciclo metabólico de los ácidos grasos dependiendo de su origen y estructura química. En presencia de SDRA, la síntesis de ácidos grasos se deriva, vía ácido araquidónico (AA), hacia la producción de leucotrienos de la serie 4 y prostanoides de la serie 2 con claros efectos proinflamatorios e inmunosupresores.
Específicamente se forman prostanoides de la serie 2 (v.g tromboxano A2, prostaglandina E2) con actividad proinflamatoria en virtud de su capacidad de promover la agregación plaquetaria y la trombosis microvascular, y la producción de otras citoquinas inflamatorias. La PGE2 tiene actividad proinflamatoria e inmunosupresora, induce fiebre, incrementa la permeabilidad vascular y suprime la proliferación de linfocitos T. Adicionalmente, el metabolismo del AA por parte de la 5-lipooxigenasa incrementa la producción de leucotrienos de la serie 4 los cuales también tienen actividades proinflamatorias.(30)
Figura 3. Ciclo metabólico de los ácidos grasos
Por otro lado, el metabolismo de EPA y DHA por las mismas enzimas forma prostanoides y leucotrienos de las series 3 y 5 respectivamente, entre ellos, el tromboxano A3, la prostaglandina E3 y el leucotrieno B5. Sus principales acciones son de tipo antiinflamatorio, al inhibir la agregación plaquetaria, la quimiotaxis y la adhesión celular.(31)
Por todo lo anterior es previsible, dado este carácter inflamatorio, que su modulación puede afectar favorablemente el pronóstico de SDRA. Surgen así los inmunonutrientes, es decir, nutrientes con una actividad antiinflamatoria con probable utilidad en aquel grupo de patologías en las cuales el componente inflamatorio sea crucial y con un uso muy controversial en otras patologías. Por ejemplo, en caquexia-cáncer una revisión sistemática reciente, que involucró 587 pacientes, concluyó que existen datos insuficientes para recomendar el uso de EPA oral al compararla con el placebo. Al comparar EPA con una suplementación proteica sin EPA en presencia de un estimulante del apetito (Acetato de Megestrol) no se halló evidencia de mejoría en el uso de síntomas asociados a la caquexia vista en pacientes con cáncer.(32)
Composición de los lípidos
La investigación sobre la composición de los lípidos de la dieta explica parcialmente el incremento de algunas patologías que comparten el componente inflamatorio como explicación de su etiología.
Ahora se sabe que la relación de lípidos omega 6:omega 3 de la dieta tiene la potencial capacidad de influenciar la respuesta inmune.(33) Durante los últimos 50 años esta relación se ha incrementado en Occidente, debido al alto predominio del consumo de alimentos ricos en AA (v.g carnes y huevos). Por esta razón, la antigua relación 15:1 se ha incrementado hasta valores de 20:1 lo cual, probablemente, ha influenciado en forma adversa el curso clínico de patologías como la enfermedad coronaria, el asma y la obesidad.
En el grupo de las fórmulas especializadas, aquellas que contienen predomino de ácidos grasos poliinsaturados omega 3 (PUFAs ω3) son probablemente los más importantes y los más estudiados. Una fórmula que contenga una mezcla específica de lípidos con altas fuentes de ácido γ-linolénico (GLA; 18:3 n-6) y de ácido eicosapentaenoico (EPA; 20:5 n-3) puede revertir la tendencia inflamatoria en SDRA, al incrementar la producción de prostaglandinas de la serie 1 y leucotrienos de la serie 5 cuyos metabolitos están asociados a un estado antiinflamatorio y vasodilatador (figura 3).
Adicionalmente, estas fórmulas contienen altas cantidades de α-tocoferol, β caroteno, ácido ascórbico y antioxidantes que pueden tener un papel benéfico en el curso de un SDRA.
Aplicación de fórmulas enterales especializadas
Los resultados de los diferentes estudios de aplicación de fórmulas enterales especializadas para pacientes pulmonares son controvertidos. Aunque en algunos parámetros se aprecia una clara mejoría, la mayoría de ellos no acierta a demostrar una disminución notable en la mortalidad, lo cual, al compararlo con los costos que ocasiona su uso hace cuestionable su indicación y masificación. Es probable que una fórmula densa (1,5- 2,0 kcal/ml) deba ser considerada en aquellos pacientes que requieran restricción en la ingesta de líquidos.(34)
Hasta la fecha no existe una evidencia suficiente que apoye el uso de fórmulas especializadas en SDRA. Los datos preclínicos demuestran efectos positivos del uso de EPA y GLA sobre la producción de mediadores inflamatorios, el intercambio gaseoso y el transporte de oxígeno.(35) Específicamente los estudios de SDRA inducida por endotoxinas en murinos muestran importantes diferencias en la población alimentada con aceite de maíz, en comparación con aquella sometida a dietas ricas en EPA y GLA. En el primer grupo se apreció un incremento más temprano y prolongado en la permeabilidad pulmonar y en la aparición de hipotensión. El efecto benéfico observado en la dieta enriquecida, se debió posiblemente a la disminución de mediadores proinflamatorios dependientes del AA tales como leucotrienos de la serie 4 (LTB4), tromboxanos de la serie 2 (TXB2) y prostaglandina E2 (PG2).(36,37)
Soporte ventilatorio y de estancia en UCI
Estudios en humanos han mostrado, por su parte, una mejoría significativa en la ventilación, disminución del número de días de soporte ventilatorio y de estancia en UCI sin cambios significativos en la mortalidad, al compararlos con los grupos control.(38-40) Concretamente, los pacientes con SDRA que recibieron EPA más GLA presentaron un incremento en la oxigenación arterial (PaO2 /FIO2 ) y una disminución significativa en el número de neutrófilos en el fluido bronquial, al compararlos con el grupo sometido a la fórmula estándar. Incluso se ha llegado a demostrar un efecto preventivo en la formación de nuevas úlceras de decúbito en pacientes con LPA.(41)
Pontes-Arruda y col en Brasil demostraron efectos benéficos de una dieta enteral enriquecida con EPA y GLA más antioxidantes en pacientes con sepsis severa y choque séptico sometidos a ventilación mecánica. En efecto, al compararlos con una dieta isonitrógena, los pacientes sometidos a la fórmula especial presentaron una reducción del 19,4% en la mortalidad (p=.037). Además tuvieron mejores parámetros ventilatorios, un mayor número de días libres de ventilador (13,4 vs. 5,8 p < .001), mayor número de días fuera de UCI (10,8 vs. 4,6 p < .001) y menor desarrollo de SDOM.(42) Singer y col revisaron la evidencia existente sobre el uso, y aunque se registran beneficios como los de Pontes-Arruda, también advierten pocos beneficios e incluso riesgos de su uso en pacientes críticos en UCI.(43,44)
Una revisión de la base Cochrane sobre el tema, realizada por los autores anteriores, concluye que, en pacientes con LPA/SDRA y sepsis, las fórmulas con EPA + GLA pueden modular la respuesta inflamatoria sistémica, mejorar el intercambio de gases, reducir la tasa de DOM, el tiempo de ventilación mecánica y el riesgo de mortalidad.(45)
Reclutamiento de neutrófilos pulmonares
Los datos anteriores podrían explicarse en una reducción del reclutamiento de neutrófilos pulmonares y niveles más bajos de mediadores proinflamatorios los cuales son protagonistas de la aparición de sepsis y SDRA. Una dieta rica en EPA + GLA + antioxidantes contribuye a la restauración del balance entre los mediadores inflamatorios que modulan el metabolismo del ácido araquidónico y la síntesis de eicosanoides antiinflamatorios.(46)
El uso parenteral de fórmulas enriquecidas en lípidos especiales, continúa siendo objeto de dura controversia. Algunos estudios presentan evidencia de efectos pulmonares adversos atribuidos a las emulsiones grasas ricas en triglicéridos de cadena larga (LCT) dentro de los cuales se destacan la inmunosupresión, el empeoramiento de la inflamación local y el compromiso de la actividad fagocítica.(47)
Recientemente se introdujo en Europa una fórmula parenteral especializada para pacientes con SDRA. Se trata de una emulsión de aceite de pescado que al compararla con una preparación convencional compuesta de ácidos grasos w-6 durante un periodo de cinco días demostró un importante incremento plasmático de los ácidos grasos w-3, una inversión de la relación w-6/w- 3, además de una rápida incorporación de EPA y DHA en las membranas de los leucocitos.(48)
Conclusiones
El presente documento resumió, en clave histórica, los principales aportes en el conocimiento de la compleja relación Nutrición: Enfermedad pulmonar. A partir del reconocimiento del carácter hipermetabólico del paciente pulmonar se postula la reciente mirada sobre los mecanismos inflamatorios que subyacen en el EPOC y el complejo SDRA/LPA para finalmente hacer un examen del papel potencial de las fórmulas enterales especializadas como moduladores de la respuesta inflamatoria que caracteriza estas patologías y mostrar la evidencia clínica existente sobre su uso en modelos animales y ensayos clínicos.
La Enfermedad pulmonar obstructiva crónica (EPOC) y el complejo SDRA/LPA representan un grupo de patologías con riesgo potencial de desnutrición aguda. El uso de fórmulas enterales especializadas en pacientes con EPOC es controversial y son insuficientes los estudios que apoyan en forma consistente el uso rutinario de las fórmulas ricas en grasa en pacientes hospitalizados con disfunción pulmonar.
Es probable que estas fórmulas puedan tener mayor cabida en el subgrupo de pacientes desnutridos severos sometidos a ventilación mecánica y con dificultades para retiro progresivo del ventilador.
En aquellos pacientes ambulatorios, que presentan EPOC y desnutrición severa asociada, una fórmula rica en grasa puede ser utilizada con un mayor beneficio potencial al compararla con la fórmula estándar pues contrarresta los efectos adversos que acompañan a los regímenes hipercalóricos.
Para aquellos pacientes con SDRA/LPA:
Los estudios sugieren que las alteraciones inmunes descritas pueden ser susceptibles de modulación mediante el uso de inmunonutrientes. Es posible que una fórmula que contenga EPA, GLA y alto porcentaje de antioxidantes sea benéfica y aplique especialmente en subgrupos específicos pues es conocido que, el efecto fisiológico del aceite de pescado toma algunos días en hacerse aparente y que, debido al polimorfismo genético, dicho efecto no es uniforme en toda la población.
Finalmente, la relación óptima de w-6/w-3 aún no está claramente definida. Es probable que en pacientes bajo régimen parenteral una relación 2:1 sea óptima.(49) Se debe enfatizar, sin embargo, que más que la obtención de una relación ideal, lo importante es la provisión de una fuente nutricional en forma de w-3.
Existen algunas alternativas parenterales de emulsiones lipídicas las cuales contienen una carga reducida de LCT y diversas mezclas de LCT/MCT, aceite de pescado, ácido oleico y triglicéridos estructurados; sin embargo, estas fórmulas tienen aún un uso restringido y deben esperar su comprobación clínica benéfica para autorizar su uso masivo.(50)
Conflictos de interés:
Ninguno.
Referencias Bibliográficas
- 1. Correia MITD, Campos ACL. Prevalence of hospital malnutrition in Latin America: The Multicenter ELAN Study. Nutrition 2003; 19: 823-5.
- 2. Mannino DM, Gagnon RC, Petty TL, Lydick E. Obstructive lung disease and low lung function in adults in the United States: data from the National Health and Nutrition Examination Survey, 1988-1994. Arch Intern Med 2000; 160: 1683-9.
- 3. Sahebjami H, Sathianpitayakul E. Influence of body weight on the severity of dyspnea in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2000; 161: 886-90.
- 4. Radrizzani D, Iapichino G. Nutrition and lung function in the critically ill patient. Clin Nutr 1998; 17: 7-10.
- 5. Laaban JP, Kouchakji B, Dore MF, et al. Nutritional status of patients with chronic obstructive pulmonary disease and acute respiratory failure. Chest 1993; 103: 1362-8.
- 6. Wouters E. Nutrition and metabolism in COPD. Chest 2000; 117(Supp): 274S-280S.
- 7. Schols MWJ. Nutrition in chronic obstructive pulmonary disease. Curr Opin Pulm Med 2000; 6: 110-5.
- 8. Schols MWJ, Buurman WA, Staal-van den Brekel A, Dentener MA, Wouters EFM. Evidence for a relation between metabolic derangements and increased levels of inflammatory mediators in a subgroup of patients with chronic obstructive pulmonary disease. Thorax 1996; 51: 819-824.
- 9. Berry JK, Baum C. Malnutrition in Chronic Obstructive Pulmonary Disease: Adding Insult to Injury. AACN Clinical Issues 2001; 12(2): 210-9.
- 10. Creutzberg EC, Schols AMWJ, Bothmer-Quadvlieg FCM. Prevalence of an elevated resting energy expenditure in patients with chronic obstructive pulmonary disease in relation to body composition and lung function. Eur J Clin Nutr. 1998; 52: 396–401.
- 11. Mallampalli A. Nutritional Management of the Patient with Chronic Obstructive Pulmonary Disease. NCP 2004; 19(6): 550-5.
- 12. Ferreira IM, Brooks D, Lacasse Y, Goldstein RS, et al. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002; (1): CD 000998.
- 13. Ferreira I, Brooks D, Lacasse Y, Goldstein R, White J. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews. Online. Consultada el 23-04-2010.
- 14. Talpers SS, Romberger DJ, Bunce SB, Pingleton SK. Nutritionally associated increased carbon dioxide production: excess total calories vs. high proportion of carbohydrate calories. Chest 1992; 102: 551-5.
- 15. Kuo CD, Shiao GM, Lee JD. The effects of high fat and high carbohydrate loads on gas exchange and ventilation in COPD patients and normal subjects. Chest 1993; 104: 189-96.
- 16. Vermeeren MA, Wouters EF, Nelissen LH, van Lier A, et al. Acute effects of different nutritional supplements on symptoms and functional capacity in patients with chronic obstructive pulmonary disease. Am J Clin Nutr 2001; 73: 295-301.
- 17. Cai B, Zhu Y, Ma Y, et al. Effect of supplementing a highfat, low-carbohydrates enteral formula in COPD patients. Nutrition 2003; 19: 229-32.
- 18. Skeie B, Askanazi J, Rothkopf MM, et al. Intravenous fat emulsions and lung function: A review. Crit Care Med 1988; 16: 183-94.
- 19. Hageman JR, Hunt CE. Fat emulsions and lung function. Clin Chest Med 1986; 7: 69-77.
- 20. Al-Saady NM, Blackmore CM, Bennett ED. High fat, low carbohydrate, enteral feeding lowers PaCO2 and reduces the period of ventilation in artificially ventilated patients Intensive Care Med 1989; 15: 290-295.
- 21. Van den Berg B, Bogaard JM, Hop WC. High fat, low carbohydrate, enteral feeding in patients weaning from the ventilator. Intensive Care Med 1994; 20: 470-5.
- 22. Malone, A. The use of Specialized Enteral Formulas in Pulmonary Disease. Nutr Clin Pract 2004; 19: 557-62.
- 23. McClave SA, Martindale RG, Vanek VW, McCarthy M et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN 2009; 33(3): 277-316.
- 24. Pontes-Arruda A. The Use of Special Lipids in the Treatment of Inflammatory Lung Disease. Clinical Nutrition Insight. November 2007. p. 1-4
- 25. Wheeler AP, Bernard GR. Acute lung injury and the acute respiratory distress syndrome: a clinical review. Lancet 2007; 369: 1553-64.
- 26. Flaaten H, Gjerde S, Guttormson AB, et al. Outcome after acute respiratory failure is more dependent on dysfunction in other vital organs than on the severity of the respiratory failure. Crit Care 2003; 7: R72-R77.
- 27. Al-Saady NM, Blackmore CM, Bennett ED. High fat, low carbohydrate, enteral feeding lowers PaCO2 and reduces the period of ventilation in artificially ventilated patients. Intensive Care Med 1989; 15: 290-5.
- 28. Elamin EM, Camporesi E. Evidence-based Nutritional Support in the Intensive Care Unit. International Anesthesiology Clinics 2009; 47(1): 121-38.
- 29. Puneet P, Moochhala S, Bhatia M. Chemokines in acute respiratory distress syndrome. Am J Physiol Lung Cell Mol Physiol 2005; 288: L3-L15.
- 30. Mayer K, Seeger W. Fish oil in critical illness. Curr Opin Clin Nutr Metab Care 2008; 11: 121-7.
- 31. Calder PC. Immunomodulation by omega-3 fatty acids. Prostaglandines Leukot Essent Fatty Acids 2007; 77: 327-335.
- 32. Dewey A, Baughan C, Dean TP, Higgins B, Johnson I, Eicosapentaenoic acid (EPA, an omega-3 fatty acid from fish oils) for the treatment of cancer cachexia. Cochrane Database of Systematic Reviews. 1, 2009. Online. Consultado 23-04-2010.
- 33. Bulger EM, Jurkovich GJ, Gentiello LM, et al. Current clinical options for the treatment and management of acute respiratory distress syndrome. J Trauma 2000; 48: 562-72.
- 34. Barale F, Verdy S, Boillot A, et al. Calorimetric study of enteral low-carbohydrate diet in patients with respiratory insufficiency and decompensation. Agressologie 1990; 31: 77-9.
- 35. Mancuso P, Whelan J, DeMichele SJ, et al. Dietary fish oil and fish and borage oil suppress intrapulmonary proinflammatory eicosanoid biosynthesis and attenuate pulmonary neutrophil accumulation in endotoxic rats. Crit Care Med 1997; 25: 1198-1206.
- 36. Palombo JD, DeMichele SJ, Boyce PJ, et al. Effect of short term enteral feeding with eicosapentaenoic and g-linolenic acids on alveolar macrophage eicosanoid synthesis and bactericidal function in rats. Crit Care Med 1999; 27: 1409-20.
- 37. Oltermann MH. Nutrition support in the acutely ventilated patient. Respir Care Clin N Am 2006; 12: 533-45.
- 38. Gadek J, DeMichele S, Karlstad M, et al. Effect of enteral feeding with eicosapentaenoic acid, g-linolenic acid, and antioxidants in patients with acute respiratory distress syndrome. Crit Care Med 1999; 27: 1409-20.
- 39. Tehila M, Gibstein L, Gordgi D, Cohen JD, Aspira M, et al. Enteral fish oil, borage oil and antioxidants in patients with acute lung injury (ALI). Clin Nutr 2003; 22(Suppl): S20.
- 40. Cook D, Meade M, Guyatt G, et al. Trials of miscellaneous interventions to wean from mechanical ventilation. Chest 2001; 120(suppl): 438S-444S.
- 41. Theilla M, Singer P, Cohen J, Dekeyser F. A diet enriched in eicosapentanoic acid, gamma-linolenic acid and antioxidants in the prevention of new pressure ulcer formation in critically ill patients with acute lung injury: a randomized, prospective, controlled study. Clin Nutr 2007; 26: 752-7.