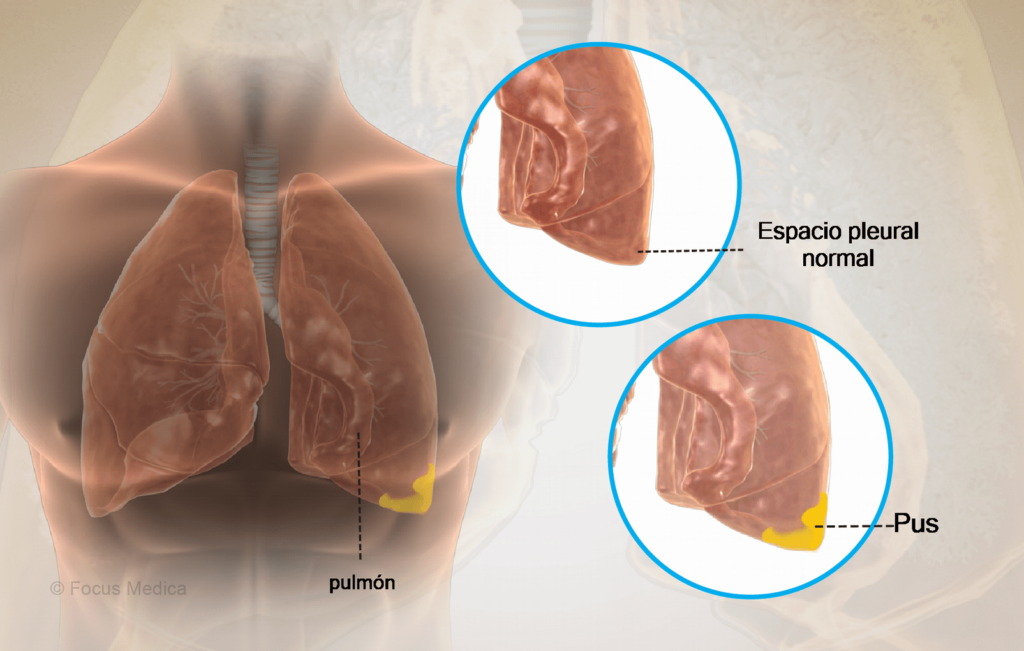
Empiema es la colección de líquido pleural infectado. Los exudados asociados a procesos infecciosos bacterianos se dividen en derrame paraneumónico no complicado y complicado o empiema propiamente dicho.
* Ricardo Posada Saldarriaga, MD· Pediatra
Neumólogo. ISS Clínica León XIII. Profesor CES, UPB.
Historia
Hipócrates (460 A.C.) fue el primero en describir el empiema en forma profunda. Reconoció que el empiema o absceso pulmonar que drenaba en forma espontánea dentro del árbol bronquial era más probable que sobreviviera que el que no lo hiciera. Aparentemente no diferenciaba entre absceso pulmonar y empiema. Fue Hipócrates el primero que drenó quirúrgicamente un empiema.
Arataeus en el siglo II describió el curso clínico. Paré en el siglo XVII, luego de siglos de oscurantismo, describió el empiema y la técnica detallada de su drenaje.
Poco fue adherido a la literatura hasta el siglo XIX, cuando se desarrollaron agujas para localizar y aspirar un empiema y se introdujo la trampa de agua para el drenaje de la cavidad pleural y pronto se estableció que la resección de una costilla hacía más fácil el drenaje.
En 1918 la comisión de la Armada de los Estados Unidos de Norte América para el empiema, reportó una mortalidad del 30 al 70%. Con el desarrollo de la penicilina y otros antibióticos, la mortalidad disminuyó en forma rápida. Así en niños en 1946 la mortalidad era de 25.3%, en 1970 de 1 .6% y actualmente es menor del 1%. (Lea también: Rinitis alérgica en pediatría: la enfermedad crónica más común)
Patogenesis
El origen más frecuente de empiema en niños es a partir de focos neumónicos adyacentes que alcanzan la pleura por diseminación directa (55%).
Menos frecuentemente las bacterias llegan al espacio pleural por vía de una fístula broncopleural (3%), o por ruptura instrumental o espontánea del esófago o por infecciones subdiafragmáticas (2%), o por trauma cerrado o abierto del tórax (6%), o por procedimientos diagnósticos invasivos (20%).
Finalmente por diseminación hematógena de infecciones distantes (sin embargo, generalmente hay foco parenquimatoso inicial que luego contamina al espacio pleural).
Etiología
Los agentes causales de empiema han cambiado con el tiempo. En la era preantibiótica los gérmenes más comunes eran neumococo y estreptococo pyogenes. En la era postantibiótica los gérmenes predominantes en niños son estafilococo aureus y haemophilus influenzae.
Los gérmenes también dependen del sitio geográfico. En países desarrollados el germen predominante es estafilococo aureus, sin embargo, los gérmenes varían según los diferentes estudios. Además, en general las bacterias causales en orden de frecuencia en niños son:
- S. Aureus.
- H. Influenzae: Es el más frecuente en menores de 2 años.
- Neumococo.
- Streptococo pyogenes.
- Gram negativos entéricos.
- Anaerobios: son poco frecuentes en los niños a diferencia de los adultos.
En un estudio realizado en el Hospital General de Medellín se encontraron como principales gérmenes, en su orden S. Aureus, H. Influenzae y neumococo. En el estudio del Hospital Infantil de Bogotá los resultados fueron iguales.
En las neumonías por S. Aureus cerca del 70% de los pacientes tienen líquido pleural detectable radiológicamente y de éstos el 80% están infectados (empiema).
En cambio, en los pacientes con neumonía por neumococo, sólo el 40% tienen derrame pleural detectable y de estos únicamente el 4 a 5% están infectados.
La incidencia de derrame pleural y empiema en las neumonías por H. influenzae es idéntica a la del S. Aureus.
Fisiopatología
El desarrollo de un empiema se divide en tres fases o estadios:
Primera fase o fase exudativa: hay aumento de permeabilidad de la pleura visceral y acumulación de un líquido pleural estéril. El líquido en esta fase es un exudado con glucosa normal y pH normal (derrame paraneumónico no complicado).
Segunda fase o fase fibrinopurulenta: se caracteriza por la infección del espacio pleural, se acumula mayor cantidad de líquido que contiene bacterias y detritos celulares. Se acumula fibrina entre las dos pleuras y si progresa, hay tendencia a la loculación con formación de membranas, con dificultad en el drenaje adecuado del empiema. El pH y la glucosa disminuyen progresivamente y la deshidrogenasa láctica (DHL) aumenta.
Tercera fase o estado de organización: crecen fibroblastos dentro del exudado y se produce una membrana inelástica como una caparazón que atrapa el pulmón. Si el paciente no recibe tratamiento, puede drenar el líquido espontáneamente a través de la pared torácica (empiema necesitatis) o hacia el pulmón (fístula bronco pleural).
Clínica de la empiema pleural
Los síntomas más frecuentes son dolor torácico y disnea. En niños mayores puede encontrarse dolor pleurítico en la inspiración o con la tos que puede desaparecer al aumentar la cantidad de líquido.
Puede haber fiebre alta, escalofríos, vómito, anorexia y postración. También puede haber distensión y dolor abdominal producidos por el ileus reflejo.
AI examen físico en las fases iniciales, puede auscultarse un frote pleural cuando hay poco líquido, pero al aumentar el derrame va desapareciendo. Los hallazgos clásicos de derrame pleural aparecen entonces, a saber:
- Disminución de la excursión torácica.
- Percusión mate.
- Disminución del frémito vocal y táctil.
- Abombamiento de los espacios intercostales
- Disminución de ruidos respiratorios.
- La tráquea y el corazón se desplazan al lado contralateral.
Diagnóstico de la empiema pleural
Rx de tórax: El hallazgo más temprano de derrame pleural es la obliteración del ángulo costofrénico. Se necesitan más de 75 cc de líquido para que pueda verse radiológicamente.
Las radiografías en decúbito lateral pueden revelar pequeñas cantidades de líquido, no visibles con los Rx de rutina.
Los líquidos libres (no tabicados) se movilizan fácilmente y los cambios de posición del paciente pueden ser muy útiles para aclarar imágenes sospechosas en los Rx de rutina.
El descubrimiento de un nivel hidroaéreo en los Rx indica fístula broncopleural, neumotórax espontáneo con efusión, trauma, presencia de microorganismos formadores de gas o ruptura esofágica.
El líquido pleural libre se localiza a lo largo de todo el hemitórax y se aprecia radiológicamente como una línea radioopaca paralela a la caja torácica, con borramiento de los ángulos cardio y costofrénicos.
Radiológicamente es indistinguible un derrame de un engrosamiento pleural. Los cambios en la línea pleural durante los cambios de posición, ayudan a establecer la presencia de derrame. Sin embargo, los líquidos tabicados pueden no variar con los cambios de posición del paciente y en estos casosla ecografía torácica es un auxiliar invaluable para establecer la diferencia.
Diagnóstico
Rx de tórax: El hallazgo más temprano de derrame pleural es la obliteración del ángulo costofrénico. Se necesitan más de 75 cc de líquido para que pueda verse radiológicamente. Las radiografías en decúbito lateral pueden revelar pequeñas cantidades de líquido, no visibles con los Rx de rutina.
Los líquidos libres (no tabicados) se movilizan fácilmente y los cambios de posición del paciente pueden ser muy útiles para aclarar imágenes sospechosas en los Rx de rutina.
El descubrimiento de un nivel hidroaéreo en los Rx indica fístula broncopleural, neumotórax espontáneo con efusión, trauma, presencia de microorganismos formadores de gas o ruptura esofágica.
El líquido pleural libre se localiza a lo largo de todo el hemitórax y se aprecia radiológicamente como una línea radioopaca paralela a la caja torácica, con borramiento de los ángulos cardio y costofrénicos.
Radiológicamente es indistinguible un derrame de un engrosamiento pleural. Los cambios en la línea pleural durante los cambios de posición, ayudan a establecer la presencia de derrame. Sin embargo, los líquidos tabicados pueden no variar con los cambios de posición del paciente y en estos casosla ecografía torácica es un auxiliar invaluable para establecer la diferencia.
La ecografía ayuda a aclarar hallazgos dudosos a los Rx, además identifica el sitio más apropiado para la toracentesis. También muestra los septos en colecciones tabicadas.
La tomografía axial computarizada puede ser útil en casos de derrame pleural masivo con opacidad de todo el hemitórax comprometido, para el diagnóstico de enfermedades parenquimatosas de base, las cuales están ocultas por el derrame; sin embargo, cuando esto no es posible o es difícil de realizar, se puede esperar a que drene el líquido y ver si en los Rx de control aparece la real lesión de base.
Enfoque diagnóstico y terapéutico
Como mencionábamos al principio del capítulo, los exudados asociados a neumonías bacterianas se dividen en:
- Derrames paraneumónicos no complicados.
- Derrames paraneumónicos complicados (empiema).
Todo derrame pleural asociado a neumonía se debe puncionar para establecer a cuál de los grupos pertenece.
Los derrames paraneumónicos se clasifican de acuerdo a las características del cuadro 1. La diferencia de estos dos tipos de derrames paraneumónicos, es fundamental para el tratamiento.
Característica derrame PN no complicado empiema
| Aspecto | Claro – No purulento | Purulento |
| Gram | Negativo | Positivo |
| Cultivo | Negativo | Positivo |
| pH | Mayor de 7.2 | Menor de 7.2 |
| Glucosa | Mayor de 40 | Menor de 40 |
| DHL | Menor de 1000 | Mayor de 1.000 |
El no complicado usualmente mejora con el tratamiento antibiótico de la neumonía, sin necesidad de tubo a tórax. Por su parte, el derrame paraneumónico complicado o empiema, requiere siempre drenaje con
toracostomía cerrada (tubo o sonda a tórax) para un tratamiento efectivo y para evitar complicaciones como adherencias pleurales y paquipleuritis y para acortar el tiempo de enfermedad y hospitalización.
La medición del pH debe hacerse siempre en máquina de gases y no por otros métodos de laboratorio; pacientes con pH entre 7.0 y 7.2, deben individualizarse y la decisión de tubo a tórax depende de otros factores. En casos dudosos pueden aconsejarse las punciones repetidas; si el pH y la glucosa siguen disminuyendo a pesar del tratamiento antibiótico adecuado, se requiere toracostomía cerrada.
Uno solo de los criterios descritos para derrame paraneumónico complicado o empiema, es indicación absoluta de inserción de tubo a tórax, independientemente del tamaño del derrame.
Caída del pH y caída de la glucosa
La caída del pH ocurre más tempranamente que la caída de la glucosa, por lo tanto la medición del pH es más sensible que la de la glucosa.
Hay que tener en cuenta que el pH y la glucosa sólo deben utilizarse como criterio de tubo a tórax en pacientes con derrames paraneumónicos, otras efusiones pleurales tales como las secundarias a enfermedades reumatoideas, tumores malignos o tuberculosis, pueden tener pH y glucosa bajos y no requieren necesariamente tubo a tórax.
En algunos sitios, todavía, sólo se pasa tubo a tórax cuando el líquido es francamente purulento o su Gram y/o cultivo son positivos. Sin embargo, esto es un error grave que ensombrece el pronóstico y prolonga innecesariamente la fase aguda y la hospitalización de estos pacientes.
El tratamiento del empiema debe ser “agresivo” y debemos actuar rápidamente, porque una demora de horas en el drenaje adecuado, puede producir tabiques pleurales y mayor destrucción tisular que perpetúan la infección pleuropulmonar.
En un líquido pleural que no sea purulento, el hallazgo de un pH menor de 7.0 o de una glucosa menor de 40 mgr/dL, son por sí solos indicación de tubo a tórax.
Además de la evacuación del empiema se debe iniciar tratamiento antibiótico. Si el germen es desconocido, iniciar oxacilina a dosis de 200-400 mgr/kg/día más cloramfenicol a 100 mgr/kgl; día para cubrir los dos gérmenes más comunes (S. Aureus y H. Influenzae). Luego se continúa de acuerdo al germen aislado.
Revisión de cultivos y cambio de antibióticos
Si después de 48 a 72 horas de drenaje y de tratamiento antibiótico el paciente no ha mejorado, hay que revisar los cultivos, pensar en cambio de antibióticos o hacer ecografía de tórax para determinar si hay formación de tabiques con cavidades aisladas dentro del espacio pleural que no pueden ser drenadas con un solo tubo y que podrían requerir tratamiento quirúrgico más agresivo como toracotomía abierta con liberación de estas adherencias.
Múltiples artículos recientes abogan por el tratamiento quirúrgico agresivo en niños tempranamente, para evitar las secuelas a largo plazo y disminuir el tiempo de hospitalización (básicamente minitoracotomía con decorticación limitada).
El tubo a tórax se debe dejar en general hasta que el drenaje sea menor de 50 cc/día o hasta que el líquido sea claro.
En los últimos años han aparecido en la literatura mundial varios trabajos que demuestran la efectividad y los mínimos efectos secundarios de la aplicación de agentes fibrinoliticos en la cavidad pleural de pacientes con empiemas tabicados.
Los dos más utilizados son la estreptokinasa y la urokinasa. Los resultados son prometedores en estados avanzados de empiemas en niños y probablemente en poco tiempo empezaremos a utilizarlas en nuestro medio.
Agente fibrinolitico
El agente fibrinolitico se introduce dentro de la cavidad pleural a través del tubo a tórax con el fin de lisar las adherencias para lograr un drenaje adecuado de toda la cavidad pleural. El método usual es diluir 250.000 unidades de estreptokinasa o 100.000 U de urokinasa en 100 cc de solución salina. Esta solución se inyecta por el tubo a tórax, el cual es pinzado por 4 horas y luego se reasume el drenaje.
Otra modalidad terapéutica que ha ganado importancia en los últimos años para el tratamiento de empiema tabicado es la video-toracoscopia. Por medio de una instrumentacion relativamente sencilla se rompen los tabiques pleurales y es posibleevitar la necesidad de cirugías mayores en pacientes con empiema en fase fibrinopurulenta, en nuestro medio se ha empezado a utilizar con buenos resultados.
Con el tratamiento descrito, la mayoría de los pacientes con empiema evolucionan satisfactoriamente en pocos días y el pronóstico a largo plazo es excelente, pero definitivamente depende de la rapidez y agresividad del manejo adecuado.
Bibliografía
Brusch JL, Weinstein L. Pleural Empyema. In Feigin Textbook of pediatric infectious disesase. 1992; 315-20. W.B. Saunders.
Bullard KM, Adzick NS. State of the Art: Pediatric Thoracoscopy; a new vista. Pediatric Pulmonol. 1996; 22: 129-35
De Campos JR et al. Thoracoscopy in children and adolescents. Chest 111: 494-497. 1997.
Golladay E, Wagner CW. Management of Empyema in Children. Am J Surg. 158: 618-622. 1989.
Henschle C. et al. The Pathogenesis, Radiologic Evaluation and Therapy of pleural Effusions. Radiol Clin of N.A. 1241-1255. Nov. 1989.
Hoff SJ. et al. Post-neumonic empyema in childhood: Selecting appropiate therapy. J of Pediatr Surg. 1989.
Kornecki A, Sivan Y. Treatment of loculated pleural effusion with intrapleural urokinase in children. J Pediatr Surg. 32: 1473-1475. 1997.
Krishnan S, Amin N, Dozor AJ, Stringel G. Urokinase in the management of complicated parapneumonic effussions in children. Chest. 112:1579-1583. 1997.
Le Roux, BT. Empyema thoracis and Lung Abscess. Curr. Prob Surgery. Págs. 1-89, 1986.
Pagtakhan R, Montgomery M. Pleuresy and Empyema. In Kendig Disorders of the Respiratory Tract in Children. Págs. 436-445. W.B. Saunders. 1990.
Rizalar R et al. Postpneumonic empyema in children treated by early decortication. Eur J Pediatr Surg. 1997; 7: 135-7
Solak, H. et al. Methods of treatment of childhood empyema in a Turkish universitary hospital. Chest. 1987; 92: 517-51 9.
Striffeler, H el al. Video-assisted thoracoscopic surgery for fibrinopurulent pleural empyema in 67 patients. Ann Thorac Surg. 1998; 65: 319-23.