El derrame pleural es una entidad frecuente en clínica, a la que debe enfrentarse no solo el médico neumólogo sino otros especialistas y el médico general. Con base en la tabla 1, que muestra las causas de derrame, revisaremos esta patología desde el punto de vista clínico, destacando las características más sobresalientes de cada entidad, deteniéndonos posteriormente en su análisis citológico. Tabla 1. Tomado y modificado de Bartter et al. The evaluation of pleural effusion. Chest 1994; 106:1209-14
|
Transudados Publicidad |
|
| Falla cardíaca | Atelectasias |
| Cirrosis | Mixedema |
| Síndrome Nefrótico | Urinotórax |
| Diálisis peritoneal | Embolismo pulmonar |
|
Exudados |
|
| Neoplasias | Otras Inflamatorias |
| Pulmón | Embolismo pulmonar |
| Linfoma | S. de Dressler |
| Mesotelioma | Asbestosis |
| Metastásicas | Uremia |
| S. de Kaposi | Pulmón atrapado |
| Terapia de radiación | De origen ginecológico |
| Infecciosas | Enfermedades linfáticas |
| Paraneumónicas | Quilotórax |
| Tuberculosis | Linfangioleiomiomatosis |
| Micóticas | Sindrome uñas amarillas |
| Virales | |
| Parasitarias | Inducido por drogas |
| Abscesos abdominales | Enfs Colágeno-vasculares |
| Infección por VIH | Lupus eritematoso |
| Gastrointestinales no infecciosas | Artritis reumatoidea |
| Pancreatitis | G. de Wegener |
| Ruptura esofágica | S. Churg-Strauss |
| Cirugía abdominal | S. Sjogren |
| Escleroterapia várices esofágicas | Linfadenopatía Inm |
Bustillo JG * , Ojeda P.**
* Médico neumólogo Hospital de La Samaritana. Jefe de Medicina Interna Hospital J.N.Corpas
**Médico Patólogo. Jefe Departamento Patología Hospital Santa Clara. Profesor U El Bosque.
Falla cardíaca congestiva
Es probablemente la causa más común de derrame pleural (DP). De 402 pacientes con falla cardíaca revisados por Race y asociados (1), 290 tuvieron DP, de los cuales, 88% lo presentaron en forma bilateral, 8% unilateral derecho y 4% unilateral izquierdo.
Las anteriores cifras colocan en tela de juicio el concepto que se tenía en el pasado respecto a que los derrames secundarios a falla eran comúnmente unilaterales derechos o al menos eran mucho más grandes de ese lado. Los pacientes con enfermedad pericárdica, tienden por el contrario, a presentar derrames unilaterales izquierdos (1). (Lea también: Neumotorax)
Acumulación y remoción de líquido pleural
Los conceptos de acumulación y remoción de líquido pleural en los pacientes con falla cardíaca, han experimentado algunas revisiones y cambios en los últimos años.
Al parecer, la elevada presión en los capilares pulmonares, al momento de la falla izquierda, conlleva un aumento de líquido al espacio intersticial del pulmón, líquido que alcanza el espacio pleural a través de la alta permeabilidad de la pleura visceral.
El derrame se presenta cuando la cantidad que entra al espacio pleural, excede la capacidad de los linfáticos de la pleura parietal para ser drenado.
Trasudado
Se presenta como un trasudado compuesto en su mayoría por células mesoteliales y linfocitos, siendo raro que los polimorfonucleares excedan el 10%. El gradiente de albúmina pleural/albúmina sérica, mayor de 1.2 g por dL, no deja dudas sobre la falla como origen del derrame; cifras menores obligan a la exclusión de neoplasia o embolismo pulmonar(1). Importante es recordar que el trasudado de los pacientes con falla tratados con diuréticos, puede adquirir características de exudado (2).
Clínicamente se relaciona más con falla izquierda que con falla derecha, cursando con cardiomegalia y no con fiebre ni dolor pleurítico, circunstancias estas que obligan a excluir otra patología. En la misma serie de Race, 21% de los pacientes con falla cardíaca y derrame pleural tuvieron embolismo pulmonar en la autopsia.
La diálisis peritoneal, cirrosis, mixedema, glomerulonefritis, hipoalbuminemia, el urinotórax (secundario a uropatía obstructiva, trauma litiasis o transplante renal); atelectasias , sindrome nefrótico y la obstrucción de vena cava superior, son las otras entidades que cursan con derrames tipo trasudados.
Un buen porcentaje de derrames secundarios a sindrome nefrótico son de localización subpulmonar; en ellos además, dada la deficiencia adquirida de proteína S y de que el síndrome puede ser debido o complicado por trombosis de la vena renal, se debería considerar siempre la posibilidad de TEP.
Las heridas penetrantes y las fracturas o cirugías de la columna torácica pueden presentarse ocasionalmente con derrames, al crearse fístulas subaracnoideas hacia el espacio pleural (1).
Derrame paraneumónico
Se conoce como tal cualquier derrame pleural asociado con neumonía bacteriana, absceso pulmonar o bronquiectasias. Junto con los derrames malignos y la tuberculosis, constituyen las 3 causas más frecuentes de exudado.
De acuerdo a la revisión de dos series, (1) aproximadamente un 62% de los casos muestran aislamiento exclusivo de bacterias aeróbicas, un 13% solo de anaeróbicas y entre un 16-23%, de ambos grupos.
Aunque el porcentaje de aislamiento del germen guarda relación con la serie revisada, con el grupo de edad, con el énfasis puesto en la búsqueda de anaerobios o con la disponibilidad de recursos para aislarlos, Light, con base en tres grandes series de los años setenta, ochenta y noventa allega las siguientes consideraciones:
1. Los organismos aeróbicos son aislados un poco más frecuente que los anaeróbicos, conformando el S. aureus y el S. pneumoniae, el 70% de todos los aeróbicos gram positivos aislados.
2. Cuando existe un solo organismo gram positivo aeróbico en el líquido pleural, casi siempre es S. aureus, S. pneumoniae o S. pyogenes, siendo los cultivos del líquido pleural generalmente negativos en pacientes con derrames paraneumónicos por neumococos
3. Los aeróbicos gram positivos son aislados dos veces más que los aeróbicos gram negativos, constituyendo la Klebsiella, Pseudomona y H. Influenzae el 75% de todos los empiemas por aeróbicos gram negativos con un solo organismo aislado, ya que aunque el E. Coli es el gram negativo aeróbico más comúnmente aislado, por si solo es raramente responsable del empiema.
4. Los organismos anaeróbicos solos, generalmente no causan empiemas, constituyéndose las especies de Bacteroides y de Peptoestreptococos, en las dos más comúnmente aisladas(1).
Esquema de clasificación y tratamiento para derrames paraneumónicos y epidermas
La tabla 2 muestra el esquema propuesto por Light para clasificación y tratamiento de los derrames paraneumónicos y de los empiemas, dejando en claro que en ciertos casos, la disponibilidad de recursos limita al médico tratante en el seguimiento estricto de los parámetros propuestos. Estos conceptos, propuestos por Light desde 1973, han sido desde entonces, objeto de varias revisiones.
Tabla 2. Esquema de clasificación y tratamiento para derrames paraneumónicos y epidermas.
Tomado de Clinics in Chest medicine Vol 19, número 2, Junio 1998
| CLASE 1 No significativo |
10mm En Radiografía de decúbito no está indicada la toracentesis. |
| CLASE 2 Derrame paraneumónico típico |
10 mm Glucosa mgs/dL, Ph >7,2 Gram y cultivo negativos solo antibióticos. |
| CLASE 3 Derrame pleural complicado !borderline! |
Ph 7- 7,0 o DHL>1000 y Glucosa >40 mg/dL Gram y cultivo negativos Antibiótico |
| CLASE 4 Derrame pleural complicado simple |
Ph <7,0 o Glucosa < 40 mg/dL, o Gram o cultivo positivos. No loculado,no, franca pus tubo de tórax más antibbióticos. |
| CLASE 5 Derrame pleural complicado complejo |
Ph <7,0 o Glucosa < 40 mg/dL, o Gram o cultivo positivos. Multiloculado.Tubo de torax más trombolíticos Torascopía di lo anterior no es efectivo. |
| CLASE 6 Empiema simple |
Franca pus lóculo único Tubo de tórax +decorticación |
| CLASE 7 Emfiema complejo |
Múltiples lóculos Tubo de tórax más trombolíticos decorticación generalmennte requiere torascopía o decorticación. |
Antibioticoterapia
Se encuentra indicada en todos los casos de neumonía con derrame pleural, siendo suficiente su utilización, como único tratamiento, en la denominada clase 1. Es menester recordar, que a excepción de los aminoglucósidos, la mayoría de antibióticos alcanza buenos niveles en los empiemas.
Toracentesis
Se recomienda toracentesis diagnóstica y a la vez terapéutica, para los pacientes en clase 2; si el líquido recurre, se recomienda una segunda toracentesis terapéutica, colocando un tubo de tórax en caso que los resultados de esa segunda intervención muestren parámetros bioquímicos de empeoramiento.
Tubo de toracostomía y terapia intrapleural trombolítica
Encuentra su indicación en la condición anotada. El tubo debe ser conectado a un sistema de drenaje con agua , sellado y con succión. Si la pleura visceral se encuentra cubierta con una capa fibrinosa, la aplicación de presión negativa puede facilitar la expansión del pulmón y el cierre de la cavidad del empiema.
Si en 24 horas no existe mejoría clínico-radiológica, debe pensarse en un tubo mal situado u ocluído, en mala escogencia del antibiótico o en un derrame loculado; la última circunstancia es indicación de terapia trombolítica intrapleural o de toracoscopia, con el fin de romper las adherencias de fibrina.
Solo en casos de franco empiema se aconseja el uso de tubos grandes; los clases 3, 4 y 5 responden bien a tubos pequeños que sean insertados percutáneamente y con ayuda imagenológica, debido probablemente a su exacta ubicación.
El tubo puede ser retirado cuando el drenaje es menor a 50 ml/24 hs. En caso de persistir el drenaje purulento, pese a la mejoría clínica, la utilización de medio de contraste a través del tubo puede ayudarnos a escoger entre esperar o hacer una decorticación, dependiendo del tamaño de la cavidad encontrada.
También debe retirarse el tubo cuando el nivel del líquido en su interior ha dejado de fluctuar con los movimientos respiratorios ya que esta última condición, aparte de no servir a ningún propósito, puede contribuir a agravar la infección pleural.
Toracoscopia, toracotomía con decorticación y drenaje abierto
La primera encuentra su indicación en aquellos pacientes en quienes fracasaron el tubo de tórax más los trombolíticos.
Previa a su realización se aconseja una tomografía, que entre muchas otras cosas permitirá observar si existe exclusivamente engrosamiento de la pleura visceral sin septa, circunstancia que sugiere que el empiema es crónico y que muy probablemente se necesitará de una decorticación con toracotomía, cirugía que no debe realizarse en pacientes muy debilitados y que solo está indicada si los procedimientos ya anotados fueron incapaces de controlar la sepsis.
Con la decorticación se logra evacuar la pus, remover el tejido fibroso y permitir la expansión pulmonar.
Es importante recalcar que en la fase aguda su indicación es solo controlar la sepsis y no tratar el engrosamiento pleural, el cual generalmente se resuelve en un período comprendido entre varias semanas a seis meses; si al cabo de este tiempo el engrosamiento limita la función pulmonar , se realizará decorticación siempre y cuando esta devuelva más funcionalidad que la que eventualmente pueda perderse con la misma cirugía.
En pacientes muy debilitados el drenaje abierto es una alternativa para la decorticación. Necesita de la fusión previa de las pleuras y consiste en la resección segmentaria de una a tres costillas cercanas a la parte más declive del empiema, con la colocación de varios tubos dentro de la cavidad de este y la irrigación diaria de una solución antiséptica.
Derrame pleural maligno
Es la segunda causa de derrame pleural tipo exudado, después de los derrames paraneumónicos. Las neoplasias de pulmón, seno y linfomas, según las series de Spriggs-Boddington y Anderson, son las responsables del 75% de estos derrames, siguiéndoles las neoplasias de ovario, sarcomas, útero, estómago, colon y páncreas.
Cualquier tipo celular de cáncer pulmonar puede ocasionar derrame, pero parece ser más frecuente con el tipo adenocarcinoma.
En dos series de cáncer de seno diseminado, el derrame se localizó en más de la mitad de los casos, en el mismo lado de la lesión primaria, en una quinta parte, en el lado opuesto, y en un porcentaje menor, en ambos lados.
El intervalo entre el tumor primario de seno y la aparición del derrame pleural es alrededor de dos años, pero también puede tomarse tanto como 20 años. En el cáncer del pulmón, el derrame ipsilateral es la regla. En otros casos diferentes a pulmón y seno no parece existir predilección ipsilateral, siendo comunes los derrames bilaterales(1).
Radiológicamente el derrame varía de grande a moderado. Un 10% se presenta con derrames menores de 500 ml y 10% con derrames masivos (cerca de 70% de pacientes con derrame masivo tienen malignidad subyacente).
Es práctico destacar que en presencia de derrame bilateral y silueta cardíaca normal, un 50% de estos pacientes cursan con derrames malignos o paramalignos, debiéndose considerar también como diagnósticos diferenciales el lupus, la hipoalbuminemia, pericarditis constrictiva, derrame reumatoideo, cirrosis y asbestosis benigna.
La ausencia de desviación contralateral del mediastino en presencia de supuestos grandes derrames debe hacernos sospechar:
a. Atelectasia secundaria a carcinoma del bronquio fuente ipsilateral.
b. Mediastino “congelado” o fijo, por ganglios linfáticos malignos.
c. Mesotelioma maligno.
d. Extensa infiltración pulmonar del tumor semejando derrame.
Destaquemos también que los pacientes con enfermedad de Hodgkin y derrame pleural, casi siempre presentan compromiso de ganglios linfáticos intratorácicos (no siempre evidentes en la radiografía) pero poco compromiso pleural(4).
Mecanismos fisiopatológicos del derrame
En la génesis del derrame de origen maligno están implicados varios mecanismos fisiopatológicos, dentro de los que se cuentan:
1. Efectos locales del tumor
A esta categoría corresponden:
a. Disminución del drenaje del líquido pleural condicionada por obstrucción metastásica de los vasos linfáticos de la pleura parietal o por compromiso neoplásico de los ganglios mediastinales, sitio al que drenan además dichos linfáticos.
b. Obstrucción del conducto torácico, caso en el cual el resultado es un quilotórax, siendo los linfomas responsables del 75% de los casos.
c. Aumento de la presión negativa intrapleural secundaria a las atelectasias post-obstructivas de los bronquios principales y lobares.
d. Obstrucción bronquial con neumonía distal y derrame paraneumónico subsecuente.
e. Aumento de la presión hidrostática de la circulación pulmonar y sistémica en los casos de derrame pericárdico.
f. Sindrome de vena cava superior.
g. Pulmón atrapado.
2. Efectos sistémicos del tumor
Corresponden a esta categoría:
a. Embolismo pulmonar por estado hipercoagulable.
b. Hipoalbuminemia.
3. Complicaciones de la radio y de la quimioterapia
La primera puede causar pleuritis 6 semanas a 6 meses después de la radiación, o fibrosis mediastinal, pericarditis constrictiva u obstrucción de la vena cava superior en estadíos más tardíos. Las drogas empleadas en la quimioterapia pueden también ser responsables del derrame.
4. Invasión directa de vasos sanguíneos
5. Incrementada permeabilidad capilar
Causada por substancias vasoactivas tales como el factor de crecimiento endotelial vascular, el cual se ha postulado como el responsable del derrame en los casos de las metástasis pleurales.
Los mecanismos cuarto y quinto serían los responsables de la presencia de células tumorales en las citologías del líquido y en las biopsias pleurales; al derrame resultante se le ha denominado derrame pleural maligno, el cual comporta inoperabilidad del tumor y mal pronóstico, mientras que en los tres primeros mecanismos no se detectan células tumorales en el líquido ni en la biopsia, no es sinónimo de inoperabilidad y algunos autores lo conocen como derrame paramaligno.
Metástasis pleurales
Clínicamente, debido a que las metástasis pleurales implican una enfermedad bastante avanzada, estos pacientes a menudo tienen apariencia de estar crónicamente enfermos, con importante pérdida de peso, disnea y tos.
Sin embargo, en la serie de Chernow y Sahn (5) cerca de 25% de estos pacientes estaban “asintomáticos” al momento de la presentación; en ellos, el derrame pleural maligno fue primero sospechado al examen físico o diagnosticado de rutina en una radiografía de tórax.
Las características del líquido corresponden generalmente a un exudado que puede variar de seroso o serosanguinolento a francamente hemorrágico, con una celularidad basada en linfocitos del tipo linfocitos T, presentes en cantidades de 50-70% (menos de los observados en TBC donde alcanzan a ser mayores de 90%) los que se cree que jueguen papel en la defensa local contra la invasión tumoral de la pleura; la prevalencia de eosinófilos, mayor de 10, aunque reduce la probabilidad de malignidad, no la excluye. Un 10% de los derrames pueden ser trasudados.
Células malignas en el líquido
En cuanto a las células malignas en el líquido, son raras en algunos casos, mientras que en otros constituyen la casi totalidad de la población. Los tumores de varios meses de evolución, que han alterado la barrera pleural, cursan con glucosa baja ya que es poca la cantidad de esta que puede pasar de la sangre al espacio pleural.
A ello obedece que un derrame maligno con glucosa baja habla de una gran extensión del tumor debido a su mayor tiempo de evolución, con un pronóstico más pobre; ahora bien, la cantidad de glucosa que logra pasar, es metabolizada por las células normales y por las tumorales, a CO2 y DHL, substancias que al no poder atravesar la barrera pleural en sentido contrario, se encontrarán elevadas en el análisis del líquido (4).
Diagnóstico
La forma de establecer el diagnóstico es por citología y/o biopsia pleural. El exámen citológico aumenta su rendimiento diagnóstico cuando se combina con examen del bloque celular.
En caso de adenocarcinoma metastásico el análisis citológico establecerá el diagnóstico en más del 70% de los casos; en 20% de los escamocelulares; 25-50% en casos de linfoma y 25% en los casos de sarcoma que comprometen la pleura(6).
Estos porcentajes lógicamente variarán de acuerdo con la experiencia del operador y del citopatólogo. Con base en un análisis de más de 500 casos en la literatura, el rendimiento de la citología del líquido es de 66% (mayor sensibilidad que la biopsia pleural), aumentando a 73% cuando se combina con biopsia pleural (sensibilidad de 46%).
Sin embargo se considera que la biopsia pleural a ciegas con aguja, ayuda poco al análisis citológico en términos de diagnóstico de cáncer pleural, recurriéndose a la toracoscopia como el procedimiento de escogencia para pacientes con sospecha de cáncer y examen citológico negativo.
En los casos de sospecha de linfoma la citometría de flujo puede demostrar la presencia de un clono celular en el líquido, estableciendo el diagnóstico(6). La medición de niveles de marcadores tumorales en el líquido no se recomienda para el diagnóstico, debido a que no son 100% específicos (1).
Toracoscopia
Con base en la toracoscopia se cree que las metástasis inicialmente ocurren en la pleura mediastinal y diafragmática, diseminándose luego a las áreas cefálicas y costales en la medida que el tumor progresa, incrementándose al mismo tiempo el rendimiento de la citología y de la biopsia pleural a ciegas.
Ante la sospecha inicial de derrame maligno, se deben extraer varios cientos de mililitros de líquido, no porque la maniobra conlleve un más alto rendimiento diagnóstico sino porque en caso de que la primera citología sea negativa, una segunda toracentesis días más tarde puede mostrar menos células mesoteliales degenerativas con células malignas recién desprendidas.
Cuando 3 especímenes de líquido son enviados separadamente a un citopatólogo experimentado, se espera un diagnóstico positivo en 80% de los pacientes, sin embargo, se recomienda que en presencia de dos exámenes citológicos y una biopsia pleural negativa, no se intente una tercera citología ni una segunda biopsia debido a que usualmente no son diagnósticas.
En estos casos el médico debe decidirse por esperar varias semanas y repetir las pruebas, o llevar al paciente a toracoscopia, recordando que mientras más toracentesis y biopsias cerradas se hubiesen practicado, más adherencias habrá que interfieran con la toracoscopia.
Ahora bien, ya que la toracoscopia es muy efectiva en establecer el diagnóstico y en vista que la biopsia con aguja es diagnóstica en menos de 20% de pacientes, solo se escogerá esta última opción en casos de citología negativa con toracoscopio no disponible.
TACs
En caso de primario desconocido se recomienda TAC de tórax, abdomen y pelvis. Solo si existen anormalidades en tórax, se recomienda broncoscopia. Se practicará una evaluación detallada del órgano que manifieste síntomas.
Si es mujer debe realizarse mamografía y un cuidadoso examen pélvico. Si esta secuencia no demuestra el sitio, no se recomienda continuar con otros exámenes(1).
Aunque ningún factor es realmente exacto en predecir sobrevida (pH, glucosa, escala de Karnofsky), el más importante parece ser la fuente del tumor, variando según estudios, de 2.3 meses en neoplasias de tracto gastrointestinal, hasta 6 meses en aquellos con mesotelioma.
Dentro del grupo de derrames debe ser incluído también el causado por el mesotelioma, asociado en su gran mayoría a trabajadores de asbesto, con exposiciones que en ocasiones pueden no ser muy obvias. Se sospechará en pacientes con derrame, engrosamiento pleural y disminución de volumen del hemitórax ipsilateral.
Como la citología y la biopsia pleural no pueden distinguir entre mesotelioma y adenocarcinoma metastásico, se recomienda la biopsia abierta o por toracoscopia. Las coloraciones histoquímicas, los estudios de inmunoperoxidasa con anticuerpos monoclonales y la microscopía electrónica, son técnicas actualmente disponibles, capaces de mejorar la exactitud diagnóstica para este tipo de tumores.
Tratamiento paliativo de los derrames pleurales malignos
El tratamiento paliativo de los derrames pleurales malignos lo constituye en la actualidad la pleurodesis con talco, aunque substancias como bleomicina y tetraciclina también han mostrado utilidad. Antes de realizar el procedimiento es conveniente recordar que algunos derrames malignos (los ocasionados por linfomas, cáncer de seno u ovario) pueden resolver después de la quimio o la radioterapia.
Los pacientes con pulmón atrapado, que no expande, no se beneficiarán de la pleurodesis; las opciones para ellos las constituyen el cortocircuíto pleuroperitoneal, la implantación del llamado catéter Pleur X, la toracentesis seriada, pleurectomía, radioterapia pleural o el tratamiento paliativo.
El catéter Pleur X, insertado bajo anestesia local y manejado en el hogar, permite al paciente o sus familiares, drenar el líquido siempre que el derrame se haga sintomático (7). Una modalidad similar, muy recursiva y adaptada a nuestro medio es actualmente objeto de estudio por parte del grupo de cirujanos de tórax del Instituto Colombiano de Cancerología (8)
El grado de disnea se correlaciona directamente con el volumen del derrame y con la función pulmonar subyacente. Quienes más se ven beneficiados con toracentesis terapeútica, en cuanto a alivio de su disnea, son especialmente aquellos con desviación contralateral del mediastino, no así los que presentan atelectasia o neumonitis obstructivas o enfermedad parenquimatosa infiltrativa.
Es preciso recordar que el volumen removido por toracentesis no se correlaciona mililitro a mililitro con la mejoría de los volúmenes pulmonares, como también que la Capacidad Pulmonar Total (CPT) incrementa aproximadamente un tercio del volumen del líquido removido, mientras que la Capacidad Vital Forzada incrementa casi la mitad de lo que lo hace la CPT.3
Tuberculosis
En muchas partes del mundo la tuberculosis sigue siendo la causa más común de derrame pleural en ausencia de enfermedad pulmonar demostrable y su diagnóstico debe ser considerado en cualquier paciente con derrame tipo exudado.
En ausencia de tuberculosis radiológicamente aparente, el derrame casi siempre es secuela de una infección primaria ocurrida 2-3 meses antes, o puede también ser la expresión de una tuberculosis de reactivación.
La hipersensibilidad retardada, aunque no siempre, parece explicar el desarrollo del derrame, al incrementar la permeabilidad de los capilares pleurales a las proteínas, lo cual conduciría a una más alta formación y acumulación de líquido en el espacio pleural. Por otro lado, parece que la intensa reacción inflamatoria en la pleura parietal impide el drenaje linfático del espacio pleural, conduciendo a la acumulación del líquido.
Adenosín deaminasa ADA
La titulación de Adenosín deaminasa (ADA) ha variado según los autores, con puntos de corte fluctuando entre 33-50 U por litro. Un trabajo Colombiano al igual que otros de diferentes países, demuestra que títulos superiores a 50 U/l son altamente sugestivos y pueden sustentar la terapia a menos que se sospeche empiema o derrame por artritis reumatoidea (9), entidades que por lo demás, no cursan con lpredominio linfocitario en el líquido.
Otros investigadores Colombianos (10) han concluído que la titulación de ADA en líquido pleural es un examen sensible (97.6%) y específico (82.2%) con un punto de corte de 36 U/l, mientras que Lee et al (11) encontraron puntos de corte por encima de 40 U/l en 253 de 254 pacientes con pleuritis tuberculosa.
La ADA presenta dos formas moleculares: 1 y 2, siendo la ADA2 la que con más frecuencia se encuentra en pacientes tuberculosos y la ADA1 en otros líquidos pleurales, aunque la titulación de isoenzimas rara vez es necesaria en el diagnóstico de pleuritis tuberculosa. El comportamiento de ADA en líquido pleural es igual para los pacientes con infección por VIH.
Otros métodos diagnósticos
Otros métodos alternativos utilizados para establecer el diagnóstico consisten en la medición de Interferón gama y en la detección de DNA micobacteriano por la técnica de PCR (6), métodos que por ahora no superan en operatividad y costo beneficio a la técnica de ADA, por lo menos en poblaciones como la nuestra.
Particularudades del derrame tuberculoso
Como particularidades del derrame tuberculoso se podrían resaltar la no rara presentación de tipo agudo, con dolor pleurítico, tos y fiebre como las manifestaciones más frecuentes; su predominio en personas jóvenes, aunque los pacientes con derrame secundario a reactivación tienden a ser más viejos que aquellos con derrame postprimario.
La apariencia amarillo-cetrina, excepcionalmente hemorrágica, con predominio de linfocitos, los cuales, cuando están en un rango superior a 85% hacen muy sugestivo el diagnóstico; su tamaño pequeño a moderado, aunque se han descrito ocupaciones de un hemitórax entero.
La alta negatividad de la coloración y del cultivo para el bacilo y su tendencia a resolverse espontáneamente aún sin tratamiento, solo para reaparecer años más tarde como tuberculosis activa (Más del 50% desarrollarán tuberculosis activa pulmonar o extrapulmonar dentro de los próximos 5 años).
Los pacientes con VIH tienden a presentar más signos y síntomas sistémicos, como sudoración nocturna, diarrea, fatiga, hepatoesplenomegalia y linfadenopatía. , teniendo más probabilidad que los VIH negativos de que la coloración y el cultivo sean positivos para BK. Si el conteo de CD4 es menor de 100, casi el 50% tienen coloración positiva para BK en el líquido(1).
El derrame debido a Micobacterias no tuberculosas es raro, recomendando algunos autores que si alguna de estas micobacterias es aislada del líquido, no debería ser considerada como la causa etiológica del derrame a menos que exista evidencia del mismo organismo infectando otro tejido (12)
Tratamiento y evolución
Con el tratamiento, el paciente generalmente se torna afebril en dos semanas, sin embargo, la fiebre puede persistir hasta por 2 meses. El derrame casi siempre se resuelve en el término de 6 semanas, pero puede persistir por 3-4 meses; las secuelas son mínimas y la toracentesis no parece jugar papel en su disminución a menos que el derrame sea masivo(4).
El valor de los corticoides orales en el tratamiento de la pleuritis tuberculosa es controversial. Si al momento de iniciar el tratamiento se practica una toracentesis terapéutica, el paciente puede quedar sin fiebre en el término de 5 días.
El tratamiento es con las mismas drogas y durante el mismo tiempo que para las formas pulmonares, observándose ocasionalmente una recaída paradójica al inicio del mismo, con aumento del derrame y de la disnea, dentro de los que un porcentaje mejoran con toracentesis y esteroides. Algunos autores han implicado a la pleuritis lúpica inducida por isoniacida como la responsable de la respuesta paradójica(1).
El empiema tuberculoso constituye la otra forma de presentación de tuberculosis pleural, siendo la consecuencia de ruptura de cavitaciones parenquimatosas hacia esta cavidad; a diferencia de la anterior, la confirmación bacteriológica es mucho más fácil y requiere, como parte del tratamiento, el drenaje por toracostomía.
Tromboembolismo Pulmonar (TEP)
El TEP continúa siendo una entidad muy frecuente (entre una cuarta parte y la mitad de todas las autopsias presentan este hallazgo), con una mortalidad que varía entre 18-35% cuando no se diagnostica y se trata prontamente (la falta de especificidad de los síntomas, la presencia de enfermedades pulmonares comórbidas y la ausencia de una prueba diagnóstica que llene todas las expectativas, contribuyen a que el diagnóstico antemorten correcto solo sea realizado en un 30% de los casos).
Este diagnóstico debería ser considerado entonces en cualquier paciente con un derrame pleural de origen incierto, sobre todo si se acompaña de taquicardia, taquipnea y dolor pleurítico en el lado del derrame, dolor que en ocasiones puede confundirse con enfermedad coronaria o con neumonía, sobre todo si se acompaña de fiebre (40% o más de los pacientes con TEP presentan fiebre; diaforesis, hemoptisis (30%) y síncope (13%) pueden también estar presentes(17)
Mecanismos fisiopatológicos responsables de su origen
Entre los mecanismos fisiopatológicos responsables de su origen se destacan la obstrucción de los vasos pulmonares y el aumento de permeabilidad de los mismos; en el primer caso, la acumulación de líquido es la resultante de un incremento de presión en los capilares de la pleura parietal debido a la falla derecha condicionada a su turno por la obstrucción vascular.
En el segundo caso, la liberación de mediadores inflamatorios por parte de las plaquetas del trombo, o la isquemia de los capilares distales a la obstrucción, conlleva a un aumento de la permeabilidad de los capilares pulmonares o de los de la pleura visceral, con salida de líquido y proteínas que vienen a acumularse en el espacio pleural. De acuerdo a cual mecanismo esté presente, el derrame presentará las características de transudado o de exudado.
El derrame acompaña a un 30-50% de los pacientes con TEP y generalmente es pequeño, ocupando menos del 15% del hemitórax o limitándose a borrar el ángulo costofrénico, pero en ocasiones, sobre todo cuando se acompaña de infiltrados parenquimatosos (que pueden corresponder a infarto), puede ocupar un porcentaje mayor (Estudio PIOPED).
Casi siempre se presenta en un solo lado, aunque ocasionalmente puede ser bilateral. En los casos en que el TEP se acompaña de infarto pulmonar (15%), la necrosis del tejido pulmonar puede condicionar derrame hemorrágico en más del 80% de los casos, aunque 35% de pacientes con TEP sin infarto radiológico también tendrán derrame hemorrágico (13).
Derrames secundarios a TEP
Las “características” que en algún momento se le atribuyeron a los derrames secundarios a TEP (exudados hemorrágicos neutrofílicos) no son muy confiables debido a sus patrones altamente variables, debiéndose resaltar que virtualmente, cualquier apariencia del líquido con cualquier componente químico o celular, es compatible con el diagnóstico.
No sobra recalcar sin embargo que un derrame hemorrágico debe sugerir el diagnóstico, sobre todo si se ha excluído trauma, malignidad o sindrome de injuria postcardíaca(12).
Prueba de tamizaje Dímero D
Algunos autores (6) consideran al Dímero D en sangre periférica como la mejor prueba de tamizaje. Una prueba negativa realizada con un test sensible (ELISA), excluye TEP. Una prueba positiva obliga a la realización de otros exámenes para excluirlo.
Una gamagrafía de perfusión negativa virtualmente excluye TEP mientras que una de alta probabilidad permite el diagnóstico en un 87% de los casos. El problema lo constituyen las gamagrafías de probabilidad intermedia, las cuales obligan a la realización de otras pruebas.
Lo anterior, sumado al hecho de que los infiltrados parenquimatosos y aún los derrames, pueden alterar la gamagrafía de perfusión, ha conducido a muchos centros a la realización de TAC helicoidal como el método de escogencia para el diagnóstico de TEP, debido además a su gran sensibilidad para detectar émbolos en las arterias principales, lobares y segmentarias.
El rendimiento no es óptimo para las arterias subsegmentarias, pero si tenemos en cuenta que según el estudio PIOPED allí solo se localiza un 6% de los émbolos, la prueba parece rendir más beneficios que otras, sobre todo que también permite obtener información sobre parenquima, pleura, ganglios y pericardio(1).
Pacientes con infarto y derrame pleural
Los pacientes sin evidencia radiológica de infarto aclaran sus derrames en menos de 7 días con la terapia anticoagulante; aquellos con infarto se toman más tiempo en hacerlo. Durante los postoperatorios, la presencia de nuevos infiltrados pulmonares debe hacer sospechar TEP, sobre todo si desaparecen en algunos días. (14).
El derrame que acompaña al TEP generalmente alcanza su mayor volumen durante las primeras 72 horas , si el derrame aumenta después de este tiempo, debe pensarse en embolismo recurrente, hemotórax por anticoagulaciòn, infarto infectado o en un diagnóstico alterno(4).
Cuando un derrame incrementa en tamaño en un paciente con TEP, se debería realizar una toracentesis diagnóstica con el fin de excluir derrame paraneumónico complicado o hemotórax. En caso de obtenerse líquido hemorrágico, si el hematocrito del líquido es más del 50% del de lsangre periférica, se suspender la anticoagulación y colocar un tubo a tórax.
Cirrosis
Derrame pleural puede ocurrir ante la sola presencia de cirrosis, pero es mucho más frecuente cuando la ascítis está presente.
El mecanismo de la disminución de la presión oncótica plasmática no parece ser la causa predominante y de hecho, el mecanismo principal parece ser el paso de líquido ascítico hacia la cavidad pleural, a través de defectos microscópicos causados en el diafragma, como consecuencia del estiramiento al que se ve sometido este músculo en presencia de un incremento de la presión abdominal. En algunos pacientes con cirrosis, el paso del líquido a través del diafragma puede llevarse a cabo por intermedio de los vasos linfáticos.
Derrames asociados a patología abdominal
a. Pancreatitis aguda
Puede asociarse a un derrame pleural pequeño., unilateral y de predominio izquierdo, pero puede ser también derecho o bilateral. En su génesis se ha comprometido a la red de linfáticos que interconectan las porciones peritoneal y pleural del diafragma, al alto contenido enzimático del líquido, capaz de aumentar la permeabilidad o de obstruir los vasos linfáticos pleurales, y a la misma inflamación del diafragma, la cual puede incrementar la permeabilidad capilar en la pleura diafragmática.
El cuadro clínico está dominado por los síntomas abdominales, pero en ocasiones puede simular una neumonía o un embolismo pulmonar. El derrame no amerita tratamiento específico y se resuelve en la medida que lo hace la pancreatitis.
La radiografía, aparte del derrame, puede mostrar elevación del diafragma o infiltrados basales. La determinación de amilasa pleural, que va incrementando a medida que pasa el tiempo hasta hacerse mayor que en suero, contribuye al diagnóstico. Tener en cuenta que 10% de las neoplasias, el embarazo ectópico, la ruptura esofágica y algunas neumonías, también pueden elevar los títulos de amilasa en lìquido pleural.(4)
b. Absceso pancreático
Se acompaña también de derrame y debe sospecharse si el paciente no responde a la terapia de la pancreatitis o si después de una o dos semanas de la misma empieza a presentar leucocitosis y fiebre.
c. Seudoquiste pancreático
Aproximadamente un 10% de pacientes con pancreatitis desarrollará esta patología y un porcentaje de ellos cursará con derrame, cuyo mecanismo es el establecimiento de un tracto fistuloso que comunica directamente el páncreas con el espacio pleural. El derrame, rico en amilasa, es en la gran mayoría de los casos unilateral izquierdo, pero puede también ser unilateral derecho o bilateral.
d. Absceso subfrénico
Puede ser el resultado de cirugías abdominales (las de bazo, estómago, duodeno y páncreas predisponen a formación de abscesos izquierdos, mientras que las del tracto biliar son la causa más frecuente de abscesos derechos); perforación visceral (apéndice, colon, vesícula); diverticulitis; colecistitis; pancreatitis y trauma.
La incidencia se incrementa con la cirugía de emergencia, el sangrado y la contaminación por contenido intestinal. En casos de intervención quirúrgica el intervalo entre esta y la aparición del absceso puede variar entre 1-3 semanas y hasta 5 meses.
La inflamación diafragmática resultante del absceso adyacente probablemente incremente la permeabilidad de los capilares en la pleura diafragmática y conduzca al derrame, el cual puede estar presente en 60-80% de los casos y acompañarse de infiltrados pulmonares basales, atelectasias, elevación del hemidiafragma y a menudo gas, visible en la cavidad del absceso. El empiema secundario a la penetración diafragmática por el absceso ha sido informado hasta en 18% de los casos.
Las manifestaciones clínicas pueden ser proteiformes debido al uso de antibióticos, no siendo raros el dolor abdominal y/o pleurítico, dolor en el hombro y fiebre. La aspiración con aguja dirigida por TAC permite aislar el germen, que en la mayoría de los casos corresponden a E. Coli y a Staphyfilococcus aureus. Los derrames estériles se resuelven con el tratamiento del absceso; el empiema debe manejarse como tal (1)(15).
e. Abscesos intrahepáticos
De estos llaman la atención el absceso piógeno y el amebiano. Ambos pueden manifestarse como un simple derrame pleural debido a irritación diafragmática, o como un empiema, secundario a la ruptura del absceso dentro del espacio pleural.
En el primer caso se puede observar una elevación del hemidiafragma con atelectasias y un pequeño derrame derecho, cuyo único tratamiento puede ser toracentesis terapeútica y antibióticos. La ruptura del absceso hacia el espacio pleural produce un dolor agudo en el cuadrante superior derecho con dificultad respiratoria, sepsis y desviaciòn contralateral del mediastino debido al derrame masivo, el cual es achocolatado, pudiéndose rara vez recuperar el parásito.
La toracostomía y los antibióticos (una tercera parte tiene infección bacteriana concomitante) constituyen el tratamiento. Duque, en su estudio sobre Amibiasis fatal en Colombia, muestra que de 84 casos de absceso hepático, 41 (48%)presentaron perforación a cavidad torácica (16). Es pertinente anotar que para la fecha del estudio no se contaba aún con los métodos diagnósticos actuales.
f. Patología esplénica
1. Absceso esplénico. Es una entidad rara, que la mayoría de las veces resulta de diseminación hematógena, como en el caso de las endocarditis. El derrame puede acompañarse de trombocitosis.
2. Traumas de bazo. Pueden conllevar a hemotórax como consecuencia de ruptura esplénica, o a derrame pleural izquierdo, seroso o hemorrágico, como causa de un hematoma subcapsular secundario a un trauma ocurrido tiempo atrás y del cual a veces el paciente ni recuerda; esta patología debe tenerse en cuenta en todo derrame izquierdo de causa no clara.
3. Infarto. Puede ser la consecuencia de hemoglobinopatías y ser causa de derrames.
g. Perforación esofágica
El derrame que acompaña a esta entidad es un exudado rico en amilasa salival y células epiteliales escamosas, generalmente izquierdo, pero puede también ser derecho o bilateral, y acompañarse de ensanchamiento mediastinal, neumotórax y/o neumomediastino.
Debe sospecharse en pacientes quienes después de una endoscopia esofágica laboriosa (remoción de cuerpo extraño, dilatación de estrecheces etc) , desarrollan dolor torácico (perforaciones cervicales) o epigátrico con disnea o disfagia (perforaciones distales).
La presencia de enfisema subcutáneo es una manifestación tardía, presentándose en el cuello en las perforaciones cervicales y en mediastino en las de esófago intratorácico. Los de cuello pueden ser vistos en la radioografía aún antes que puedan ser palpados. La perforación puede también ser el resultado de vómito copioso, carcinoma esofágico y traumas u operaciones de tórax.
Debido a la morbimortalidad que comporta la mediastinitis causada por el contenido orofaríngeo, la entidad demanda un rápido diagnóstico el cual se establece con un esofagograma con medio de contraste diferente al bario, debido a la marcada reacción inflamatoria que este produce en la pleura.
Se aconseja la administración de medios solubles en agua, con el paciente en decúbito lateral; si no se observa perforación se debe entonces continuar con un trago de bario. En la medida que transcurre el tiempo la amilasa de origen salivar y los anaerobios de la cavidad bucal alcanzan el espacio pleural.
La mala colocación de tubos de alimentación parenteral que en ocasiones y en pacientes sedados pueden perforar esófago, penetrar los bronquios y penetrar al parenquima pulmonar, han sido descritos como causa de complicaciones pleuropulmonares, entre ellas hemotórax, empiema, fístula broncopleural y depósito de la alimentación enteral en el espacio pleural(1,15).
h. Hernia diafragmática
Puede simular o acompañarse de derrame pleural. La presencia de aire en el contenido intestinal herniado conduce al diagnóstico, el cual se comprueba con estudios de contraste del tracto gastrointestinal. Un 95% son del lado izquierdo, existiendo muchas veces el antecedente de trauma de tórax (accidente automovilístico, caídas de grandes alturas). La estrangulación de la hernia se presenta con signos agudos de catástrofe abdominal.
i. Procedimientos abdominales quirúrgicos
La incidencia de derrame que acompaña a las cirugías abdominales, sobre todo a las altas, es importante; la mayoría de las veces son pequeños, de tipo exudado, se resuelven espontáneamente y parecen estar relacionados a irritación diafragmática o a atelectasias. Cuando superan Los l0mm de engrosamiento en una radiografía decúbito lateral, se aconseja toracentesis para excluir infección.
j. Escleroterapia esofágica endoscópica
Los derrames secundarios a esta patología generalmente son exudados sin predilección por ningún lado, presentes en las 48-72 horas post procedimiento y secundarios posiblemente a la inflamación pleural que sigue a la inyección de la substancia. No requieren terapia específica y se resuelven en varios días o semanas.
k. Las fístulas del árbol biliar
Hacia la cavidad pleural, condicionadas por trauma tóracoabdominal o por complicaciones obstructivas del mismo, así como la escleroterapia de várices esofágicas y los transplantes hepáticos, cierran el capítulo de derrames pleurales de causa abdominal.
Derrames asociados a enfermedades del colágeno
El derrame que acompaña a la Artritis Reumatoidea ocurre en aproximadamente 5% de pacientes con esta entidad; generalmente se presenta en hombres, con nódulos subcutáneos concomitantes y cuando la artritis ha estado presente por varios años.
Casi siempre ocupa menos del 50% del hemitórax, aunque ocasionalmente pueden ser mayores; en la mayoría de los casos es unilateral (aunque puede ser bilateral) y no tiene predilección por ningún lado. En la tercera parte de los casos se asocia a compromiso parenquimatoso del tipo intersticial o a nódulos pulmonares.
El líquido se caracteriza por contener niveles de glucosa por debajo de 40 mgs/dl, niveles elevados de DHL y de ADA, son de frecuente observación, así como bajos niveles de complemento y altos títulos de factor reumatoideo. Altos niveles de colesterol también han sido informados, confiriéndole entonces un color lechoso.
Citológicamente puede encontrarse macrófagos gigantes multinucleados, que aunque descritos como únicos en esta entidad, su especificidad y sensibilidad no está definida. El conteo de leucocitos puede mostrar indistintamente predominio de polimorfonucleares si la toracentesis guarda relación con el episodio agudo, o de linfocitos si el proceso es más crónico.
El derrame puede tomarse de semanas a meses para su resolución espontánea o hacerlo con las drogas administradas para la artritis; se ha descrito también evolución hacia el engrosamiento pleural, requiriendo decorticación. La toracentesis puede ser una alternativa en los casos de derrame con dificultad respiratoria(18).
Lupus eritematoso
En cuanto al Lupus Eritematoso, la pleura resulta comprometida más frecuentemente en esta entidad que en cualquier otra enfermedad del colágeno, siendo la mayoría mujeres en cualquier grupo de edad, con derrame de localización bilateral en un 50% de los casos y tamaños que típicamente varían de pequeños a moderados, aunque pueden, en raras ocasiones, ser masivos.
La radiografía puede mostrar además, infiltrados, atelectasias y silueta cardíaca aumentada de tamaño ya sea por falla cardíaca secundaria a enfermedad renal, o por derrame pericárdico.
El derrame consiste en un exudado seroso o serosanguinolento, rara vez hemorrágico, con un recuento leucocitario que puede demostrar predominio de polimorfonucleares o de mononucleares, siendo estos últimos más frecuentes en derrames mayores de 1 semana. Dolor pleurítico, tos, disnea, frote pleural y fiebre constituyen la forma más frecuente de presentación clínica. La inmunofluorescencia combinada con la microscopía de luz, permite el diagnóstico en los especímenes de biopsia pleural.
Presencia de ANAS en el líquido pleural
La presencia de ANAS en líquido pleural es la prueba más útil para establecer el diagnóstico de derrame lúpico, recomendándose pensar en otras etiologías cuando los títulos son menores de 1:320.
Los ANAS además, han venido a reemplazar la búsqueda de células LE en el líquido, examen este último, que aunque parece ser específico para lupus, presenta unos rangos de sensibilidad demasiado grandes y emplea mucho tiempo en su preparación, aunque tiene la ventaja de que a veces puede presentarse en el líquido antes que en el plasma (4).
A diferencia de la artritis reumatoidea, el derrame del lupus sí responde a la administración de esteroides, presentando además, niveles de glucosa por encima de 70- 80 mgs, aunque también se han informado niveles bajos de glucosa en el lìquido.
La DHL con frecuencia se encuentra por debajo de 500 U/L. El derrame se resuelve rápidamente con los esteroides, aunque puede hacerlo también espontáneamente, siendo rara vez necesario recurrir al tubo de tórax. La pleurodesis o los cortocircuítos pleuroperitoneales son una alternativa en caso de grandes derrames que no respondan a esteroides.
Es pertinente recordar que en los pacientes con lupus, otras causas de derrame pueden incluir embolismo pulmonar, infecciones, falla cardíaca, sindrome nefrótico y uremia.. Ciertas drogas como la hidralazina, isoniacida, quinidina, fenitoína y clorpromazina están definitivamente incriminadas en la producción del sindrome lúpico, con presencia de ANAS, derrame pleural y síntomas que desaparecen al suspender las drogas(19)
El derrame pleural ha sido también descrito como acompañante del Sindrome de Churg Strauss y de la Granulomatosis de Wegener. En otras enfermedades del colágeno como poliarteritis nodosa, escleroderma o dermatomiositis, parece deberse más a complicaciones (falla cardíaca, embolismo pulmonar), que a una entidad primaria.
Drogas
Dentro de las drogas capaces de causar derrame pleural deben tenerse en mente la Amiodarona, Metotrexate, Bleomicina, Nitrofurantoína y las ya mencionadas en el aparte de Lupus.
Derrame pleural secundario a VIH
La distribución de las enfermedades que causan derrame en presencia de sida, varía ampliamente según las series, moviéndose entre TBC, Kaposi, empiema por bacterias aeróbicas, linfoma, hipoalbuminemia, falla renal y pancreatitis básicamente.
Sarcoma de Kaposi
El Sarcoma de Kaposi es una de las causas más frecuentes, presentándose con derrame en 50% de los casos, uni o bilateral, constituído por un exudado serosanguinolento o hemorrágico que muchas veces se acompaña de infiltrados parenquimatosos y puede coexistir con infecciones oportunistas, debiéndose pensar en ellas cuando se acompaña de opacidades en vidrio esmerilado o de adenopatías mediastinales.
La patogénesis no está clara; un 20% son quilotórax y la causa parece ser el compromiso del conducto torácico por el sarcoma, en los restantes se ha atribuído posiblemente a la elaboración de substancias por parte del tumor, que incrementarían la permeabilidad vascular, tales como el factor de crecimiento endotelial vascular.
El diagnóstico se establece por toracoscopia y no por biopsia con aguja, ya que la pleura parietal no está comprometida. La toracoscopia permite además la abrasión pleural o la pleurectomía, procedimientos que además del cortocircuíto pleuroperitoneal, son los tratamientos de escogencia en el difícil manejo de esta entidad, cuyo pronóstico es de 4 a 7 meses una vez establecido el diagnóstico.
En pacientes con VIH y derrame paraneumónico o empiema, los micro organismos causantes y el manejo, son iguales que en el resto de la población.
En cuanto a la tuberculosis, se ha observado que los derrames por esta causa son más frecuentes en pacientes con conteos de CD4 por encima de 200 por mm3
Pleuresía por Carini
Aunque se han informado algunos contados casos de pleuresía por Carini, observado en el derrame con la coloración de plata metenamina y en pacientes tratados con pentamidina aerosolizada, esta complicación es poco común, al igual que los derrames causados por Micobacterias no tuberculosas.
El estudio integral del derrame en un paciente con VIH debería incluir coloraciones y cultivos para bacterias, micobacterias y hongos; citología con especial énfasis en linfoma; realización de ADA y coloración para Carini en caso de antecedente de pentamidina aerosolizada.
Si se trata de un exudado, no hay estigmas externos de Kaposi y las pruebas anteriores son negativas, probablemente el paso siguiente es una toracoscopia, la cual permite, además de establecer el diagnóstico de otras entidades oportunistas o neoplásicas, realizar abrasión pleural para evitar recurrencias(20-1).
Otras causas de derrame (1-4-21)
Sarcoidosis
El compromiso pleural es relativamente raro en comparación con el que experimentan el parenquima y los ganglios. Los casos se han informado en los estados 1 y 2 y se recomienda excluir otras posibles causas antes de dar por sentada a la sarcoidosis como la etiología definitiva.
Terapia de radiación
Asume dos modalidades: La pleuritis por radiación, presente dentro de los seis meses que siguen a la misma, tiende hacia la adherencia y loculación, a persistir en el tiempo y a ser unilateral y hemorrágica. La otra forma se presenta 1-2 años después de la irradiación , como complicación de fibrosis mediastinal (pericarditis constrictiva con o sin taponamiento, obstrucción linfática u obstrucción de vena cava superior)
Síndrome de injuria post cardíaca o S. de Dressler
Ha sido descrito después de infarto miocárdico, cirugía cardíaca, trauma de tórax, punción ventricular izquierda percutánea e implantación de marcapaso. Se caracteriza por fiebre, pleuropericarditis e infiltrados parenquimatosos en promedio 3 semanas después de una injuria al miocardio o al pericardio. La mayoría se presenta con derrame uni o bilateral, serosanguinolento o hemorrágico, generalmente autolimitado, que se resuelve en 1-3 semanas y que responde bien a la aspirina o a los AINES.
Derrame pleural benigno por exposición a asbesto
Es la manifestación más común por exposición a asbesto, con períodos de latencia muy variable, descritos entre 1 a 50 años. La mayoría de los pacientes son asintomáticos , descubiertos por una radiografía de rutina que muestra un derrame unilateral, pequeño, tipo exudado serosanguinolento, seroso o hemorrágico, con eosinofilia hasta en 50% de las veces.
Puede resolverse entre 1-4 meses, dejando obliteración del ángulo costofrénico o engrosamiento pleural difuso. La recurrencia es común y algunos pueden desarrollar severa fibrosis pleural bilateral progresiva, o mesotelioma maligno.
Derrame pleural urémico
Ha sido informado en cerca de 20% de autopsias de pacientes con uremia y en aquellos sometidos a hemodiálisis crónica. Consiste en un exudado, generalmente unilateral, serosanguinolento, hemorrágico o seroso, con predominio linfocitario y alta concentración de creatinina , que se puede presentar con fiebre, dolor torácico y tos.
El diagnóstico diferencial de todo paciente sometido a diálisis y que presente derrame, debe incluir falla cardíaca, derrame urémico, sindrome nefrótico y derrame tuberculoso. El derrame generalmente se resuelve con la diálisis en el término de semanas, pero puede recurrir.
Derrame por pulmón atrapado
Consiste en una membrana fibrosa que atrapa parte del pulmón e impide su expansión. Resulta generalmente de empiemas o hemotórax no drenados, o de pleuresías reumáticas o urémicas. Debido a que el pulmón no se expande, la presión intrapleural se vuelve más negativa, lo que favorece la acumulación de un líquido que puede ser trasudado o exudado, en el espacio pleural. Los pacientes sintomáticos deben ser considerados para decorticación.
Actinomicosis y nocardiosis
Estas dos bacterias son capaces de producir derrame. En la Actinomicosis la presencia de abscesos o de tractos fistulosos en la pared torácica sugiere el diagnóstico. El derrame puede ser seroso o francamente purulento y en él, la coloración de Gram permite observar la presencia de largos filamentos ramificados Gram positivos, aunque el diagnósico definitivo se establece con la demostración de Actinomyces Israelii en cultivos anaeróbicos.
La Nocardiosis debe sospecharse en pacientes inmunosuprimidos, con infiltrados pulmonares crónicos y derrame pleural, cuyo Gram, al igual que el de esputo o del BAL, puede revelar los típicos filamentos ramificados Gram positivos
Derrames causados por parásitos
Además de la amebiasis, ya descrita, se cuentan las debidas a Equinococo y Paragonimiasis. Debe sospecharse en las áreas donde ellos tienen predilección: Sudeste asiático, Méjico, Argentina, Uruguay, Chile, Líbano y Grecia, para el Equinococo y Corea, Japón e Indochina, para el Paragonimus W.
Derrames causados por hongos
Los hongos son apenas responsables del 1% del total de derrames pleurales.
Paracoccidioidomicosis
De esta entidad, endémica en Brasil, Colombia y Venezuela, llama la atención la ausencia de lesión pleural.
Histoplasmosis
Micosis frecuente en Norte y Suramérica, incluyendo los países ya citados. El derrame pleural puede ser una forma de presentación de la histoplasmosis pulmonar primaria solo en un grupo de población constituído por niños y pacientes de edad, al igual que en inmunocomprometidos, sobre todo por VIH. Rara vez el hongo puede ser cultivado del líquido o de la biopsia pleural, la cual puede mostrar granulomas no caseificantes.
Criptococosis
Aunque el compromiso pleural no es frecuente, se puede observar en la forma pulmonar progresiva. Los pacientes generalmente tienen enfermedades subyacentes del tipo leucemia o linfoma y están recibiendo esteroides. El cultivo del líquido puede hacer el diagnóstico aunque no en todos los casos.
Coccidioidomicosis
Es una entidad rara en Colombia, habiéndose comprobado infección solo en 9-13% de personas normales residentes en las zonas semidesérticas de Guajira, Cesar y Bajo Magdalena. El derrame pleural puede verse solo en cerca del 10% de los pacientes con la forma primaria.
En la forma diseminada las lesiones pulmonares pueden abscedarse y comprometer la pleura originando empiema. El diagnóstico se establece por cultivo del líquido y/o por cultivo y estudio histopatológico de la biopsia. La mayoría de Los pacientes con infección primaria y derrame pleural no requieren terapia antifúngica; el derrame se resuelve espontáneamente en varias semanas.
Blastomicosis
Ampliamente conocida en Norteamérica. El compromiso pleural puede observarse en la forma pulmonar crónica. El cultivo del líquido es frecuentemente positivo.
Derrames causados por virus y otros microorganismos
Probablemente los virus sean responsables de muchos más derrames pleurales que lo que se estima; la aparente baja incidencia puede ser debida a dificultades diagnósticas, ya que muchos hospitales no realizan cultivos ni tienen la disponibilidad de pruebas serológicas.
El líquido se ha catalogado como un exudado rico en linfocitos. Entre Los virus capaces de causarlo se cuentan: Hantavirus, Adenovirus Pneumonía, Hepatitis, Mononucleosis infecciosa y virus del Dengue hemorrágico; la patogenia en esta última entidad parece ser un aumento de permeabilidad mediada por citoquinas, que da origen a pequeños trasudados o exudados, uni o bilaterales. El Micoplasma, las Rickettsias y la Ehrlichiosis, se cuentan como causas de derrame causados por otros microorganismos.
Derrame pleural de orígen ginecológico
Comprende 5 entidades:
1. Sindrome de hiperestimulación ovárica
Se presenta como complicación de la ovulación inducida con gonadotropina coriónica humana con fines de fertilización in vitro. La forma severa cursa con ascitis, derrame pleural o ambos. En los pacientes con derrames bilaterales el mecanismo posiblemente obedece a un sindrome generalizado de permeabilidad capilar, mientras que en pacientes con grandes derrames derechos se debe probablemente a paso directo del líquido del espacio peritoneal al pleural.
2. Derrame pleural fetal
Su prevalencia es de l en 10.000 partos. Consiste en presencia de derrame generalmente quilosoen el pulmón fetalcuya compresión conduce a hipoplasia, que puede resultar en muerte perinatal. Su tratamiento es controversial e incluye observación, amniocentesis y toracentesis diagnóstica, cortocircuíto pleuro amniótico o repetidas toracentesis.
3. Derrame post parto
Puede presentarse en el post parto inmediato, con mecanismo desconocido hasta el presente, no necesitando tratamiento en ausencia de síntomas, o presentarse en el post parto tardío, caso en el que se recomienda evaluación para anticuerpos antifosfolípidos, con base en 4 casos hasta ahora informados.
4. Síndrome de Meigs
Hace parte de esta patología cualquier paciente con una neoplasia pélvica, ascitis y derrame pleural, en quien la extirpación del tumor se acompañe de desaparición de los derrames.
5. Endometriosis
El líquido en este caso se piensa que alcanza la pleura a través del diafragma, como en el S. de Meigs.
Quilotórax y seudoquilotórax
El quilotórax consiste en la acumulación de quilo en el espacio pleural como consecuencia de la ruptura del conducto torácico debido a causas tumorales (linfoma en 75% de los casos) ; traumáticas (procedimientos quirúrgicos cardiovasculares, pulmonares o esofágicos, siendo particularmente frecuentes en las cirugías quwe movilizan la arteria subclavia izquierda) y congénitas.
Otras causas comprenden: fusión tóraco lumbar para corrección de cifosis, disección de nódulo cervical, herida penetrante en tórax o cuello, hiperextensión de columna, trauma torácico cerrado, trombosis de vena cava superior o de vena subclavia y cirrosis, sindrome nefrótico, linfangioleiomiomatosis, Kaposi en pacientes con sida, fibrosis mediastinal inducida por radiación, e hipotiroidismo.
Como no todos los quilotórax tiene apariencia lechosa, se sugiere hacer medición de lípidos en todo derrame de causa no esclarecida; si el nivel de triglicéridos en el líquido está por encima de 110 mgs por dL y la relación de colesterol pleural/colesterol sérico es menor de 1, se establece el diagnóstico de quilotórax. El tratamiento depende de la etiología.
El seudoquilotórax consiste en la acumulación de líquido pleural con apariencia lechosa, parecido a empiema, cuya causa no es la ruptura del conducto torácico sino la presencia muchas veces, de un derrame crónico o de tuberculosis no tratada.
La presencia de cristales de colesterol en la coloración del sedimento y la presencia de niveles pleurales de colesterol mayores de 200 mgs por dL apuntan hacia presencia de seudoquilotórax, aunque dichos niveles pueden estar también elevados en el quilotórax.
En caso de duda se practicará análisis de lipoproteínas, ya que solo los líquidos pleurales quilosos contienen quilomicrones. El tratamiento, excluída una tuberculosis no tratada, consiste en toracentesis terapeútica si existe limitación al ejercicio, o la decorticación si el paciente está sintomático y el pulmón subyacente está sano.
Derrames de causa no definida
Hasta en un 15% de pacientes no se puede establecer la causa del derrame aún después de procedimientos invasivos como toracoscopia o biopsia pleural abierta.
Análisis citológico del líquido pleural
Aunque el examen del líquido pleural puede dar una variada información, el principal propósito al utilizar el análisis citológico, es detectar la presencia o ausencia de células neoplásicas. Para un óptimo rendimiento debe existir una obtención, preservación y procesamiento adecuados.
En la práctica, uno de Los problemas más comunes es la diferenciación entre células mesoteliales reactivas y células neoplásicas, pues es bien conocido el potencial de la célula mesotelial para asumir formas atípicas bajo ciertas condiciones como inflamación y lesiones físicas o térmicas.
Células mesoteliales normales
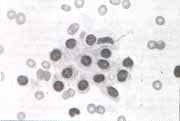
Las células mesoteliales normales (fig 1) son redondas u ovales, con un diámetro entre 7-15 micras, con citoplasma denso, basofílico o anfofílico, de núcleo redondo u oval , generalmente central y con cromatina granular, pudiendo ser observados pequeños nucleolos. Usualmente se encuentran sueltas pero se pueden agrupar en monocapas.
La presencia de células mesoteliales en el líquido pleural en un porcentaje menor a 15% eleva la posibilidad que el derrame sea secundario a tuberculosis, mientras que por otro lado, 4 series separadas han han confirmado que el líquido pleural de de pacientes con tuberculosis, rara vez conctiene más de 5% de células mesoteliales.
Desafortunadamente la ausencia de estas células no es diagnóstica de tuberculosis, ya que en cualquier condición en que la superficie pleural se vea extensamente comprometida por un proceso inflamatorio, dichas células no son encontradas en el líquido pleural un número superior a 16% puede apuntar hacia derrames de etiología maligna, por falla cardíaca o por colagenosis, entre otras.
Figura 1. Células mesoteliales normales
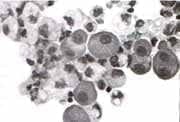
Las células mesoteliales reactivas (fig 2) son grandes, redondas u ovales, varían de tamañoalcanzando entre 15-40 micras, su núcleo es redondo y oval, de localización paracentral y poseen macronucléolos, siendo comunes la bi y la multinecleación. Pueden observarse solas o en grupos que asumen la configuración poligonal, o en mosaicos con ventanas entre ellas, que se colorean con PAS y Alcian Blue.
Figura 2. Células mesoteliales reactivas
Las células neoplásicas (fig 3) son grandes, con núcleos que exceden 50 micras de diámetro, con macronucléolos y con una alta relación núcleo-citoplasma.
Figura 3. Células neoplásicas

El uso de anticuerpos monoclonales dirigido contra varios antígenos es útil en distinguir derrames pleurales benignos de malignos, existiendo estudios que comparan la utilidad de diferentes anticuerpos en la diferenciación de los 3 tipos de células citadas.
Los adenocarcinomas metastásicos tienden a teñir positivo con antígeno carcinoembrionario (CEA), MOC-3.1 LEU-M1, B72.3, Ver-EP4 y BG-8, mientras que las células mesoteliales reactivas o las células mesoteliales malignas no tiñen positivo con ninguno de estos anticuerpos.
Para Mesotelioma sonde utilidad la Calretinina y Citoqueratina 5/6, destacando que las células mesoteliales benignas también son positivas para estos últimos marcadores (24).
Conteo celular diferencial
La relación entre el momento en que se realiza la toracentesis y el tiempo de evolución del derrame, determina el predominio celular. Así, los exudados agudos muestran un predominio de PMN, con más del 50% del total de células (derrames secundarios a neumonía, TEP y pancreatitis, por ej.), con predominio posterior de mononucleares a medida que el derrame evoluciona.
Sin embargo, se puede afirmar que los trasudados generalmente tienen menos de 1000 leucocitos; los exudados crónicos tipo tuberculosis y neoplasias generalmente tienen menos de 5000; leucocitos mayores de 10.000 indican una severa inflamación pleural como la observada en derrames paraneumónicos, aunque también puede ser vista en pancreatitis, infarto pulmonar, pleuresìa aguda por asbesto y sindrome de injuria post cardíaca.
Finalmente, conteos mayores de 50.000/ul generalmente solo se encuentran en derrames paraneumónicos tipo empiemas (4)
La presencia de linfocitosis, más de 50% en líquidos tipo exudado, apuntan hacia tuberculosis o cáncer; conteos de 85-90% son particularmente sugestivos de tuberculosis, aunque también debe considerarse linfoma, sarcoidosis y enfermedad reumática crónica.
Un tercio de pacientes con derrame tipo trasudado mostrará predominio de linfocitos, lo cual no tiene importancia clínica ni es indicación para biopsia pleural.
Eosinofilia en el líquida pleural
La eosinofilia en el líquido pleural, definida como el porcentaje de eosinófilos mayor de 10, reduce la probabilidad de malignidad o de tuberculosis, asociándose con presencia de aire o sangre en el espacio pleural.
Su diagnóstico diferencial incluye infarto pulmonar, hemotórax, neumotórax, toracentesis previa, enfermedades parasitarias (paragonimiasis o enfermedad hidatídica), infecciones por hongos (histoplasmosis), pleuresía por asbesto, Churg Strauss y administración de drogas tipo nitrofurantoína, y bromocriptina entre otras (3-23-25).
Los macrófagos no tienen valor diagnóstico, salvo que deben ser diferenciados de las células mesoteliales, ya que la presencia de macrófagos no excluye tuberculosis pleural, mientras que la presencia de más de 15% de células mesoteliales en un exudado, virtualmente excluye este diagnóstico.
La presencia de gran número de células plasmáticas en el líquido sugiere mieloma múltiple con compromiso pleural.
Cerca de 50% de exudados y 10-15% de trasudados pueden ser sanguinolentos. En pacientes con derrames de origen neoplásico el conteo de eritrocitos fluctúa entre 30.000-50.000/ul. Conteos superiores a 100.000 eritrocitos/Ul apuntan hacia trauma, malignidad, embolismo pulmonar, pleuresía por asbesto y sidrome de injuria post cardíaca (S. de Dressler).
Bloque celular
Resulta de centrifugar mínimo 50cc de líquido pleural, sin heparina, durante 10 minutos a 3000 rpm, decantando posteriormente el sobrenadante y fijando el bloque obtenido con formol al 10% durante un mínimo de 4 horas. (fig 4)
Permite analizar un número mayor de células que la citología, mostrando un alto rendimiento en carcinomas metastásicos a pleura provenientes de ovario, mama, pulmón, páncreas, tracto gastro intestinal y riñón (22).
Figura 4. Bloque celular
Bibliografía
1. Light RW. Pleural diseases. 4ª edición. Baltimore. Williams and Wilkins. 2001
2. Bartter et al. The evaluation of pleural effusion Chest 1994; 106: 1209-14
3. Light RW, Rodríguez M. Management of paraneumonic effusions. In: Veena BA. Diseases of the pleura. Clinics In Chest Medicine 1998; 19-2
4. Sahn SA. State of the Art. The Pleura. Am Rev Respir Dis 1988; 138: 184-234
5. Chernow B, Sahn SA. Carcinomatous involvement of the pleura: An analysis of 96 patients Am J Med 1977; 63:695
6. Light RW. Pleural Effusion. The New England Journal of Medicine 2002; 346:1971-1977
7. Camacho F, Román Z, González M. Derrame pleural maligno. Rev Colomb Neumol 2002;14:4-7
8. López M, Buitrago R, Beltrán R. Manejo ambulatorio del derrame pleural maligno. Rev Colomb Neumol 2002; 14: 10-16
9. Posada A, Anaya J, Ortega J, Naranjo N, Guerrero MI, Orozco L, Ortega JE. Evaluación de métodos diagnósticos en derrame pleural tuberculoso. Acta Médica Colombiana 1988; 13: C198
10. Durán M, Gómez M. Adenosin deaminasa como método diagnóstico en tuberculosis pleural. Rev Colomb Neumol 1995; 7:201-4
11. Lee et al. Adenosine deaminase levels in nontuberculous lymphocytic pleural effusions. Chest 2001; 120: 356-61 Gribetz AR et al. Nontuberculous mycobacteria in pleural fluid: assessment of clinical significance. Chest 1985; 87: 495-98
12. Heffner JE. Pleural effusions from pulmonary thromboembolism. Seminars In Respiratory Medicine 1987; 9: 59-65
13. Bynum LJ, Wilson JE. Radiographic features of pleural effusions in pulmonary embolism. Am Rev Respir Dis 1978; 117:829-34
14. Shipley B. The Chest Radiograph after extratoracic surgery. Seminars in Roentgenology 1988; 23:49-60
15. Lorch DG, Sahn SA. Pleural effusions due to diseases below the diaphragm 1987; 9: 75-86
16. Duque OD. Amibiasis fatal en Colombia. Antioquia Médica 1965: 300-301
17. Goldhaber SZ. Pulmonary Embolism. The New England Journal of Medicine 1998; 339: 93-103
18. Tanoue L. Pulmonary manifestations of Rheumatoid Arthritis. In: Matthay RA. Thoracic manifestations of the systemic autoinmune diseases. Clinics In Chest Medicine 1998: 19-4
19. Murin S et al. Pulmonary manifestations of systemic Lupus Erythematosus. In :Matthay RA. Thoracic manifestations of the systemic autoimmune diseases. Clinics In Chest Medicine 1998; 19-4
20. White DA. Pulmonary complications of HIV-associated malignancies Clinics in Chest Medicine 1996; 17:4
21. Restrepo A. Micosis Pulmonares. En: Chaparro C, Awad C, Torres C. Fundamentos de Medicina. Medellín-Colombia. CIB. 1998. 187-215
22. Chapman CB et al. The examination of serous fluid by the cell-block technic. The New England Journal of Medicine. 1974, 237: 216-220
23. Adelman M et al. Diagnostic utility of pleural fluid eosinophilia. The American Journal of Medicine 1984, 77: 915-920
24. Tickman RJ et al. Distinction between carcinoma cells and mesothelial cells in serous effusions. Usefulness of inmunohistochemistry. Acta Cytologica 1990, 3: 491-496
25. Kuhn et al. Probability of malignancy in pleural fluid eosinophilia. Chest 1989: 96: 992-996