Discusión
Se ha establecido que la mujer al llegar a la edad de la menopausia inicia una pérdida progresiva de su densidad mineral ósea de 1% anual, pero este valor varía de población en población y modificado por factores medio ambientales.
Recientemente, se ha podido demostrar que las pacientes con un aumento mayor del índice de masa corporal acusan una mejor DMO y por el contrario las pacientes delgadas independientemente de los factores nutricionales, la pérdida ósea es menor.
El presente trabajo ratifica estas observaciones demostrando que las pacientes con menor índice de masa corporal tienen menor densidad mineral ósea. Las pacientes postmenopáusicas por el contrario presentan un aumento de peso frente a las lpremenopaúsicas sin ser significativo y su pérdida anual es relativamente menor al compararla con el grupo I36-37.
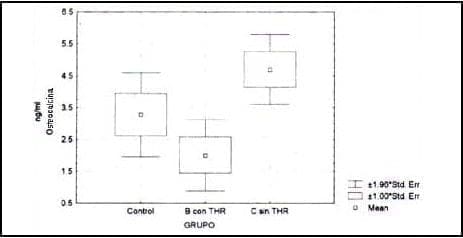
Estudios preliminares han evidenciado que la PTH y la Osteocalcina aumentan a medida que progresa la edad para declinar en la senectud. Nuestros datos confirman que esto es cierto para la PTH intacta y la osteocalcina en el grupo I, con muy pocas variaciones en el grupo II. En el grupo III como era de esperarse y descrito por otros autores estos valores disminuyen con la terapia de reemplazo hormonal y/o PTH-calcitonina38.
El estudio europeo de cohorte OFELY en 725 mujeres sanas entre 31 y 89 años se presenta una disminución de masa ósea en el nivel Lumbar de -5 a -8% después de los 40 años y en Triángulo de Wards en -11% después de los 35 años39. En otro estudio mediciones por DEXA en 16 Instituciones europeas en mujeres postmenopáusicas, encuentra una diminución en la cabeza del fémur de -1.23% a los 55 años, 0.77% año a los 65 años y -0.31% por año a los 75 años40.
Los cambios en DMO:
Demuestran en este estudio que la pérdida mineral ósea en los grupos que no reciben tratamiento a nivel lumbar es del -0.11% por año. En cuello de fémur oscila en -0.01% y -0.09%, en triángulo de Wards -0.15 – 0.27 año, con recuperación a nivel Lumbar en las que reciben tratamiento de +0.36% año, cuello de Fémur +0.01, y triángulo de Ward’s de -0.19%. La respuesta en general de la cadera es de +0.14% año que en términos generales está por debajo de lo reportado en la literatura y que podría explicarse ante el aumento de peso de éstas últimas.
Las mujeres del grupo III ingresan al estudio con menor DMO y de no haber sido por la terapia de reemplazo este grupo llegaría más rápidamente a la osteoporosis. Cabe destacar que se confirma en el seguimiento a un año en pacientes tratadas y no tratadas la pérdida de 0.1% anual en un estudio de mujeres chinas después de hacer el análisis de regresión se confirma que la disminución en cadera es -02% a -1.0%41.
Hay evidencias que el hueso tanto a nivel lumbar y en sitios de la cadera como cuello de fémur y el triángulo de Ward’s son los más sensibles para predecir el grado de pérdida ósea y la respuesta al tratamiento. En nuestros resultados es evidente esta apreciación encontrando significancia estadística no sólo en estos tres lugares sino también a nivel del trocanter.
Varios autores han correlacionado los marcadores tanto de resorción como:
De formación ósea y la densitometría. Ha sido difícil correlacionar el valor que puedan tener los marcadores a nivel urinario como predictores de pérdida ósea y sólo se ha aceptado como diagnóstico en pacientes perdedoras y rápidas o en el seguimiento de tratamientos específicos.
En el presente estudio no pudimos comprobar su valor en estas mujeres en seguimiento a largo plazo y con diferentes determinaciones. El análisis estadístico de correlación muestra en las pacientes tratadas que la relación piridinolina-creatinina correlaciona de forma significativa con los valores controles después de un año a nivel lumbar y triángulo de Ward’s42-43.
En conclusión se puede afirmar que la osteocalcina y la relación pridinolina-creatinina son unos buenos marcadores de resorción ósea en el manejo y seguimiento de las pacientes en el climaterio. Confirmando que la medición por DEXA es un buen método para evaluar la pérdida ósea.
Bibliografía
- 1. Riggs BL, Melton LJ. lll The prevention and treatment of osteoporosis. N Englan J Med 1992; 327: 620-627.
- 2. Seeman E. Reduced bone density in women with fractures: contribution of low peak bone density and rapid bone loss. Osteoporosis Int 1994; 4: 15S-25S.
- 3. Lindsay R. The menopause and osteoporosis. Obstet Gynecol 1996; 87: 16S-19S.
- 4. Nordin BEC, Need AG, Chatterson BE, Horowitz M, Morris HA. The relative contributions of age and years since menopause to postmenopausal bone loss. J Clin Endocrinol Metab 1985; 70: 83-88.
- 5. Rannevick G, Jeppsson S, Johnell O, Bjerre B, Laurell-Borulf Y, Svanberg L. A longitudinal study of the perimenopausal transition: altered prolifes os steroid and pituitary hormones, SHBG and bone mineral density. Maturitas 1995; 21: 103-113.
- 6. Albanese CV, Civitelli R, Tibollo FG, Masciangelo R, Mango D. Endocrine and physical determinants of bone mass in late postmenopause. Exp Clin Endocrinol Diabetes 1996; 104: 263-270.
- 7. Rigss BL, Wahner HW, Dunn WL et all. Rates of bone loss in the apendicular and axial skeleton of women: evidence of substantial vertebral bone loss before menopause. J Clin Invest 1986; 77: 1487-1491.
- 8. Kroger H, Heikkineme J, Laitinen K et all. Dual energy X ray absorptiometry in normal women: a cross-sectional study of 717 Finnish volunteers. Osteoporosis Int 1992; 2: 135-140.
- 9. Falch JA, Sandvik L. Perimenopausal appendicular bone loss: a ten years prospective study. Bone 1990; 11: 425-428.
- 10. Elders PJ, Lips P, Netelenbos JC et all. Long term effect of calcium supplementation on bone loss in perimenopausal women. J Bone Miner Res 1994; 9: 963-970.
- 11. Garton M, Martin J, New S et all. Bone mass and metabolism in women aged 45-55. Clin Endocrinol 1996; 44: 563-570.
- 12. Nilas L. Christiansen C. Bone mass and its relationship to age and the menopause. J Clin Endocrinol Metab 1987; 65:987-702.
- 13. Recker RR, Lappe JM, Davies KM et all. Change in bone mass inmediately before menopause. J Bone Miner Res 1992; 7: 857-862.
- 14. Lukert B, Higgins J, Stoskop JM. Menopausal bone loss is partially regulated by dietary intake of vitamin D. Calcif Tissue Int 1992; 51: 173-179.
- 15. Christiansen C. Postmenopausal bone loss and risk of osteoporosis. Osteoporosis Int 1994; 1: 47S-51.
- 16. Gallagher JC, Goldar D, Moy A. Total bone calcium in normal women: effect of age and menopause status. J Bone Miner Res 1987; 2: 491-496.
- 17. Melton LJ III, Chrischilles EA, Cooper C et all. How many women have osteoporosis? J Bone Miner Res 1992; 7: 1005-1010.
- 18. Forero MS, Klein RF, Nissenson RA et all. Effect of age on circulating immunoreactive and bioactive parathyroid levels in women. J Bone Miner Res 1987; 2: 363-366.
- 19. Alba MM, Ardila EA, Onatra W et all. Diagnóstico y manejo de mujeres con osteoporosis postmenopáusica. Rev Col Obstet Ginecol 1991; 42: 105-115.
- 20. Young G, Marcus R, Minkoff JR et all. Age related rise in parathyroid hormone in man: the use of intact and midmolecule antisera to distinguish hormone secretion from retenction. J Bone Miner Res 1987; 2: 367-374.
- 21. Guo CY, Thomas WE, Dehami AW et all. Longitudinal changes in bone mineral density and turnover in postmenopausal women with primary hyperparathyroidism. J Clin Endocrinol Metab 1996; 81: 3487-3491.
- 22. Shiele F, Arthur Y, Flanch A et all. Total tartrate-resistent and tartrate-inhibited acid phosphatases in serum: biological variations and reference limits. Clin Chem 1988; 34: 685-690.
- 23. Brawn JP, Delmas PB, Malaval L et all. Serum bone gla-protein: a specific marker of bone formation in postmenopausal osteoporosis. Lancet 1984; 1: 1091-1093.
- 24. Gamero P, Shih WJ, Gineyts E et all. Comparison of new biochemical markers of bone turnover in late postmenopausal osteoporotic women in response to alendronate treatment. J Clin Endocrinol Metab 1994; 79: 1693-1700.
- 25. Stepon JJ, Pospichell J, Scheiber V et all. The application of plasma tartrate-resistant acid phosphatase to assess changes in bone resorption in response to artificial menopause and its treatment with estrogen or norethisterone. Calcif Tissue Int 1989; 45: 237-280.
- 26. Prestwood, Pilbeam CC, Burleson JA et all. The short term effects of conjugated estrogen on bone turnover in older women. J Clin Endocrinol Metab 1994; 79: 366-371.
- 27. Calvo MS, Eyre DR, Gundberg. Molecular basis and clinical aplication of biological markers of bone turnover. Endocrin Rev 1966; 17: 333-368.
- 28. Raisz LG, Wiita B, Artis A et all. Comparison of the effects of estrogen alone plus androgen on biochemical markers of bone formation and resorption in postmenopausal women. J Clin Endocrinol Metab 1966; 81: 37-43.
- 29. Seibel MJ, Robins SP, Biblezikien JP. Urinary pyridium cross-linkes of collagen specific markers of bone resorption in metabolism bone disease. Trens Endocrinol Metab 1992; 3: 263-270.
- 30. Cosman F, Nieves J, Wilkinson C et all. Bone density change and biochemical indices of skeletal turnover. Calcif Tissue Int 1996; 58: 236-243.
- 31. OMS. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. WHO technical report. Ginebra 1994.
- 32. Garnero P, Delmas PD. Assessment of the serum levels of bone alkaline phosphatase with a new immunoradiometric assay in patients with metabolic bone disease. J Clin Endocrinol Metab 1993; 77: 1046-1053.
- 33. Cali LP, Bowers GN, Young DS. A Referee method for the determination of total calcium in serum. Chin Chem 1973; 19:1208-1213.
- 34. Uebelhart D, Gineyts E, Chapuy M et all. Urinary excretion of pyridinium crosslinks: a new marker of metabolic bone disease. Bone Miner 1990; 8: 87-96.
- 35. Norusis MJ. SPSS Base System User’s Guide. McGraw Hill. New Tork 1990.
- 36. Marcus R, Greendale G, Blunt BA. et al. Correlates of bone mineral density in the postmenopausal estrogen-rogestin intervention trial. J Bone Miner Res 1994; 9: 1467-1476.
- 37. Sánchez J, Onatra W, Villegas JG et al. Correlación entre el índice de masa corporal y densidad mineral ósea en mujeres pre y postmenopáusicas. Rev Col Menop 1997; 3: 89-92.
- 38. Hodsman AB, Fraher LJ, Watson PH et al. A randomized controlled trial to compare to efficacy of cyclical parathyroid hormone versus cyclical parathyroid hormone and sequential calcitonin to improve bone mass in postmenopausal women with osteoposis. J Clin Endocrinol Metab 1997; 82: 620-628.
- 39. Ariot ME, Sornay-Rendu E, Garnero P, Very-Marty B, Delmas PD. Apparent pre and postmenopausal bone loss evaluated by DXA at different skeletal sites in women: the OFELY cohort. J Bone Miner Res 1997; 12: 683-690.
- 40. Lunt MF, Adams J, Benevolenskaya L et al. Population based geographic variations in DXA bone density ub Europe: the EVOS study. Osteoporosis Int 1997; 7: 175-189.
- 41. Tsai KS, Chen WC, Sánchez TV et al. Bone densitometry of proximal femur in Chinese subjects: gender differences in bone mass and bone areas Bone 1977; 20: 365-369.
- 42. Taguchi Gl, Nakayama CO, Minaguchi H. Specific changes of urinary excretion of cros-linked N-telopeptides of type Y collagen in pre and postmenopausal women: correlation with other markers of bone turnover. Calcif Tissue Int 1997; 60: 317-322.
- 43. Eastell R, Colwell A, Hampton L et al. Biochemical markers of bone resorption compared with estimates of bone resorption from radiotracer kinetic studies in osteoporosis. J Bone Miner Res 1997; 12: 59-65.