Contribuciones Originales
1 Edgar Cortés Reyes Profesor Asociado, Carrera de Terapia Física Facultad
de Medicina Universidad Nacional de Colombia, 2 Astrid T. Bermúdez C.,
Sandra J. Ortiz G. Terapeutas Físicas, Universidad Nacional de Colombia.
Resumen
La osteoporosis masculina, es un problema importante de salud pública. En este documento se establece el proceso del desarrollo de esta entidad y los principales factores que la desencadenan, tomando como parámetro de comparación el descrito para la población femenina. De igual manera, se establece la influencia del ejercicio físico como uno de los elementos clave para su prevención y tratamiento.
Palabras clave: osteoporosis masculina, factor de riesgo, ejercicio físico.
Abstract
Male osteoporosis is a clinical entity not very frequently recognized and diagnosed. It represents, however, a real and important public health problem. This article considers the process of the development of the disease, its risk-factors and, most important, it analizes female parameters for comparison with the male. In addition, it determines how physical exercise acts as an important factor in osteoporosis prevention and treatment.
Key words: male osteoporosis, risk factors, physical exercise.
Introducción
A pesar de que la osteoporosis se presenta con mayor magnitud en la población femenina, se observa que en las últimas décadas se ha incrementado su incidencia en la población masculina, en cifras que aunque no iguales a las de las mujeres, son de un valor representativo. Ello determina la importancia de describir cuál es el proceso de desarrollo de la osteoporosis masculina (OM) frente a los factores de riesgo más frecuentes, tomando como punto de partida el descrito para las mujeres; de igual forma se describe la influencia del ejercicio físico en su tratamiento.
Se define la osteoporosis como una enfermedad esquelética sistémica caracterizada por una masa ósea baja y el deterioro microarquitectónico del tejido óseo, con un aumento subsecuente en la fragilidad del hueso y la susceptibilidad de éste al riesgo de fractura ante traumas leves1.
El primer síntoma de la osteoporosis, se presenta cuando la masa ósea está disminuida, el esqueleto ya no puede soportar la tensión mecánica de las actividades diarias y se originan las fracturas. La osteoporosis es responsable del acortamiento de los huesos de la columna y de la disminución de la estatura, de cifosis, de las fracturas de cadera y también de dolor considerable especialmente a nivel lumbar. Afecta a todo el sistema esquelético, en especial a los cuerpos vertebrales, costillas, fémur proximal, húmero y tercio distal del radio2; pero cuando ocurre pérdida de hueso todos los sitios pueden ser de alto riesgo3. Es por tanto que el significado clínico de la osteoporosis, se traduce en las fracturas que de ella resultan.
La incidencia de fracturas osteoporóticas aumenta con la edad en ambos sexos, lo cual está relacionado con cambios en la cantidad de tejido óseo presente en el esqueleto. El tamaño de los huesos no disminuye con la edad e incluso el grosor de los huesos tubulares puede aumentar. La porosidad de los huesos sí aumenta, por lo cual la proporción de hueso ocupado por tejido óseo disminuye. Los factores involucrados en la cantidad de hueso presente y por tanto, el riesgo de fractura en la vida adulta, son el pico de masa ósea (PMO) alcanzado durante la edad adulta temprana y la cantidad de pérdida ósea. Este PMO se logra aproximadamente alrededor de los 30 a 35 años de edad e inicia su caída alrededor de los 40 años; su máxima disminución se alcanza alrededor de los 80 años.
El PMO depende de la interacción de varios factores reguladores, dentro de los que se incluyen: influencias genéticas, de gran importancia, pues existe una estrecha correlación entre el PMO de familiares consanguíneos hasta el segundo grado4-5; el sexo es también un determinante genético mayor, tendiendo los hombres a tener una masa ósea considerablemente mayor que las mujeres, probablemente como consecuencia de las hormonas androgénicas durante la pubertad, lo que se traduce en una mayor incidencia de fracturas osteoporóticas en las mujeres4; el papel de las hormonas sexuales masculinas en esta diferencia está apoyada por el hallazgo de que la pubertad tardía en los varones se relaciona con una masa ósea reducida en la edad adulta6. Finalmente la raza, establece diferencias significativas: por ejemplo, las adolescentes de raza negra muestran una mayor aceleración del crecimiento óseo en el período prepuberal que jóvenes blancas de la misma edad, lo que resulta en un PMO alrededor de 10% mayor en mujeres negras que en blancas y una menor propensión a fracturas osteoporóticas en las primeras7.
De igual manera, los hombres negros tienen mayor contenido mineral óseo (CMO) que los blancos, en magnitudes de 5 a 20%, principalmente a nivel del radio, columna lumbar y cuello femoral. Estas variaciones acentuadas por la raza en ambos sexos, pueden ser explicadas por las diferencias dadas a nivel bioquímico, arquitectónico y genético, más que por influencias ambientales8.
Por otro lado, la pérdida ósea en la osteoporosis está asociada con otras anormalidades estructurales y cualitativas, con alteraciones en el recambio óseo para reparar el daño por fatiga y con la pérdida de conectividad de los elementos trabeculares. Estas y otras anormalidades son colectivamente llamadas “alteraciones de la calidad ósea” y aunque contribuyen a debilitar al esqueleto, algunos de dichos cambios son consecuencia directa de la pérdida de masa ósea entre sí. Por encima de esto, la masa ósea no es el único determinante de riesgo de fractura, pues otros factores como la edad, el riesgo aumentado de caídas y una pobre habilidad para reaccionar frente a estas (especialmente en los ancianos), pueden constituirse en riesgo para fracturas.
Partiendo de las generalidades de la osteoporosis, es importante establecer a continuación qué diferencias se presentan entre hombres y mujeres con relación a la ganancia y pérdida ósea.
Diferencias entre la ganancia y pérdida ósea por género
El PMO es más alto en los hombres que en las mujeres en muchos sitios esqueléticos, principalmente en aquellos donde hay mayor contenido de hueso cortical, lo cual está dado fundamentalmente porque los hombres ganan 700 gm. más de hueso que las mujeres (pico total de CMO: Hombres 3.300 g vs Mujeres 2.600 g), y sólo pierden durante la edad adulta 200 g (total CMO en la edad adulta: Hombres 3.100 g vs Mujeres 2.200 g)9.
El PMO del esqueleto apendicular es mucho mayor en hombres que en mujeres, porque los hombres tienen huesos más largos, gracias a que el crecimiento prepuberal dura dos años más en ellos, mientras que el período de crecimiento puberal es más rápido y continuo. En promedio, el período prepuberal contribuye con 10 cm (5 cm por año) mientras que el período de crecimiento puberal contribuye con dos a tres cm; todo en conjunto ofrece de 12 a 13 cm más de estatura a los hombres que a las mujeres10.
También se ha dicho que el PMO del esqueleto vertebral es mayor en hombres que en mujeres porque el cuerpo de la vértebra es más grueso y profundo (pero no más alto) en ellos9; sin embargo Genant en 1988, encontró que el pico de densidad ósea (PDO) en la columna, es similar en ambos sexos (aproximadamente 175 mg/ml). Theintz12 en 1992 también reportó que se pueden alcanzar niveles similares de PDO en el esqueleto axial y apendicular en ambos sexos. Además Mosekilde13 en 1990 registró que el cuerpo de la vértebra y la densidad trabecular es similar entre hombres y mujeres de aproximadamente 30 años de edad. Por histomorfometría, han sido encontradas observaciones similares en el volumen total de hueso trabecular en muestras de cresta iliaca14-15.
De igual manera se ha reportado que los hombres tienen mayor diámetro en los cuerpos vertebrales y en los huesos largos, así como una mayor expansión, lo cual en conjunto favorece una mayor distribución de las fuerzas y una menor fragilidad ósea cuando se les compara con las mujeres9-16.
Lo anterior hace pensar que la mayor masa ósea en hombres es atribuible más a la mayor cantidad de hueso ganado durante el crecimiento, que a la pérdida ósea dada con la edad, así como que la continua deposición dada en ellos durante la fase adulta, juega un papel importante en el mantenimiento de la fuerza ósea9. Estos datos se relacionan en la tabla 1.
Tabla 1. Diferencias relacionadas con la ganancia y pérdida ósea por género
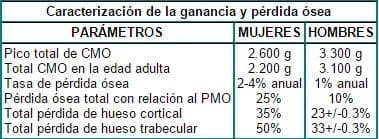
Fuente.Adaptado de SEEMAN. The American Journal of Medicine. 1993. y KANIS. Osteoporosis. 1996.
Como se observa, hay diferencias entre hombres y mujeres a nivel de la tasa de pérdida ósea: ésta es de aproximadamente 1% por año en los hombres, comenzando desde la edad mediana, mientras que en las mujeres ocurren tasas más elevadas de pérdida ósea (2-4% por año) en los primeros 5 a 10 años después de la menopausia, debido a la deficiencia gonadal3.
La pérdida ósea relacionada con el PMO alcanzado es de aproximadamente 10% en hombres y de 25% en las mujeres9. En forma similar, se ha estimado que las mujeres perderán el 35% de su hueso cortical y el 50% del trabecular, mientras que los hombres perderán dos tercios de estas cifras. La mitad de estas pérdidas de hueso trabecular estarían relacionadas con la menopausia y el resto, con factores inherentes al proceso de envejecimiento.
El hueso trabecular disminuye cuantitativamente en una forma similar entre hombres y mujeres, pero difiere cualitativamente. Aunque se presenta una disminución en el número de trabéculas y en al ancho trabecular en ambos sexos, en las mujeres predomina una reducción en el número de trabéculas y una perforación por resorción total, con pérdida de conectividad especialmente en la fase de más cambio, es decir, después de la menopausia. En los hombres, se presenta adelgazamiento trabecular con disminución de su densidad, sin que haya una perforación completa17, como se muestra en la tabla 2.
Tabla 2. Diferencias en la disminución del hueso trabecular por género
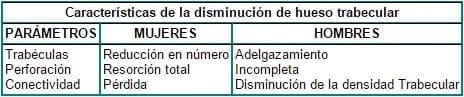
Fuente: Adaptado de SEEMAN. The American Journal of Medicine. 1995
Existen también diferencias entre ambos sexos a nivel de la pérdida cortical: tal disminución es mucho menor en hombres que en mujeres, porque hay menor resorción endocortical y mayor depósito periosteal en los hombres, gracias a que el área medular (la cual refleja resorción endocortical) incrementa en 7% por década en los hombres y en 8% por década en las mujeres. De otro lado, el área subperiosteal (la cual refleja deposición periosteal) incrementa en 2.5% por década en los hombres y en 1.1% por década en las mujeres, siendo en conjunto la disminución total del área cortical de 1.6% por década en hombres y de 7% por década en las mujeres. De igual manera, la curva de rigidez incrementa en 2.1% por década en los hombres y declina en 3.3% por década en las mujeres18, como se muestra en la tabla 3.
Tabla 3. Diferencias en la disminución del hueso cortical por género
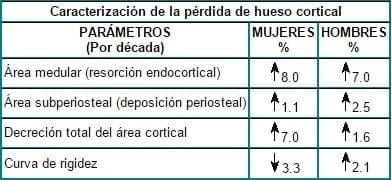
Fuente: Adaptado de RUFF. Journal of Orthopaedics and Research. 1988.
La pérdida de hueso cortical también puede acelerarse en las personas mayores de 70 años de edad (tanto hombres como mujeres), quizás porque la resorción endocortical y el aumento de la porosidad cortical incrementan la efectiva disposición de la superficie para la resorción en el hueso cortical19.
Por otro lado, existen diferencias entre ambos sexos con relación a la pérdida ósea a nivel de la columna: ésta es de 14% en los hombres y de 47% en las mujeres20. Dicha discrepancia difiere sustancialmente dependiendo del lugar de la vértebra. Por ejemplo, la disminución en el centro de la vértebra (formada por hueso trabecular), es similar entre hombres y mujeres. Partiendo desde el PDO alcanzado en la columna, la disminución es de 175 a 110 mg/ml en hombres y de 175 a 90 mg/ml en las mujeres11. Otros estudios han confirmado que la pérdida de densidad ósea trabecular a nivel del cuerpo vertebral es similar entre hombres y mujeres, siendo ésta de 50 a 60% del PDO alcanzado21.
Si se habla en términos de la cantidad de pérdida de hueso cortical a nivel vertebral, se establecen diferencias significativas entre ambos sexos, puesto que dicha disminución es mayor en las mujeres que en los hombres9. En 1989, Kalender21 demostró que la disminución del hueso cortical a nivel del cuerpo vertebral es de 0.73% por año en las mujeres y de 0.17% en los hombres, lo que está dado fundamentalmente por un proceso de compensación en los hombres consistente en una mayor formación de hueso cortical a nivel subperiosteal y a una menor resorción endocortical. Dicho proceso es menor en las mujeres13.
En forma similar, se presentan diferencias relacionadas con la disminución de la densidad ósea a nivel femoral, desde la juventud hasta la edad adulta en ambos sexos, siendo ésta de 39% en los hombres y en las mujeres las dos terceras partes de dicha cifra. En las personas mayores, la disminución ósea a este nivel es similar entre hombres y mujeres20.
Hannan22, en 1992, corroboró esta información, cuando encontró porcentajes similares de disminución (porcentaje por año) entre 437 hombres y 698 mujeres con rangos de edad entre los 68 y 98 años: de -0.69 ± 0.15 vs -0.68 ± 12 a nivel del cuello femoral, de -0.45 ± 0.17 vs – 0.53 ± 0.15 a nivel del trocánter, y de -0.88 ±0.23 vs -0.94 ± 0.12 en el triángulo de Wards. Así mismo, Warhaftig23 en 1995, reportó una disminución en el CMO de 13.5% a nivel del cuello femoral en los hombres mayores de 75 años, mientras que para hom bres entre los 50 y 59 años de edad, encontró una disminución de 8% a nivel de trocánter y de 3% a nivel del triángulo de Wards.
Es por ello que las diferencias entre ambos sexos, con relación a la ganancia y pérdida ósea cuentan en alguna medida para el riesgo diferente de fractura. En hombres, la tasa de incidencia de fractura aumenta sustancialmente después de los 70 años de edad, mientras que en las mujeres se observa un incremento después de los 45 años de edad. En mujeres, las fracturas son frecuentes a nivel del tercio distal del radio hasta más o menos la edad de 65 años; después de esta edad, las fracturas de cadera asumen una importancia mayor, no sólo en la población femenina sino también en la masculina, siendo después de los 85 años de edad, el sitio predilecto para fractura en ambos sexos6.
Pero éstas no son las únicas diferencias que se establecen entre hombres y mujeres. Existen otras diferencias sustanciales entre ambos sexos con relación a los factores de riesgo que favorecen el desarrollo de la osteoporosis. Ellas se explican a continuación.
Factores de riesgo que favorecen la osteoporosis masculina (OM)
Los factores de riesgo que favorecen el proceso de osteoporosis, marcan también diferencias sustanciales entre hombres y mujeres. La disminución de los niveles de estrógenos luego de la menopausia, es el principal factor de riesgo que determina el proceso de osteoporosis en ellas, mientras que en los hombres, elementos de tipo metabólico, hormonal y otros factores externos son los que juegan un papel importante en el desarrollo de la osteoporosis masculina.
Dentro de los factores de orden metabólico se incluyen: la mala absorción de calcio, pues favorece su balance negativo al propiciar la disminución en la cantidad absorbida por el intestino y un aumento en su excreción urinaria; el bajo consumo de vitamina D, que conduce principalmente a hiperparatiroidismo secundario y a un aumento en la actividad osteoclástica; y el alto consumo de sodio el cual favorece el aumento en la excreción urinaria de calcio e hidroxiprolina.
El nivel hormonal comprende dos grandes grupos: hiperparatiroidismo, el cual deteriora el control del balance del calcio, declina la absorción intestinal del mismo y reduce progresivamente la función renal, con lo que se compromete la capacidad de hidroxilación de la 25 hidroxivitamina D a su forma activa; y elhipogonadismo, el cual produce una disminución en el estatus androgénico, lo cual favorece la pérdida ósea, gracias a la formación reducida de hueso y a un aumento en su resorción y fragilidad, la cual conlleva posteriormente a fracturas.
Los factores externos que explican la osteoporosis masculina incluyen: el uso de glucocorticoides que provocan anormalidades en la secreción de hormonas gonadales, en la absorción de calcio y en su homeostasis renal e inhiben la actividad de los osteoblastos en forma directa produciendo una disminución en su replicación celular, con el consiguiente incremento en la degradación del colágeno de la matriz; la inmovilización, la cual genera un menor estrés en el hueso, a consecuencia de lo cual se crean cambios considerables en el metabolismo óseo e incrementos en su tasa de remodelación, dados principalmente por un desequilibrio entre la cantidad absorbida y la formación, la cual resulta en hipercalcemia, hipercalciuria y pérdida ósea. Por último, se incluyen el consumo de bebidas alcohólicas y el tabaquismo los cuales traen como consecuencia una disminución en la absorción intestinal de calcio y compromiso de la hidroxilación de la 25 hidroxivitamina D a su forma activa.
Otros factores de riesgo desencadenantes de la osteoporosis masculina son la enfermedad hepática, la cual crea una alteración de la vitamina D y obstaculiza la hidroxilación de la 25 hidroxivitamina D; la gastrectomía que genera cambios en el metabolismo de la vitamina D y su mala absorción, generando a la vez hiperparatiroidismo secundario; la orquidectomía por cáncer de próstata, la cual produce una disminución de los niveles de testosterona, lo cual conlleva a que se produzca un aumento de la pérdida ósea y, finalmente, el transplante cardíaco el cual origina una elevación de la PTH y la excreción urinaria de calcio y fósforo, lo cual a su vez favorece el proceso de osteoporosis.
Ante esta expectativa y con el fin de cumplir con el segundo objetivo de este documento, intentaremos establecer cuál es la respuesta de la estructura ósea ante las fuerzas deformantes que en ella se generan por intermedio del ejercicio físico.
Biomecánica ósea
Los huesos se deforman por acción de las fuerzas derivadas de la carga del cuerpo o de la actividad muscular. En general, los huesos sobrellevan formas combinadas de deformación, cuyos tipos “puros” son la tracción (alargamiento), la compresión (acortamiento), la flexión (arqueado), la torsión (enroscado), y el cizallamiento (desplazamiento paralelo de secciones). Todas ellas, se reducen a una sola condición, porque su resultado es siempre la producción de una compresión o de una tracción (acortamiento o alargamiento de distancias en el seno del tejido óseo), con base a lo cual se interpretan sus efectos24-25.
Cuando un hueso es colocado en riesgo de fracturarse debido a una carga o traumatismo, entran en juego tres factores diferentes: la carga o el traumatismo cuyas características comprenden la participación eventual de amortiguadores anatómicos (tejidos blandos) y fisiológicos (reflejos, coordinación neuromuscular); laactuación del hueso como palanca “columna” o “viga” en función de la fuerza que lo va a deformar y la biomecánica ósea “dinámica” que analiza la cantidad de deformación que se va a producir conforme a la manera de actuar de la fuerza sobre el cuerpo, en función de la misma y de los brazos de palanca y momentos dinámicos a que su acción diere lugar. La función de la biomecánica ósea estática, es determinar la cantidad de sufrimiento o “estrés” que se genera en la estructura ósea según el grado de la deformación que se le imponga, en proporción a la cual llegaría o no a fracturarse por el traumatismo24-25.
El estrés, derivado de la historia de mini-deformaciones cotidianas, determina ocasionalmente microfracturas, a cuya producción el tejido óseo opone su capacidad de reparación. Cuando una tasa de producción supera a la de reparación, las microfracturas tienden a acumularse. Una acumulación suficiente de microfracturas, así como una producción rápida a causa de un traumatismo, puede ocasionar la fractura del hueso24-25.
Si la fuerza deformante no es muy intensa como para provocar microfracturas, el hueso deformado mantiene la capacidad de retornar a sus dimensiones y forma inicial al cesar su acción (deformación “elástica”, reversible). Durante el comportamiento elástico, el hueso es también capaz de devolver la energía empleada en deformarlo, como lo haría un arco tensionado para disparar una flecha. Más allá de cierto límite (punto de “cesión”), la fuerza puede provocar microfracturas las cuales ocasionan la pérdida de elasticidad (deformación “plástica” irreversible) o, en caso extremo, la fractura24-25.
En consecuencia, las propiedades mecánicas elementales del hueso como órgano son: la resistencia a la deformación (rigidez, opuesto a la deformabilidad o flexibilidad), la capacidad de absorber energía en forma reversible (elasticidad, opuesto a plasticidad) y la resistencia a la fractura (tenacidad, opuesto a fragilidad)24-25.
Los huesos controlan su rigidez por medio de un servomecanismo (feedback) conocido como “mecanostato”. El estímulo para el funcionamiento del sistema es la deformación del tejido. Los receptores de esta “señal de error” se encuentran en los osteocitos, que responden a la misma, liberando factores químicos al medio circundante. Según su naturaleza molecular, estos factores determinan la producción o la reabsorción del tejido en las regiones correspondientes, porque pueden resultar activadores o inhibidores de procesos modelatorios (de ganancia ósea con mejora arquitectónica de la estructura) o remodelatorios (de pérdida ósea, con deterioro de la calidad mecánica del tejido por aumento de la porosidad)24-25.
Una vez se ha determinado cómo el hueso responde normalmente ante los diferentes tipos de fuerzas deformantes que actúan sobre él y cómo estas se modifican con el proceso de osteoporosis, se establece a continuación la forma de respuesta ósea ante el ejercicio físico en aras de favorecer un mejor remodelado, y el mantenimiento de la masa ósea con el paso de la edad.
Influencia del ejercicio físico en el tratamiento de la OM
Tradicionalmente el manejo de la osteoporosis ha incluido medidas de tipo medicamentoso, nutricional y recientemente de ejercicio físico (EF). Este último, descrito bajo parámetros adecuados, ofrece grandes ventajas por ser un medio económico y de fácil acceso; además su realización es agradable y proporciona un bienestar general a quien lo practica, ya que contempla dentro de sus beneficios el favorecer la función cardiovascular y respiratoria, el incrementar la fuerza muscular y la resistencia ósea ofreciendo además, mayor flexibilidad y mejor balance y coordinación motora, lo que a su vez previene contra el riesgo de caídas.
Varios autores han confirmado estos hallazgos: Huddleston26 en 1980, concluyó luego de un estudio realizado en tenistas, que este deporte incrementaba el CMO del eje medio radial del brazo con el que juegan los tenistas, mientras que el CMO del brazo con el que no jugaban, correspondía al brazo no dominante de un grupo de no atletas.
En 1989 Cummings y Nevitt27 sugieren que quienes son más activos se inclinan a caer hacia atrás, evitando así impactos directos sobre la cadera, pues personas que tienen dificultades con el balance y equilibrio, al igual que aquellas con poca fuerza y muy bajas reacciones protectivas, podrían tener más caídas en posiciones que resultarían en impacto sobre la cadera. Otras posibles explicaciones sobre el efecto protector del EF y el uso de los miembros inferiores durante la caída, son su asociación con el CMO y con la fuerza muscular.
Orwol28 en 1989, concluyó que no se debe desconocer el efecto tan importante que tiene la gravedad en la remodelación ósea, siendo los ejercicios de soporte de peso los que muestran mejores resultados en el aumento del CMO. Sin embargo, y ante esta evidencia pudo demostrar, que ejercicios como la natación, en los cuales no hay una influencia tan marcada de la gravedad, pueden generar incrementos en el CMO, respecto de los valores iniciales, especialmente en los hombres. Encontró en su estudio, que la densidad ósea radial fue significativamente mayor en los sujetos nadadores, cuando se les comparó con el grupo control; a nivel vertebral, esta diferencia fue también significativa.
Warhafting23 en 1995, encontró una mayor fuerza muscular del cuádriceps asociada con un mayor CMO de cadera, lo cual sugiere que la fuerza muscular pueda incrementar el CMO de un sitio específico y ello permitiría establecer una relación entre fuerza muscular (hipertrofia) y CMO.
Enjalber29 estableció que en toda persona de edad, es conveniente indicar ejercicios de soporte de peso, tales como la marcha, los deportes de recorrido, la práctica cotidiana de la gimnasia y educación postural y el mantenimiento de la flexibilidad como una medida de prevención de la osteoporosis, ya que los efectos generados por el EF, principalmente por las contracciones musculares, permiten y ayudan al desarrollo del tejido óseo.
Vaillant30 en 1996, quiso establecer una relación directa entre tres grupos musculares y la densidad ósea de los cuerpos vertebrales a nivel lumbar, como una medida de acción local o general de las contracciones musculares sobre el hueso trabecular. Establecio una correlación significativa entre la superficie del psoas (el cual se inserta en los cuerpos vertebrales) y el CMO de los cuerpos vertebrales y no entre los extensores espinales (los cuales se insertan sobre el arco neural de las vértebras lumbares) y el CMO de los cuerpos vertebrales. No encontró ninguna correlación entre la superficie del trícep braquial y el CMO de los cuerpos vertebrales. todo ello permitió al autor confimar la hipótesis de que las contracciones musculares ejercen una acción puramente local sobre la densidad ósea del hueso trabecular; y que es el EF practicando con cierta regularidad, el que realmente modifica el CMO.
Bajo estas perspectivas, el EF contemplado como medida terapéutica, sólo puede influir de forma directa sobre aquellos factores de riesgo relacionados con inmovilización, desuos o ingravidez. Sobre los demás factores de riesgo que producen osteoporosis en hombres, es necesario el concurso de otras disciplinas de salud, de forma tal que puedan implementarse programas de tratamiento inter y multidisciplinario.
De otro lado y reconociendo al hueso como un órgano, deberá entenderse que no podría responder favorablemente ante el EF, si no fuera por las características químicas de su matriz orgánica y mineral que le confieren la resistencia a la tracción y a la compresión; gracias a estas propiedades físicas, el hueso puede gozar de elasticidad, dado que es el colágeno el que proporciona al hueso la capacidad para resistir la tensión31. Tal tensión es prescrita en términos del tipo de EF que se realice, de la frecuencia y duración del mismo y de la intensidad del esfuerzo físico, componentes importantes para determinar el estrés mecánico que se genera en el interior del hueso.
Por tanto, el efecto más importante de las fuerzas mecánicas generadas en la estructura ósea, es la deformación que en él se crea, en donde el hueso actúa a manera de transductor, convirtiendo la energía mecánica en eléctrica y provocando, como consecuencia, un cambio de potencial y la creación de un flujo eléctrico cuyo signo depende de la dirección de la fuerza mecánica aplicada.
La pérdida de hueso cortical también puede acelerarse en las personas mayores de 70 años de edad (tanto hombres como mujeres), quizás porque la resorción endocortical y el aumento de la porosidad cortical incrementan la efectiva disposición de la superficie para la resorción en el hueso cortical19.
Por otro lado, existen diferencias entre ambos sexos con relación a la pérdida ósea a nivel de la columna: ésta es de 14% en los hombres y de 47% en las mujeres20. Dicha discrepancia difiere sustancialmente dependiendo del lugar de la vértebra. Por ejemplo, la disminución en el centro de la vértebra (formada por hueso trabecular), es similar entre hombres y mujeres. Partiendo desde el PDO alcanzado en la columna, la disminución es de 175 a 110 mg/ml en hombres y de 175 a 90 mg/ml en las mujeres11. Otros estudios han confirmado que la pérdida de densidad ósea trabecular a nivel del cuerpo vertebral es similar entre hombres y mujeres, siendo ésta de 50 a 60% del PDO alcanzado21.
Si se habla en términos de la cantidad de pérdida de hueso cortical a nivel vertebral, se establecen diferencias significativas entre ambos sexos, puesto que dicha disminución es mayor en las mujeres que en los hombres9. En 1989, Kalender21 demostró que la disminución del hueso cortical a nivel del cuerpo vertebral es de 0.73% por año en las mujeres y de 0.17% en los hombres, lo que está dado fundamentalmente por un proceso de compensación en los hombres consistente en una mayor formación de hueso cortical a nivel subperiosteal y a una menor resorción endocortical. Dicho proceso es menor en las mujeres13.
En forma similar, se presentan diferencias relacionadas con la disminución de la densidad ósea a nivel femoral, desde la juventud hasta la edad adulta en ambos sexos, siendo ésta de 39% en los hombres y en las mujeres las dos terceras partes de dicha cifra. En las personas mayores, la disminución ósea a este nivel es similar entre hombres y mujeres20.
Hannan22, en 1992, corroboró esta información, cuando encontró porcentajes similares de disminución (porcentaje por año) entre 437 hombres y 698 mujeres con rangos de edad entre los 68 y 98 años: de -0.69 ± 0.15 vs -0.68 ± 12 a nivel del cuello femoral, de -0.45 ± 0.17 vs – 0.53 ± 0.15 a nivel del trocánter, y de -0.88 ±0.23 vs -0.94 ± 0.12 en el triángulo de Wards. Así mismo, Warhaftig23 en 1995, reportó una disminución en el CMO de 13.5% a nivel del cuello femoral en los hombres mayores de 75 años, mientras que para hom bres entre los 50 y 59 años de edad, encontró una disminución de 8% a nivel de trocánter y de 3% a nivel del triángulo de Wards.
Es por ello que las diferencias entre ambos sexos, con relación a la ganancia y pérdida ósea cuentan en alguna medida para el riesgo diferente de fractura. En hombres, la tasa de incidencia de fractura aumenta sustancialmente después de los 70 años de edad, mientras que en las mujeres se observa un incremento después de los 45 años de edad. En mujeres, las fracturas son frecuentes a nivel del tercio distal del radio hasta más o menos la edad de 65 años; después de esta edad, las fracturas de cadera asumen una importancia mayor, no sólo en la población femenina sino también en la masculina, siendo después de los 85 años de edad, el sitio predilecto para fractura en ambos sexos6.
Pero éstas no son las únicas diferencias que se establecen entre hombres y mujeres. Existen otras diferencias sustanciales entre ambos sexos con relación a los factores de riesgo que favorecen el desarrollo de la osteoporosis. Ellas se explican a continuación.
El colágeno o la interfase colágeno-cristal de apatita, parece ser el responsable de esas cualidades piezoeléctricas y el efecto de cambio de potencial, es una despolarización de las membranas de las células, la cual modifica la actividad metabólica celular, lo que favorece el proceso de remodelado óseo como se observa en la tabla 432.
Tabla 4. Actividad física y remodelado óseo
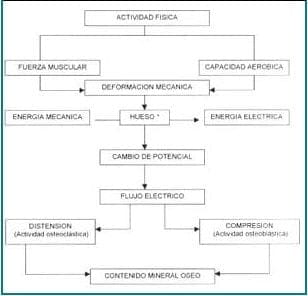
* Interfase colágeno – cristal de apatita
Fuente. CORTÉS, E: Actividad Física, en: “Osteoporosis en Iberoamérica”. Vesalius, 2000.
Así mismo, las fuerzas mecánicas generadas por el EF, crean una respuesta osteogénica en el hueso, dada principalmente cuando el estrés generado en él excede la carga a la cual está habituado. Estas cargas pueden ser diseñadas para sitios esqueléticos específicos de estrés y resistencia, que pueden ser lentas pero consistentemente incrementadas según las necesidades y lo que se busque en cada individuo.
Entre las tensiones mecánicas a las cuales está sujeto el hueso, se encuentran aquellas que resultan de la tracción de los músculos esqueléticos sobre los huesos y el soporte de peso del cuerpo contra la fuerza de gravedad. Es por ello, que algunos de los efectos del EF regular en el cual los huesos están bajo tensión continua (como caminar o correr) son el estimular el crecimiento óseo e incrementar la producción de calcitonina en la glándula tiroides, la cual a su vez detiene la actividad destructora del hueso por parte de los osteoclastos, entre otros. Ello, en conjunto, inhibe la resorción ósea2.
El EF nunca modifica intrínsecamente los elementos genéticos del individuo, que son los que determinan sus posibilidades, pero sí produce una mejora a través de dos parámetros: el evolutivo y el de adaptación, actuando el primero sobre el aspecto morfofisiológico y el segundo sobre la capacidad funcional. El ejercicio favorece así la contracción muscular, la cual, en forma indirecta, genera efectos mecánicos sobre el hueso, que favorecerán su respuesta metabólica
De esta manera y para que el EF pueda constituirse como una opción terapéutica ante la OM, se deben tener en cuenta los siguientes principios:
Principio de especificidad: el EF realizado, debe ser principalmente de soporte de peso, por ser el tipo de ejercicio físico que genera aumento del estrés mecánico, al crear las fuerzas deformantes necesarias ante las cuales los osteocitos responden en términos de una mayor formación o una menor resorción ósea, en aras de mantener un equilibrio en el remodelado óseo que asegure la calidad y la arquitectura de la estructura ósea. Estos ejercicios deben dirigirse, esencialmente, a los sitios en los cuales se ha evidenciado una mayor pérdida de CMO.
Principio de sobrecarga: para tener efectos en el cambio de masa ósea, el estímulo producido por el EF debe exceder la carga normal. Para que se produzca una mejora de la capacidad física es necesario que el organismo sea estimulado por encima de su nivel de trabajo habitual33.
El ser humano tiene una gran capacidad de adaptación y los diversos esfuerzos realizados provocan una reacción que inicialmente es de fatiga, seguida de una fase de recuperación y de un proceso de adaptación que finalmente se transformará en un nivel superior de capacidad (supercompensación). Este proceso no ocurre de forma inmediata: por el contrario, niveles de carga inferiores no producen ningún incremento de la capacidad, mientras que los esfuerzos excesivamente fuertes provocan una disminución de la capacidad de respuesta sin un aumento posterior del potencial. Por lo tanto, se debe producir una sobrecarga que pueda ser asimilada por el organismo, cuya repetición periódica irá aumentando la capacidad de respuesta, elevando el nivel de esfuerzo cada vez más, con la consiguiente mejora paulatina del rendimiento34.
Para que las cargas puedan crecer cada vez más y aumentar así la capacidad del individuo, se juega con los distintos elementos de trabajo aplicables, combinándolos entre sí y aumentando el volumen global o el número de repeticiones o bien intensificando las acciones o reduciendo las pausas o los períodos de recuperación. La utilización de una misma carga a lo largo de un período, lleva a una estabilización de los resultados y posteriormente, incluso, a una disminución34.
Por tanto, la adaptación al esfuerzo requiere un incremento paulatino de las cargas de trabajo, que podrán regularse en su calidad y variabilidad, pero que normalmente crecen cuantitativamente con el paso de los años, hasta alcanzar los niveles óptimos en cada caso, momento en el cual la intensidad de los estímulos se convertirá en un factor determinante del EF.
Principio de reversibilidad: los efectos positivos del EF sobre el hueso pueden perderse cuando éste es descontinuado o cuando no se realiza en forma regular; así mismo, se tiende a recuperar los valores iniciales cuando se producen períodos de inactividad demasiado largos33.
Principio de los valores iniciales: las personas que realizan EF en forma regular, desde la niñez hasta los 30 a 35 años, alcanzan niveles más altos de CMO cuando llegan a la edad adulta. La declinación propia del envejecimiento, se produce en forma menos acelerada, sin que se llegue a los niveles de fractura33.
Principio de regreso disminuido: cada persona tiene un tope biológico individual que determina la extensión de los efectos del EF; tanto cuanto más sea aprovechado ese tope, mayor será la ganancia de la masa ósea33.
Principio de individualización: el nivel de respuesta de cada individuo es diferente para cada tipo de estímulo o carga. Por este motivo, uno de los factores más importantes es la individualización del EF: esto exige un continuo feed-back, de forma que para que sus resultados sean eficaces, éste debe ser continuamente modificado en función de las respuestas del sujeto33.
Además de lo señalado anteriormente, es importante conocer los factores que condicionan los efectos del EF, dentro de los cuales se incluyen:
Intensidad: según va aumentando la intensidad del EF, aumenta más el consumo máximo de oxígeno (VO2 máx.) Aparte del VO2 máx., hay otras modificaciones fisiológicas también en relación con la intensidad, los cambios bioquímicos y óseos. Existe una intensidad umbral por encima de la cual los efectos del EF son más acentuados; este umbral varía entre los sujetos y está relacionado con el VO2 máx. inicial de cada individuo34.
Frecuencia y duración: tanto la frecuencia como la duración tienen efectos comparables; además pueden compensarse en muchos aspectos entre sí. Sin embargo, esta afirmación, que puede considerarse cierta para el EF continuo (trote, caminata y ciclismo), durante el cual la intensidad del esfuerzo es mantenida fácilmente con discretas variaciones de la respuesta de frecuencia cardíaca, no es igual para el tipo de trabajo fraccionado (danza artística y la mayoría de juegos y deportes), en los cuales la ganancia en el VO2 máx. está más en función de la intensidad que de la frecuencia o la duración34.
Especificidad: tiene importancia a la hora de evaluar parámetros fisiológicos. La especificidad del EF tiene dos bases fisiológicas: la base metabólica, la cual tiene dos componentes principales, los sistemas de energía y el sistema cardiorrespiratorio. El EF de baja intensidad y larga duración, involucra principalmente al sistema aeróbico, y el de alta intensidad y poca duración a las rutas metabólicas anaeróbicas. El sistema cardiorrespiratorio, está íntimamente relacionado con los cambios ocurridos en el sistema aeróbico34. La otra base es la neuromuscular, que tiene que ver con el tipo de fibra muscular involucrada en cada EF.
A partir de lo anterior, se puede concluir que la acción que ejerce el músculo sobre el hueso, como palanca mecánica, es útil en constituirse como una medida terapéutica de importancia en el manejo de la OM, pues el EF podría modificar la estructura ósea. El fortalecimiento muscular específico y los ejercicios de soporte de peso son así, los ideales para ser utilizados con este objetivo.
Conclusiones y recomendaciones
• La osteoporosis es una enfermedad caracterizada por disminución de la masa ósea que afecta la microarquitectura del hueso. Es reconocida particularmente en las mujeres pero poco o nada considerada en los hombres. Independientemente de ello, las fracturas de cadera y los cuerpos vertebrales son su expresión más evidente. Ello implica un alto costo social de la atención postfractura en la población mayor de 65 años de edad, lo cual es reconocido mundialmente.
• Factores de riesgo relacionados con la disminución de los niveles de estrógenos explican la osteoporosis en las mujeres, en tanto que los factores de tipo metabólico como la mala absorción de calcio, la deficiencia de vitamina D y el alto consumo de sodio, parecen explicar la aparición de osteoporosis en un buen número de hombres. Los factores hormonales más frecuentemente relacionados con la OM son el hiperparatiroidismo y el hipogonadismo.
• Los principales factores exógenos que pueden llevar al desarrollo de la OM son el tabaquismo, el alcoholismo (de mayor frecuencia en la población masculina) y el consumo de glucocorticoides, bien sea por enfermedad o secundario a gastrectomía o cirugía cardíaca.
• El EF unido al manejo medicamentoso y nutricional es parte vital no sólo en el tratamiento sino también en la prevención de la OM. Muchas investigaciones realizadas hasta la fecha en todo el mundo, reportan efectos positivos interesantes sobre el CMO de los sujetos que realizan ejercicio físico, particularmente entre mujeres peri y postmenopáusicas; poco o nada existe a este respecto frente a la población masculina en riesgo.
• El uso del EF en el manejo de la OM incluye actividades de fortalecimiento y soporte de peso, pues son ellas las que producen un efecto de piezoelectricidad en el hueso, al crear las fuerzas deformantes necesarias para favorecer un mejor remodelado óseo. Ello convierte al EF regular en pilar importante para el manejo y prevención de la OM, al constituirse así en el elemento de acción a través del cual la terapia física pueda contribuir como disciplina en el tratamiento de esta entidad.
• Ante el aumento de la morbilidad masculina en osteoporosis, es un reto para el personal de salud el concientizarse acerca de esta problemática, por lo cual deben plantearse grupos interdisciplinarios de trabajo que se interesen en su estudio y propongan acciones de tipo preventivo que mitiguen esta tendencia reconocida mundialmente.
Bibliografía
1. Rigs, BL. Osteoporosis. En: Endocrinology: DeGroot LJ et al, 2nd ED,WB Saunders Co: Philadelphia, 1989; 3: 1188.
2. Tortora G., Anagnostakos N. Principios de anatomía y fisiología., Editorial Harta, Sexta Edición, 1993; 174-175.
3. Kanis J. Osteoporosis, Editorial Blackwell Sciencie Ltda., 1996; 1-25.
4. Odell WD, HEATH H III. Osteoporosis: pathophysiology, prevention, diagnosis, and management, DM, 1993; 39: 789-868.
5. Ott SM. Attainement of peak bone mass (Editorial), J Clin Endocrinol Metab 1990; 71: 1082A-1082C.
6. Finkelstein JS, Neer RM, Biller BM. Osteopenia in men with a history of delayed puberty, N Engl J Med 1992; 326: 600-604.
7. Gilsanz V., Roe TF, Mora S. Changes in vertebral bone density in black girls and white girls during childhood and puberty. N Engl J Med 1991; 325: 1597-1600.
8. Nelson DA, Jacobsen G., Barondess DA. Ethnic differences in regional bone density, hip axis length and lifestyle variables among healthy black and white men. Journal of Bone and Mineral Research., 1995; 10(5): 782-787.
9. Seeman E. Osteoporosis in men: epidemiology, pathophysiology, and treatment possibilities, Am J Med, 1993; 95 (suplemento 5A); 225-28S.
10. Preece MA, Pan H., Ratcliffe SG. Auxological aspects of male and female puberty Acta Pediatric. 1992; (Suplemento 383): 11-13.
11. Genan HK, Ettinger B., Harris St, Block JE. Quantitative computed tomography in assessment of osteoporosis. In: Riggs BL, Melton LJ III, eds. Osteoporosis: Aetiology, Diagnosis and Management New York Raves Press, 1988; 221-250.
12. Theintz G., Buchs B., Rizzoli R., Slosman D. Longitudinal monitoring of bone mass accumulation in healthy adolescents: evidence for a marked reduction after 16 years of age at the levels of lumbar spine and femoral neck in female subjects., J Clin Endocrinol Metab 1992; 75: 1060-1065.
13. Mosekilde L. Sex differences in age-related changes in vertebral body size, density and biochemical competence in normal individuals., Bone, 1990; 11: 67-73.
14. Parfitt AM, Mathews CH, Villanueva AR. Relationships between surface, volumen, and thickness of iliac trabecular bone in aging and in osteoporosis., Journal of Clinical lnvestigations, 1983; 72: 1396 – 1409.
15. Aaron JE, Makins NB, Sagreiy K. The microanatomy of trabecular bone loss in normal aging men and women, Clinical Orthopaedic, 1987; 215: 260-271.
16. Biggerman M., Hilweg O., Brinckmann P. Prediction of the compressive strength of vertebral bodies of the lumbar spine by quantitative computed tomography. Skeletal Radiology, 1988; 7: 264-269.
17. Seeman Ego. The dilemma of osteoporosis in men, Am J Med 98 (Suplemento 2A), 1995; 76S-88S.
18. Ruff CB, Hayes WC. Sex differences in age-realed remodeling of the femur and tibia, Journal of Orthopaedics and Research, 1998; 6: 886-896.
19. Ringe JD. Hip fracture in men, Osteoporosis International, 1996; (Suplemento 3): S48-S51.
20. Riggs BL, Wahner HW, Dunn WL. Differential changes in bone mineral density of the appendicular and axial skeleton with aging., Journal of Clinical Investigations, 1981; 67: 328-335.
21. Kalenoer WA, Felsenberg O, Louis O. Reference values for trabecular and cortical vertebral bone density in single and dual-energy quantitative computed tomography, Eur J Radiology, 1989; 9: 75-80.
22. Hannan MT, Felson DT, Anderson JL. Bone mineral density in elderly men and women: results from the Framingham Osteoporosis Study, Journal of Bone and Mineral Research, 1992; 7: 547-552.
23. Warhaftig N, Mellahn E, Charron M. Determinants of bone mineral density in older men, Journal of Bone and Mineral Research, 1995; 10(11): 1769-1777.
24. Ferretti JL, Capozza RF. Interrelations between densitometric, geometric and mechanical properties of rat femurs. Inferences concerning mechanical regulation of bone modeling, Journal of Bone Mineral and Research, 1993; 8: 1389.
25. Ferretti JL. Properties of p QCT technology associated to biomechanical studies in skeletal research employing rat models, Bone, 1995; 17(Suplemento N4): 353S.
26. Huooleston A, Rockwell D, Kulund D. Bone mass in lifetime tennis athletes, JAMA, 1980; 244(10): 1107 -1109.
27. Cummings SR, Nevitt MC. A hiphothesis: the causes of hip fractures, Journal of Gerontology and Medicine Scientifique, 1989; 44: M107-111.
28. Orwoll E, Ferar J, Oviatt S. The relationship of swimming exercise to bone mass in men and women., Arch. Intern. Med, 198; 149(10): 2197-2200.
29. Enjalbert M., Garros JC, Marcelli C. Prevention de l’osteoporose et restauration de la fonction musculaire de la personne agee., Kinesitherapie Scientifique, 1995; 342.
30. Vaillant J., Nguyen F., Fougeray M. Osteopose: vers une prise en charge educative?, Kinesitherapie Scientifique, 1996; 355.
31. Cortés E. El ejercicio físico en la postmenopausia, Rev Col Obstet Ginecol 1994; 45(4): 5.
32. Cortés E. En Osteoporosis en Iberoamérica. Ed. Vesalius Edición de prueba, 2000; 209-218.
33. Official Journal of the American College of Sports Medicine. ACSM Position Stand on Osteoporosis and Exercise, Medicine and Science in Sports and Exercise, 1995; 27(4): i- vii.
34. López CH J. Fisiología del ejercicio. Editorial Médica Panamericana 1995; 103-104, 241-255.