Terapias Alternativas
*Miguel Bueno M.; * MD. Ginecólogo. Centro Médico Imbanaco, Cali.
Resumen
Los efectos adversos de la THS han estimulado la búsqueda de nuevos compuestos para la prevención y tratamiento de los síntomas postmenopáusicos. Entre otros varios compuestos, los serm representan un grupo nuevo de drogas para el manejo de aspectos específicos de la menopausia. Hasta ahora, raloxifeno es el serm más ampliamene conocido y usado para la prevención y tratamiento de la osteoporosis postmenopáusica. Sus efectos benéficos sobre el sistema cardiovascular y sobre la función cerebral, aún se investigan. Los mecanismos íntimos de acción de los serm, aún se desconocen. Se cree que pueden actuar por diferentes vías, a nivel de la unión ligando-receptor o por activación de las secuencias promotoras de genes, diferente del elemento de respuesta estrogénica (ere). En todos los casos, para lograr los mayores beneficios del empleo de un medicamento, su uso debe hacerse acorde con su propio perfil farmacológico y con el perfil de riesgos de cada paciente. Con este propósito, los serm representan un elemento valioso para el manejo de la osteporosis posmenopáusica y de otras patologías asociadas con la menopausia.
Palabras clave: climaterio, menopausia, terapia hormonal de reemplazo (THS), modulador selectivo de receptores estrogénicos (SERM), receptor estrogénico beta, (b) fitoestrógenos.
Summary
Adverse reactions from HRT have stimulated the search for new compounds for prevention and treatment of menopausal symptoms. Among several other compounds, SERM´s represent a new group of drugs for the management of specific aspects of menopause. So far, raloxifen is the most widely investigated and used SERM for the prevention and treatment of postmenopausal osteoporosis. Its beneficial effects on cardiovascular disease and brain function are still under investigation. The intimate action mechanisms of SERM´s are unknown. They may act through different pathways at the estrogen-receptor union or by activation of gene promoting sequences, different from the classic Estrogen Response Element (ERE). For a major beneficial effect, the selection of a drug must be in accordance with its own pharmacological profile and the clinical risks profile of each patient. On that respect, SERM´s represent a very important element for the prevention and treatment of menopausal osteoporosis and some other clinical pathologies associated with menopause.
Key words: climateric, menopause, Hormonal Replacement Therapy (HRT) Selective Estrogen Receptor Modulators (SERM´s), estrogen – receptor beta (b) and fitoestrogens.
Introducción
El protocolo de manejo que propone que una vez establecida la menopausia, ya sea natural, quirúrgica o química, necesita alguna forma de reemplazo hormonal, tiene cada vez mayor aceptación.
El propósito es el de recuperar el estado estrogénico normal, para controlar los efectos clínicos del hipoestrogenismo expresados como oleadas de calor, cambios en la piel, vaginitis, síndrome uretral y disminución de la función cognoscitiva, entre otros. También se trata de prevenir sus mayores complicaciones a largo plazo como son la pérdida de masa ósea y las alteraciones de los lípidos séricos, que por su evolución subclínica, producen gran morbimortalidad, debida a fracturas y a enfermedades cardiovasculares.
La terapia hormonal de reemplazo (THS), realizada hasta hoy con valerato de estradiol (E2) o con estrógenos conjugados equinos (ECE), ha alcanzado, a pesar de sus evidentes y conocidos efectos benéficos, una muy limitada aceptación (20-30%)1. Las causas que explican esta baja aceptación se deben, principalmente, a que los estrógenos, en general, actúan como agonistas en todos los tejidos blancos, incluyendo la mama y el endometrio, lo cual produce un incremento en la incidencia de cáncer en todos los órganos y en el sangrado vaginal.
El concepto SERM Modulador Selectivo del receptor de estrógeno (a y b)
Todo comenzó con aquello que en ese entonces se denominó “La paradoja del tamoxifeno”. En 1992, Love2-3, encontró que el tamoxifeno, sustancia diseñada en principio como un antagonista estrogénico sobre la mama, tenia efecto agonista o antagonista, dependiendo del tejido blanco. Por ello, las mujeres posmenopáusicas que tomaban tamoxifeno como tratamiento para el cáncer metastásico de mama, tenían colesterol sérico más bajo y una menor pérdida de la masa ósea durante el tratamiento, comparadas con pacientes control, no tratadas. Es decir, que el tamoxifeno actúa y modula selectivamente, como agonista estrogénico sobre el hueso y el hígado y como antagonista estrogénico sobre la mama. Por ello, el tamoxifeno es considerado el primer SERM.
Como SERM de segunda generación se consideran el raloxifeno y sus derivados. Actualmente se adelantan estudios sobre una tercera generación de SERM. También se investiga el efecto SERM de los estrógenos obtenidos de plantas (fitoestrógenos).
El receptor estrogénico (a y b)
Algunas investigaciones recientes han convertido el receptor estrogénico (RE) en el centro del proceso plurifuncional de la actividad de esta hormona.
En efecto, hasta hace poco se creía que los estrógenos ejercían su actividad biológica a través de un solo tipo de receptor, el receptor estrogénico a (REa), ubicado dentro del núcleo de las células blanco. Según este modelo, su acción sería, simplemente, la de activar los receptores inactivos. A su vez, los antiestrógenos (por ej. el clomifeno), actuarían mediante su unión a tales receptores, bloqueando el acceso agonista a ellos. Se creyó consecuentemente, que todos los estrógenos, así como también los antiestrógenos, eran cualitativa y cuantitativamente iguales.
El interés por modificar y mejorar el perfil clínico de la THS se ha canalizado hacia diversas líneas de investigación. Una de ellas, ha sido la búsqueda de receptores estrogénicos específicos para cada tejido blanco. Estos RE serían expresados, selectivamente, en aquellos tejidos en los cuales se desee la estimulación del RE (por ejemplo, el hueso) y no expresado (o expresado a bajos niveles), en otros (por ejemplo, el endometrio). Se hacía necesario encontrar, entonces un activador específico de tales receptores.
Tras varios años infructuosos, tratando de identificar un RE variante, en 1996 Kuiper y col.4 y Mosselman y col5 identificaron y clonaron un nuevo receptor, el receptor estrogénico b (REb), tejido específico, el cual hallaron en el brazo, el timo, el ovario y el testículo, tanto en ratas como en humanos. Se tuvo así, la primera evidencia de que existen formas variantes, no mutadas, de RE, las cuales son capaces de activarse con el estradiol (Fig. 1)

Figura 1.
El hallazgo del REb ha permitido definir, al menos por ahora, varios criterios importantes respecto a los estrógenos:
1. Los estrógenos manifiestan su actividad biológica, cuando menos, a través de dos receptores estrogénicos. (a y b).
2. La afinidad de unión del RE, no predice su comportamiento biológico.
3. Diferentes estrógenos, que actúan a través de un mismo receptor, se comportan, biológicamente, en forma diferente, en células diferentes.
4. Los dominios de unión de ligado de esos RE, tienen tan sólo un 60% de similaridad. Por lo tanto, diferentes estrógenos tienen el potencial para interactuar con esos receptores, en forma diferente. Algunos tienen REa, otros tienen REb y otros tienen REa y b.
5. Estrógenos diferentes llevan al receptor a adoptar formas diferentes.
6. Los SERM, por su parte, lo llevan a conformaciones que no son totalmente activas ni totalmente inactivas.
Mecanismo de acción del receptor estrogénico (a y b)
Existen varios posibles mecanismos de acción de los receptores estrogénicos, uno de los cuales se describe en la figura 2.
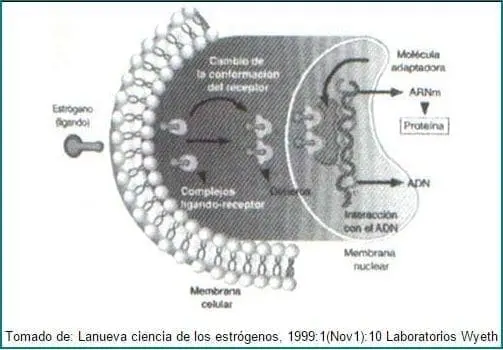
Figura 2. Mecanismo de acción del Receptor Estrogénico.
El ligando atraviesa la membrana celular y se une a un receptor. El complejo ligando-receptor experimenta una serie de cambios en su estructura tridimensional, se dimeriza y termina uniéndose a unas secuencias específicas del ADN, situadas en el promotor de diferentes genes (en el caso de los estrógenos, el denominado ERE o Estrogen Response Element), dando lugar a la transcripción de los mismos.
Además del descubrimiento del REb en 1996, en 1995 se había descubierto ya el Mecanismo Adaptador5, según el cual, diferentes estados conformacionales de los receptores, son reconocidos por células diferentes. En la actualidad se conocen cuando menos 30 proteínas adaptadoras, cuyos niveles de expresión varían de célula a célula. Estrógenos diferentes entran en las células y modulan el receptor de diferentes formas, dos de las cuales se unen para formar un regulador (Dímero). Estos reguladores buscan su adaptador favorito, el cual puede estar latente en el útero, en el cerebro o en el hueso. Si en una célula particular, el regulador del receptor activado encuentra una proteína adaptadora compatible, es capaz de interactuar con la maquinaria de transcripción en forma agonista, lo cual lleva a alteraciones de la expresión de genes blanco. Pero, si ellos no logran encontrar un adaptador, funcionan básicamente como un antagonista.
El conocimiento actual de la farmacología del RE, se resume así:
• El mecanismo por el cual el complejo RE-Ligando regula la transcripción del blanco, difiere de célula a célula.
• Aún no se conoce con exactitud el mecanismo molecular por el cual se explica el efecto SERM sobre el hueso y sobre los tejidos.
En consecuencia, las investigaciones actuales se dirigen hacia el hallazgo de fármacos con el efecto agonista pluritisular deseado en los estrógenos y la acción antagonista limitada a aquellos tejidos con efectos adversos debido a la acción estrogénica. Estos compuestos son los SERM. (Moduladores Selectivos del Receptor estrogénico).
Perfil clínico de los SERM (a y b)
El comportamiento agonista/antagonista del complejo ligando/RE determina, finalmente, el perfil clínico-farmacológico de un medicamento.
En el caso de los SERM, sus dos representantes más estudiados, hasta ahora, son el tamoxifeno y el raloxifeno, cuyo perfil clínico será analizado a continuación. Para efectos del presente trabajo se analizará el efecto SERM de los fitoestrógenos, dada la importancia que tales compuestos han logrado en investigaciones recientes
Efecto serm sobre el sistema cardiovacular (a y b)
El trabajo de Walsh y cols.,6 realizado en ocho centros en los Estados Unidos, es un estudio doble-ciego, aleatorizado, paralelo, sobre el efecto de raloxifeno en 390 mujeres posmenopáusicas saludables, asignadas al azar a uno de cuatro esquemas de tratamiento: raloxifeno 60 mg/día, raloxifeno, 120 mg/día; THS (estrógenos conjugados equinos, 0.625 mg/día y acetato de medroxiprogesterona, 2.5 mg/día) o placebo. El objetivo era medir los cambios, en porcentajes, a partir de la línea media, en los niveles de lípidos y parámetros de coagulación, después de 3 y 6 meses de tratamiento. Al final de los 6 meses de tratamiento, se observó lo siguiente (Figura 3).
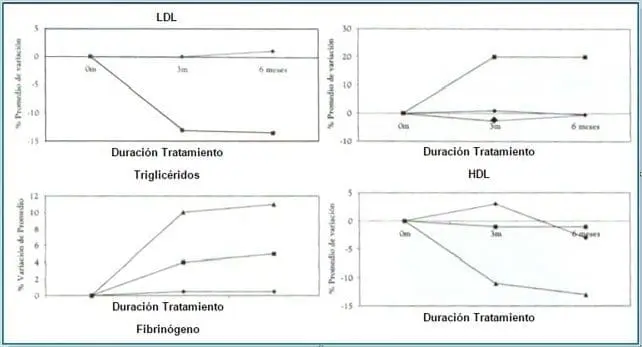 Figura 3. Porcentaje promedio de variación de parámetros del perfil lipídico y fibrinógeno en mujeres postmenopáusicas sanas, bajo tratamiento con raloxifeno, THR o placebo.
Figura 3. Porcentaje promedio de variación de parámetros del perfil lipídico y fibrinógeno en mujeres postmenopáusicas sanas, bajo tratamiento con raloxifeno, THR o placebo.
Tomado de: Walsh BW y col. JAMA, 1998;279:1445-51
Comparadas con placebo, ambas dosis de Raloxifeno bajaron, significativamente, el HDL en 12% (P < .001), similar a la reducción del 14% con THR (P < .001). Raloxifeno no cambió significativamente el HDL, ni los triglicéridos. En cambio, la THR aumentó el HDL en 11% y los triglicéridos en 20% (para ambos, P < .001). Además, Raloxifeno disminuyó significativamente el fibrinógeno en 12-14% (P < .001), diferente de THR, la cual no mostró ningún efecto sobre él.
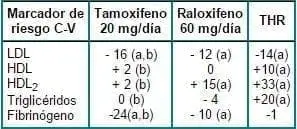
Utilizando datos de este mismo trabajo y de otros de varios autores7-9 Walsh analiza en forma comparativa con tamoxifeno y con THS los efectos de raloxifeno descritos previamente. (Tabla 1)
Tabla 1. Comparación de los efectos del raloxifeno, tamoxifeno y THS sobre marcadores de riesgo cardiovascular en mujeres posmenopáusicas sanas.
a: cambios estadísticos significativos
b: datos del estudio de Grey y col. (post 6 meses de tratamiento)
Se observa un efecto supresor similar de los tres compuestos sobre LDL y un mayor aumento de HDL y HDL2 por THS en comparación con tamoxifeno y raloxifeno. La THS aumentó significativamente los triglicéridos y produjo sobre el fibrinógeno un efecto supresor significativamente inferior al del tamoxifeno y raloxifeno.
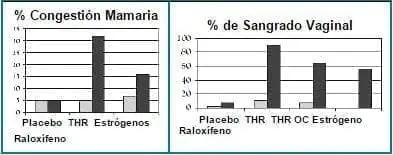
En cuanto a efectos colaterales adversos, los más frecuentes en el estudio de Walsh y col., fueron: sangrado vaginal, congestión mamaria y oleadas de calor (Tabla 2).
Tabla 2. Incidencia de sangrado vaginal, congestión mamaria, oleadas de calor y de interrupciones del tratamiento por estas causas (en porcentaje)

Las oleadas de calor fueron el efecto adverso más frecuente en el grupo con raloxifeno (22% en el grupo con 120 mg/día). La incidencia de sangrado vaginal en el grupo con THS, fue de 45%, significativamente mayor que en el grupo con raloxifeno y que en el grupo con placebo. Las interrupciones del tratamiento por el sangrado vaginal fueron de 9%. El abandono por las oleadas de calor por raloxifeno fue mínimo.
Del estudio de Walsh y col. se concluye que el SERM raloxifeno, modifica favorablemente varios lípidos séricos y factores de coagulación, marcadores de riesgo cardiovascular, en mujeres posmenopáusicas sanas. En su gran mayoría, la respuesta reprodujo la observada con THS, aunque no necesariamente de la misma magnitud. El patrón de respuesta con raloxifeno se asimiló más al del tamoxifeno que al de THR, excepto por el agonismo endometrial de tamoxifeno. Se plantea, también, la posibilidad de que el raloxifeno, a dosis de 60 a 120 mg/día, reduzca sustancialmente el riesgo de enfermedad cardiovascular en mujeres posmenopáusicas. Una respuesta concluyente necesitará, muy seguramente de estudios clínicos con eventos cardiovasculares específicos como objetivo final.
El estudio de Davies y cols.10 analiza, igualmente, diferentes efectos colaterales en pacientes quienes recibían THS, raloxifeno o placebo. Los resultados son similares a los escritos en el trabajo de Walsh y cols., antes mencionado. (Figura 4)
Figura 4. Incidencia de congestión mamaria y sangrado vaginal, en pacientes tratadas con raloxifeno, estrógenos, THR y placebo o con THR cíclica, THR combinada continua, estrógenos, raloxifeno y placebo, respectivamente.
Tomado de: Davies GC. Obstet Gynec. 1999;93:558-65
El estudio RUTH
Con el propósito de evaluar aspectos cardiovasculares específicos del raloxifeno, la compañía Eli Lilly ha lanzado el estudio RUTH (Raloxifene Use for The Heart).
Los objetivos primarios del estudio RUTH, el cual tendrá una Fase 3 larga, son el infarto cardiaco y la muerte por enfermedad coronaria. Entre los objetivos secundarios están: la mortalidad por todas las causas y por causas cardiovasculares, la morbilidad de origen miocárdico y las hospitalizaciones por angina inestable, cáncer mamario y accidentes cerebrovasculares o por fracturas. Los resultados del estudio RUTH tardarán varios años para conocerse.
La controversia continúa: El estudio HERS (Heart and Estrogen/Progestin Replacement Study.)
Los efectos cardiovasculares benéficos de la THS convencional con estrógenos y progestágenos y también con el uso de los SERM, han logrado amplia aceptación11- 13.
No obstante mientras los médicos debaten la THS, persiste una importante inquietud: cuándo y bajo qué circunstancias prescribir la THR en mujeres perimenopáusicas. La controversia ha sido recientemente reactivada de acuerdo con los resultados del estudio HERS, un estudio clínico prospectivo, el cual duró cuatro años y no demostró ningún efecto cardiovascular benéfico en la prevención secundaria por los estrógenos. De hecho, el estudio llamó la atención sobre posibles efectos cardiovasculares negativos tempranos y benéficos tardíos de los estrógenos/progestágenos.
En contra de lo esperado, la combinación estrógenos conjugados equinos y progesterona aumentó la incidencia de enfermedad coronaria durante el primer año, entretanto, en los años 2-5, el grupo placebo aumentó la incidencia de la citada enfermedad, lo cual llevó a los investigadores a suponer la existencia de un efecto
de los estrógenos inmediato protrombótico, pro arrítmico o proisquémico, el cual es superado por los efectos benéficos para la prevención, a más largo plazo, del progreso de la arteriosclerosis subyacente, quizás como resultante del perfil lipídico mejorado.
La terapia estrógenos/progestágenos aumentó la tasa de litiasis biliar y los eventos tromboembólicos y pulmonares ocurrieron tres veces más frecuentemente.
Los resultados contradictorios del estudio HERS plantean la necesidad de la evaluación cautelosa necesaria en los estudios observacionales y la importancia de los ensayos clínicos controlados.