Artículo de Opinión
Acerca de la Comunicación del INVIMA sobre Riesgo de Desarrollar Cáncer de Mama en Mujeres Posmenopáusicas en Manejo con Terapia de Reemplazo Hormonal (TRH)
BERNARDO MORENO ESCALLON,* MD
Muchas gracias por tenerme en cuenta para la elaboración del documento que Uds. como Asociación quieren construir sobre el Informe de Seguridad acerca de la THM.
Me apoyaré sobre los comentarios que una vez escribí en una carta dirigida a la Asociación en septiembre 24 de 2019 (que contienen argumentos que hoy siguen vigentes) a raíz del artículo publicado en The Lancet el 29 de agosto de 2019 (Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. DOI: https://doi.org/10.1016/S0140 6736(19)31709-X.).1
El informe de Seguridad del INVIMA menciona textualmente lo siguiente:
«El Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) comunica la siguiente información de seguridad: Descripción del caso. Antecedentes. Bogotá, 30 noviembre 2020. Asunto: Riesgo de desarrollar cáncer de seno en mujeres postmenopáusicas en manejo con terapia de reemplazo hormonal (TRH) Nro. identificación interna del Informe de Seguridad: MIS2003 – 566.»
Quienes estamos trabajando con mujeres en climaterio, sabemos perfectamente que la información no es diferente de la que ya conocemos.
Cuando se menciona el riesgo de algún agente para provocar una injuria, es muy importante analizar la magnitud de ese riesgo, por una parte, y el beneficio real, por otra, para obtener una fórmula riesgo/beneficio equilibrada. Sabemos que el riesgo de desarrollar cáncer de seno asociado a la TRH es muy bajo y que los beneficios superan con creces a ese riesgo. Por eso es muy importante que tanto los colegas como las pacientes distingan entre los términos «asociación» y «causalidad» que son muy relevantes en la comunicación de estos conceptos.
Quisiera por esta razón refrescar muchos de los argumentos a favor de la TRH así como refutar todas las inquietudes negativas procedentes de nuestras pacientes y de los medios de comunicación, incluido el INVIMA.
- La investigación en cáncer ha establecido que los tumores malignos, incluyendo el de seno, necesitan en promedio de 5 a 10 años para que una célula maligna se convierta en una lesión de 5 a 10 mm. Un periodo de solo 5 años, como el mencionado en los estudios WHI y MWS, podría ser demasiado corto para permitir la detección de tumores primariamente inducidos por TRH.
- Un cálculo sobre el peor escenario podría ser posible si el tumor es agresivo y de crecimiento rápido, sin pérdida celular durante su progresión. Esas características no ocurren en cáncer de seno asociado a terapia hormonal. Por el contrario, en la mayoría de los casos, las lesiones son bien diferenciadas y los tumores son de crecimiento lento.
- Con relación al periodo relativamente corto de observación en los estudios, habría que asumir que los medicamentos incluidos en la TRH (sustancias fisiológicas en dosis fisiológicas) transformarían un epitelio mamario normal en un tumor maligno en una fase temprana del tratamiento. Esta no es una explicación biológicamente plausible para un efecto tan inmediato de las hormonas esteroideas2.
- Tanto el estudio WHI (Women’s Health Initiative)3 como el estudio MWS (Million Women Study)4 informan que el aumento de los casos de cáncer de seno comienza inmediatamente después del inicio de la TRH.
Si la TRH realmente instigara los cánceres de seno de novo, se esperaría que el aumento de la incidencia ocurriera mucho más tarde. Sin embargo, la tasa de crecimiento disminuyó rápidamente después de que se interrumpió la TRH. Esto también es notable porque se esperaría que la curva de normalización disminuya durante un período de tiempo mucho más largo dado el potencial de crecimiento ilimitado de las células malignas. -
El TVDT (Tumor Volumen Doubling Time) es un concepto muy útil para dilucidar la duración de los estadios prediagnósticos de los tumores malignos y así, de este modo, su curso clínico.
Se define como el tiempo requerido para que el volumen de un tumor o un grupo celular se duplique una vez (TDT: Tumor Doubling Time)5. Esto es la función de muchas variables: la tasa de división celular, la proporción de células dividiéndose activamente, la tasa de apoptosis, la potencia angiogénica, el intervalo intermitótico, la carga del tumor y tasas de descamación, entre otras. - En general se acepta que se requieren de 30 a 35 duplicaciones de la población celular tumoral para alcanzar un tamaño tumoral de 5 a 10 mm de diámetro. Esto corresponde 109 células, mientras que una simple célula tumoral tiene un volumen aproximado de 10-6 mm³. Y la lesión más pequeña que se puede diagnosticar en la clínica es más o menos 5 mm 6.
Asumiendo un TDT de solo 100 días, una simple célula tumoral requiere aproximadamente de 1750 a 3500 días de crecimiento para alcanzar el tamaño de una masa que sea detectable clínicamente en una mamografía7. Esto significa que un promedio de 5 a 10 años han pasado desde la iniciación del tumor en una simple célula hasta alcanzar el diagnóstico de cáncer. - A menudo los estudios epidemiológicos no consideran la distinción entre iniciación y promoción, por eso las conclusiones de causalidad y las asociaciones entre los diferentes factores de riesgo para cáncer de seno, incluida la THR, deben ser analizados con mucha precaución.
-
Los mecanismos patogenéticos exactos de la cancerogénesis en general, así como también la iniciación y la promoción del cáncer del seno en particular son aún pobremente comprendidos.8
El término «iniciación » abarca el hecho de un daño primario del DNA en células normales que resulta en una división anormal de las células expuestas de tal manera que su potencial de crecimiento es cambiado irreversiblemente hacia un crecimiento ilimitado.
El término «promoción» o «estimulación » significa que por alguna razón desconocida existe ya una célula tumoral maligna, la cual, en parte, reacciona a un estímulo interno o externo como factores de crecimiento u hormonas, las cuales por sí mismas no son carcinogénicas. - Las hormonas esteroideas sexuales pueden influenciar la promoción de cáncer de seno desde la primera célula tumoral maligna hasta un tumor diagnosticado muchos años después.9 Por eso mujeres que inician una TRH en un momento en el que ya tienen un proceso tumoral maligno indetectable clínicamente, culparán a la terapia hormonal de haberles causado un cáncer de seno cuando es detectado en una mamografía.
- Varios estudios han mostrado que el cáncer de seno asociado a TRH tiene un pronóstico más favorable que aquel que no ha sido precedido de TRH. Esos estudios plantean un interrogante de si es una ventaja o una desventaja tener una detección temprana de un cáncer de seno debido a un foco del mismo de crecimiento acelerado, indetectable en el momento pero presente cuando ha recibido el estímulo hormonal.
-
La supervivencia del cáncer de seno en mujeres que han recibido TRH es mucho más larga que en aquellas que no han recibido terapia hormonal.10 Esto implica una propensión para una detección temprana del cáncer de seno entre usuarias de TRH indicando no solamente un sesgo sino un beneficio de la detección temprana.
Esta observación también soporta la noción de que los resultados de esos estudios (WHI, MWS y el estudio comentado) están más probablemente basados en un hallazgo y no en la iniciación de un cáncer por el tratamiento.
Esta argumentación está muy bien documentada en el artículo del Dr. Manfred Dietel, publicado en la Revista Maturitas en el año 20102. Creo que es de utilidad para los colegas como recordatorio y fortalecimiento sobre los conocimientos de la TRH.
Con relación al artículo de Lancet de los autores ingleses (mencionado al principio de estos comentarios), resolví por curiosidad hacer un análisis crudo y en bruto de las cifras que ellos utilizaron en su estudio sobre un diseño de casos y controles anidado en una cohorte de pacientes con cáncer de seno invasivo, cuya información fue obtenida de 58 estudios que incluían 143.887 mujeres posmenopáusicas (casos) y 424.972 sin cáncer de seno (controles). (Lea También: Mujeres que tienen un Mayor Riesgo de Cáncer de Mama )
Hubo 24 estudios prospectivos con 108.647 casos, de los cuales 55.575 (51%) habían utilizado terapia hormonal. Los estudios restantes (34) eran retrospectivos y contribuyeron con 35.240 casos, de los cuales 15.642 habían utilizado terapiahormonal.
(Lea También: Relación entre la Lactancia Materna y el Riesgo de Menopausia Precoz )
Los resultados de ese análisis crudo (pacientes con cáncer de seno [casos]) de usuarias vs. no usuarias de TRH y los controles sin cáncer de seno (expuestas y no expuestas a TRH) tanto sobre el total de pacientes y luego el mismo ejercicio tanto en las pacientes de los estudios prospectivos como en los retrospectivos sin estratificar en una tabla de 2 x 2, fueron los siguientes:
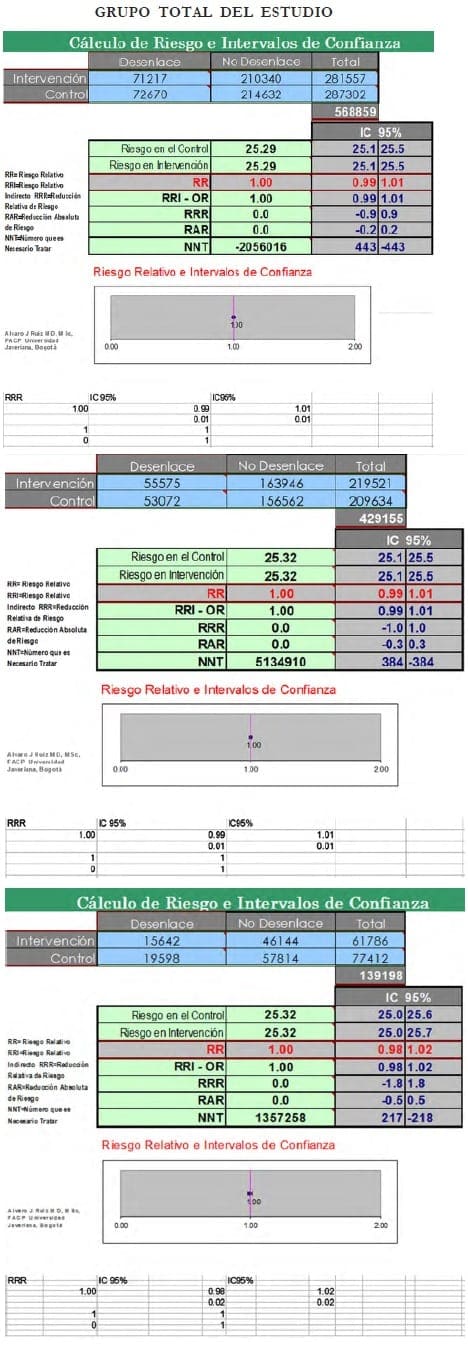
Estos resultados crudos, que muestran un tipo de «adefesio epidemiológico» porque están analizados sin estratificación, indican dos cosas: que la asociación entre cáncer de seno y TRH es débil y baja.
Por otra parte, cuando el análisis se hace estratificado por edad de la paciente, edad de la menopausia, tiempo de terapia, tipo de terapia, uso en el pasado o en el presente de la terapia hormonal, índice de masa corporal, nos indica que las pacientes que son candidatas a TRH hay que individualizarlas, informarlas y educarlas.
Con relación a los resultados encontrados por autores ingleses, se observa que no son consistentes con los resultados de los estudios aleatorizados, controlados, enmascarados y multicéntricos.
Ellos mencionan cifras de RR de 1,60 (IC 95%: 1,52-1,69) entre usuarias y no usuarias de TRH entre 1 y 4 años de terapia combinada y un RR de 1,17 (IC: 1,10-1,26) de terapia solo estrogénica y cifras de RR de 2,08 y 2,30 respectivamente en usuarias con terapia combinada por encima de los 5 años y frecuencia en el uso de progestágenos y RR 1,33 con solo terapia estrogénica.
El estudio de los autores ingleses es un diseño analítico de casos y controles anidado en una cohorte de pacientes con cáncer invasivo de seno, que no está exento de los riesgos de este tipo diseño, como son los sesgos de información, de recuerdo, de medición y de selección de los controles, y por eso son estudio con menor fortaleza epidemiológica que los experimentos clínicos, así se haya presentado como un meta-análisis.
Estos últimos estudios son de tipo secundario porque se nutren de estudios primarios, que cuando están construidos con experimentos clínicos de alta calidad, se constituyen en la mejor evidencia epidemiológica, pero cuando se alimentan con una mezcla de estudios prospectivos y retrospectivos, este tipo de meta-análisis termina reuniendo todos los errores metodológicos de los estudios primarios y, por lo tanto, el producto final no puede ser de alta calidad.
Volviendo nuevamente a los conceptos de causalidad y asociación, este último término es el que debería utilizarse y que la gente del común no tiene por qué saberlo, sin una explicación lógica. Para que un agente químico, físico o biológico se considere que «causa» un desenlace indeseable, debe cumplir con los principios epidemiológicos de Causalidad que son Temporalidad, Fuerza o magnitud del efecto, Efecto Dosis-Respuesta, Reversibilidad, Consistencia, Plausibilidad biológica, Especificidad y Analogía.
En los experimentos clínicos (como el WHI) se encontró un RR de 1,24, que significa un aumento relativo del 24% del riesgo de cáncer mamario en usuarias de TRH con relación a las no usuarias durante 5 años de uso. Si el riesgo de cáncer mamario hacia los 60 años de edad, en todas la mujeres de la población general, es de 2,4/100 mujeres, asumiendo el aumento de un 24% del riesgo en mujeres a los 50 años tomando TRH durante 5 años, significaría un incremento en términos absolutos de 0,57 de mujer al cabo de ese tiempo11.
En otras palabras, vamos a encontrar un total de 2,4 mujeres/100 que van a desarrollar cáncer de seno de la población general sin exposición a la THR y 2,95 mujeres/100 que van a desarrollar cáncer mamario expuestas a TRH, o sea una diferencia de 0,57 de mujer.
El riesgo de desarrollar un cáncer de seno invasivo asociado a TRH es bajo cuando se compara con otros factores como la edad, que es 6,6 veces mayor en mujeres por encima de los 50 años; la historia familiar de cáncer, que puede variar entre 1,4 y 13 veces; las mutaciones en BRCA ½, que son 8 veces mayores-; la alta densidad mamaria, 5,5 veces; el uso de alisadores y tintes para el cabello, 1,6 veces, entre otros12.
Para finalizar, vale la pena mencionar la parte positiva y benéfica de la THM.
Las enfermedades cardiovasculares son las que producen un mayor número de defunciones entre las mujeres y son responsables del 46% de las muertes en mujeres mayores en el mundo entero, mientras que al cáncer (incluido el de pulmón, mama, colon y estómago) se le atribuye el 14% de las muertes.13
Existe plausibilidad biológica suficiente que nos ayuda a comprender la razón por la cual las mujeres que entran a la menopausia fallecen con más frecuencia por enfermedad cardiovascular. Esto está relacionado en parte con el déficit hormonal en esta época de la vida que funciona a manera de protección cardiovascular en la etapa premenopaúsica.
Estudios observacionales y ensayos clínicos utilizando TRH en los primeros 5 a 6 años de la menopausia han mostrado beneficios para el aparato cardiovascular mediante la disminución de la progresión de la arteriosclerosis en las arterias carótidas, que son desenlaces subrogados para la enfermedad coronaria y cerebrovascular14,15.
Cuando vengan más estudios experimentales con TRH que demuestren una disminución significativa de los desenlaces cardiovasculares en términos de morbilidad y mortalidad, la terapia hormonal tendrá una indicación justificable en las Guías de manejo de la Enfermedad cardiovascular.
Sin embargo, el beneficio de la TRH temprana está presente y supera el riesgo del cáncer de seno, sobre todo en la relevancia de la mortalidad en la mujer.
A esto se suma los beneficios de la calidad de vida cuando la sintomatología vasomotora es controlada y deja de perturbar la vida cotidiana de la mujer en términos de las actividades personales, profesionales y familiares; el estado de ánimo, el reposo nocturno reparador, la vida sexual, la protección de las infecciones urinarias a repetición y la pérdida ósea, entre otras.
Desafortunadamente, existen muchas mujeres con oncofobia y detractoras de la TRH, que sufren de la deficiencia hormonal y que piensan que el negarse absolutamente a la terapia hormonal las va a liberar de tener un cáncer de seno.
Referencias
- 1. Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. www.thelancet.com Published on line August 29, 2019 http://dx.doi.org/10.1016/S0140-6736(19)31709-X
- 2. Dietel M. Hormone replacement therapy (HRT), breast cancer and tumor Pathology. Maturitas 2010;65:183-9.
- 3. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. Principal results from the Women’s Health Initiative randomized controlled trial. J Am Med Assoc 2002;288: 321-33.
- 4. Million Women Study Collaborators. Breast cancer and hormone replacement therapy in the Million Women Study. Lancet 2003;362: 419-27.
- 5. Spratt JS, Meyer JS, Spratt JA. Rates of growth of human solid neoplasms. PartI. J Surg Oncol 1995;60:137-46.
- 6. Spratt JS, Spratt JA. What is breast cancer doing before we can detect it? J Surg Oncol 1985;30:156-60.
- 7. Haskell CM. Thorax and unknown primary— breast cancer in cancer treatment. 2nd ed. WB Saunders Company; 1985. p. 138.
- 8. Dietel M, Sers C. Personalized medicine and development of targeted therapies: the upcoming challenge for diagnostic molecular pathology. A review. Virchows Arch 2006;448:744-55 [Review].
- 9. Kulendran M, Salhab M, Mokbel K. Oestrogen-synthesising enzymes and breast cancer. Anticancer Res 2009;29:1095-109 [Review].
- 10. Fletcher AS, Erbas B, Kavanagh AM, Hart S, Rodger A, Gertig DM. Use of hormone replacement therapy (HRT) and survival following breast cancer diagnosis. Breast 2005;14:192-200.
Bibliografías
- 11. The Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women’s Health Initiative randomized controlled trial. JAMA 2004; 291:1701-12.
- 12. Armstrong K, Eisen A, Weber B. Assessing the risk of breast cancer. N Engl J Med 2000;342:564-71.
- 13. Boletin de la OMS, Salud de La Mujer, septiembre 25 de 2018.
- 14. Grodstein F, Manson JE, Stampfer MJ. Hormone therapy and coronary heart disease: the role of time since menopause and age at hormone initiation. J Womens Health 2006 Jan-Feb;15(1):35-44.
- 15. Hodis HN, Mack WJ, Henderson VW et al. Vascular Effects of Early versus Late Postmenopausal Treatment with Estradiol. NEJM March 31, 2016;374:13 nejm.org
* Ginecólogo/Endocrinologo/Epidemiólogo. Fundación Santa Fe de Bogotá.