La evidencia reciente apunta hacia cambios neuromoduladores cerebrales. Las neuronas de KNDy en el hipotálamo activan a receptores de la kisspeptina y a otros en las neuronas de GnRH, y esta activación libera GnRH. Al mismo tiempo, las neuronas de KNDy también inciden en el centro termorregulador en el hipotálamo.4
A continuación se explicará la fisiología de la neuroendocrinología del control hormonal del ciclo ovárico en cuanto a la producción de GnRH y su asociación con los síntomas vasomotores de la menopausia por medio de las neuronas KNDy.
Péptido inhibidor de la síntesis de gonadotrofinas (GnIH)
El péptido inhibidor de la secreción de gonadotrofinas, de la familia de los péptidos RFamida, fue caracterizado en el cerebro de las aves en 2001, localizándose la expresión del gen que codifica su síntesis exclusivamente en el diencéfalo.5
El GnIH ejerce su acción a nivel de las células diana a través de un receptor específico unido a proteína G, GPR147, que se expresa en la adenohipófisis y en el hipotálamo. En consecuencia, el GnIH parece inhibir la secreción de gonadotrofinas actuando directamente sobre la hipófisis y también inhibiendo la liberación de GnRH.6
Sistema kisspeptina/GPR54
Durante los últimos años se ha generado un importante avance en los conocimientos de la regulación de la función reproductora, entre los que destaca el sistema kisspeptina/GPR54.7
Las kisspeptinas, neuropéptidos del grupo RFamida, son una familia de péptidos codificados por el gen Kiss1 localizado en el brazo largo del cromosoma 1 (1q32), que actúan uniéndose al receptor acoplado a la proteína G, denominado GPR54 o Kiss1R.7
La estimulación de GPR54 por la kisspeptina constituye el más potente estímulo fisiológico para la secreción de GnRH y es indispensable para alcanzar los elevados niveles necesarios de este para procesos como pubertad y ovulación; sin embargo, la falta del estímulo de la kisspeptina no anula totalmente la secreción de GnRH y permite un cierto nivel de gonadotrofinas.8
Las kisspeptinas se sintetizan como pre-prokisspeptina, un péptido precursor de 145 aminoácidos que, por proteólisis y amidación, da lugar a la proteína biológicamente activa, de 54 aminoácidos.7
El papel de las kisspeptinas y su receptor en la fisiología reproductiva no fue conocido hasta 2003, año en que fueron descritos casos de hipogonadismo hipogonadotropo idiopático como consecuencia de mutaciones del gen del receptor GPR54.9
GPR54 es un receptor formado por 7 dominios transmembrana, asociado a proteínas G, cuya activación produce un aumento del Ca++ intracelular sin cambios en el nivel de AMPc, a través de señales intracelulares en que participan Gαq/11- y β-arrestina que median la secreción de GnRH.10
El aumento de Ca++ intracelular se debe a la activación de la fosfolipasa C y a la generación de inositol trifosfato y diacilglicerol y PKC.
Los receptores Kiss1R presentan la capacidad de internalizarse y desensibilizarse tras continua exposición a su ligando, siendo después reciclados hacia la membrana celular.
También presentan la propiedad de heterodimerizarse con el receptor de GnRH.7
Los individuos portadores de mutaciones o deleciones inactivadoras de GPR54 presentan infantilismo genital, fallo de la función gonadal e hipogonadotropismo y conservan la capacidad de responder a GnRH exógeno, lo que excluye alteraciones a nivel hipofisario.
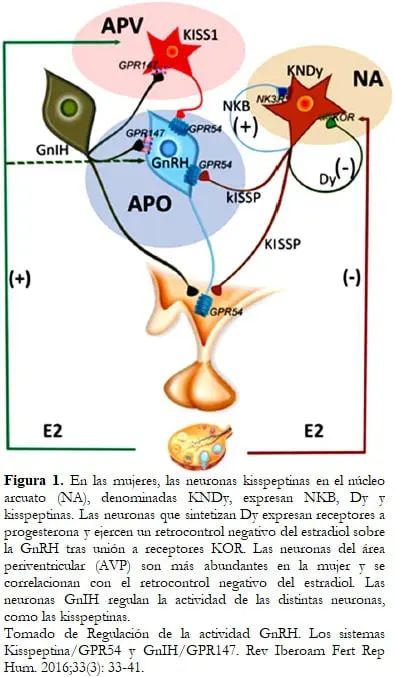
En distintas especies de mamíferos, las neuronas productoras de kisspeptina (NK) se localizan fundamentalmente en el área preóptica y en el núcleo arcuato, poblaciones celulares que también han sido identificadas en la especie humana, aunque existen ciertas diferencias en la localización de estas neuronas entre las distintas especies.12 En efecto, en el hombre, las neuronas que expresan kisspeptina en el núcleo infundibular (equivalente al arcuato de otras especies) coexpresan NKB pero escasa dinorfina; por el contrario, existe evidencia de que las mismas neuronas del núcleo infundibular de las mujeres expresan kisspeptina, dinorfina y NKB.11
La presencia de KISS1mRNA fue documentada en ganglios basales e hipotálamo en el cerebro humano en 2001, época en que también se localizó la expresión de GPR54.13
Las neuronas del área periventricular anterior del ventrículo III muestran un importante dimorfismo, siendo mucho más abundantes en las hembras, lo que se relaciona con la acción organizadora de la testosterona neonatal. Estas neuronas se han relacionado con el retrocontrol positivo del estradiol y coexpresan actividades gabaérgicas y glutamatérgicas.14 Determinadas neuronas del área periventricular son el substrato del retrocontrol positivo del estradiol.
En animales inferiores se produce una descarga de GnRH que va inmediatamente seguida por la descarga preovulatoria de gonadotrofinas, pero en la especie humana no parece necesario que se produzcan cambios preovulatorios en la secreción de GnRH para que la descarga preovulatoria de gonadotrofinas se produzca.7
El estudio del fenotipo de las neuronas Kiss de núcleo arcuato ha evidenciado que, además de kisspeptina, expresan neurokinina B (NKB) y dinorfina (Dy), por lo que se las conoce cómo neuronas KNDy. Estos tres productos se almacenan de forma independiente, en vesículas diferenciadas, en el interior de las células KNDy.15
La mayor parte de las células que sintetizan dinorfina expresan receptores a la progesterona y están implicadas en el retrocontrol negativo de la progesterona sobre la GnRH.16
La dinorfina es un miembro de la familia de los péptidos opioides endógenos que actúa a través del receptor opioide kappa (KOR). NKB juega un papel importante en la estimulación del desarrollo folicular en la mujer.17
Ha sido postulada una hipótesis sobre la forma en que las neuronas KNDy, sintetizando y liberando simultáneamente tres péptidos, kiss, NKB y Dy, pueden regular la síntesis y liberación de GnRH. NKB y Dy pueden actuar autosinápticamente sobre las células KNDy que, a su vez, actuarían sobre las neuronas GnRH utilizando kisspeptina como efector.
Las neuronas kiss1 del núcleo arcuato constituyen un eslabón importante para la integración de las señales que transmiten los esteroides sexuales causantes del retrocontrol negativo que se ejerce sobre las neuronas GnRH y, por lo tanto, a las células gonadotropas. Estos efectos inhibidores de las neuronas kiss se ejercen a través de los receptores alfa de estradiol (ERα). Al margen de las neuronas kiss, la participación de la hipófisis en el retrocontrol negativo ha sido documentada7
Mecanismo de generación de fogajes
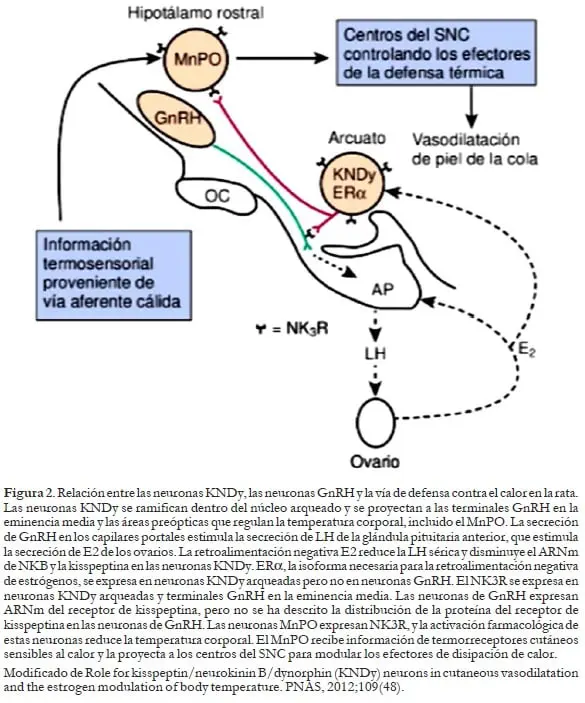
Revisada la fisiología normal del organismo femenino en cuanto al papel que juegan las neuronas KNDy en la secreción de GnRH y la estimulación de gonadotrofinas, ¿cómo están implicadas estas mismas neuronas en el mecanismo de generación de los fogajes? La evidencia actual sugiere que la secreción pulsátil de GnRH está modulada por una subpoblación de neuronas en el núcleo arqueado (infundibular) que expresa el receptor de estrógeno α (ERα), el receptor de neuroquinina 3 (NK3R), kisspeptina, neuroquinina B (NKB) y dinorfina.
En el hipotálamo de las mujeres posmenopáusicas, estas neuronas de kisspeptina/NKB/ dinorfina (KNDy) experimentan una hipertrofia somática inusual y expresan un aumento de las transcripciones de genes de kisspeptina y NKB.18
Los cambios en las neuronas KNDy en mujeres posmenopáusicas son secundarios al retiro de estrógenos ováricos y no se deben al envejecimiento per se.
Experimentos en roedores han demostrado que las neuronas KNDy se proyectan en estructuras críticas para la regulación de la temperatura corporal, incluido el núcleo preóptico mediano (MnPO), un componente importante de una vía termosensorial de defensa contra el calor.
Además, la activación farmacológica de las neuronas que expresan NK3R en el MnPO provoca una disminución robusta en la temperatura de la piel de la cola del roedor.
Si bien estos datos indican que la señalización de NK3R puede influir en la temperatura corporal a nivel de MnPO, no hay información sobre si las neuronas KNDy modulan la temperatura corporal o median los efectos del estrógeno en el sistema termorregulador19 (figura 2).
Discusión
Convencionalmente, la terapia de reemplazo hormonal se ha utilizado ampliamente para ayudar a restablecer el equilibrio hormonal y, por lo tanto, mejorar los sofocos.20 Sin embargo, la terapia de reemplazo hormonal puede no ser adecuada en mujeres con mayor riesgo de enfermedad cardiovascular, enfermedad tromboembólica o mayor riesgo de ciertos tipos de cáncer, como el cáncer de mama y el endometrial.
Por lo tanto, su eficacia está limitada por la duración del tratamiento recomendado y sí existen contraindicaciones que prohíban su uso. Las opciones de tratamiento alternativas incluyen inhibidores selectivos de la recaptación de serotonina, gabapentina, terapia cognitiva conductual, remedios herbales, acupuntura, así como modificaciones en la dieta y el estilo de vida.20
A la luz de la importante carga de síntomas que experimentan las mujeres posmenopáusicas debido a los sofocos, la necesidad de nuevos agentes ha sido un foco de investigación en los últimos años. Además de la menopausia, las mujeres que han recibido terapia de privación hormonal para el cáncer de mama también experimentan síntomas de sofocos.
Sin embargo, el reemplazo de estrógenos generalmente no se recomienda en estos casos, por lo que se requieren opciones de tratamiento alternativas y eficaces.
La comprensión de las vías neuroendocrinas implicadas en la regulación de la reproducción y la secreción de hormonas sexuales ha avanzado significativamente en los últimos 15 años como lo describimos previamente y, por lo tanto, ha ayudado a identificar posibles objetivos terapéuticos nuevos para futuras investigaciones.
(Lea También: Hemorragia Uterina Anormal en Perimenopausia y Posmenopausia)
Tales objetivos incluyen la vía de señalización de la neuroquinina B (NKB).20
Como se ha demostrado que la estimulación de la señalización NKB/NK3R induce sofocos, el antagonismo de esta vía de señalización emerge naturalmente como un objetivo terapéutico potencial para ayudar a mejorar estos síntomas.
Como se mencionó anteriormente, el antagonismo central de la señalización de NKB dentro del mPOA de las ratas puede prevenir la respuesta fisiológica de sofocos que se genera por la activación de la neurona kisspeptina en el núcleo arqueado.
Esto se puede traducir a un modelo humano, por lo que la respuesta de sofocos puede atenuarse por el antagonismo de los receptores de neuroquinina.20
Como se expuso en esta revisión, se han descrito nuevas rutas y nuevas teorías de la etiología de los síntomas vasomotores que se presentan en la menopausia, así como nuevas terapias basadas en estas nuevas rutas neuroendocrinológicas que han mostrado tener buena respuesta en la mejoría de los síntomas vasomotores.
Referencias
-
1. Fritz MA, Speroff L. Endocrinología ginecológica clínica y esterilidad. 8th ed. Filadelfia. Lippincott Williams & Wilkins. 2012; p 639-662.
-
2. Eun-Ok Im. Ethnic Differences in Symptoms Experienced During the Menopausal Transition. Health Care Women Int. 2009 April; 30(4):339-55. Available from: https://doi.org/10.1080/07399330802695002.
-
3. Gómez G. Endocrinología clínica e infertilidad. 1.a ed. Catorse; capítulo 10.
-
4. Moore AM, Coolen LM, Lehman MN. Kisspeptin/Neurokinin B/Dynorphin (KNDy) cells as integrators of diverse internal and external cues: evidence from viral-based monosynaptic tract-tracing in mice. Sci Rep. 2019 Oct 14;9(1):14768. Available from: https://doi.org/10.1038/s41598-019-51201-0
-
5. Satake H, Hisada M, Minakata TK, Ukena K, Tsutsui K. Characterization of a cDNA encoding a novel avian hypothalamic neuropeptide exerting an inhibitory effect on gonadotropin release. Biochem J. 2001;354: 379-85.
-
6. Tsutsui K, Ubuka T, Yin H, Osugi T, Ukena K, Bentley G. Mode of action and functional significance of avian gonadotropin inhibitory hormone (GnIH): a review. J Exp Zool A Comp Exp Biol. 2006;305:801-6.
-
7. Romeu A, López Villaverde V, Monzó A, Carmona Ruiz IO, Romeu M. Regulación de la actividad GnRH. Los sistemas Kisspeptina/ GPR54 y GnIH/GPR147. Rev Iberoam Fert Rep Hum. 2016;33:33-41.
-
8. Chan Y, Broder-Fingert S, Wong K, Seminara S. Kisspeptin/Gpr54-independent gonadotrophin- releasing hormone activity in Kiss1 and Gpr54 mutant mice. J Neuroendocrinol. 2009; 21:1015-23.
-
9. Seminara S, Messager S, Chatzidaki E, Thresher R, Acierno JJ, Shagoury J. The GPR54 gene as a regulator of puberty. N Engl J Med. 2003;349:1614-27.
-
10. Millar R, Babwah A. KISS1R: Hallmarks of an Effective Regulator of the Neuroendocrine Axis. Neuroendocrinology. 2015;101:193-210.
-
11. A. Rometo N. Rance. Changes in prodynorphin gene expression and neuronal morphology in the hypothalamus of postmenopausal women. J Neuroendocrinol. 2008;20:1376-81.
-
12. Lehman M, Merkley C, Coolen L, Goodman R. Anatomy of the kisspeptin neural network in mammals. Brain Res. 2010;1364:90-102.
-
13. Darker J, Larminie C, Wilson S, Bergsma D, Emson P, Faull R. AXOR12, a novel human G protein-coupled receptor, activated by the peptide KiSS-1. J Biol Chem. 2001;276: 28969-75.
-
14. Cravo R, Margatho L, Osborne-Lawrence S, Donato JJ, Atkin S, Bookout A. Characterization of Kiss1 neurons using transgenic mouse models. Neuroscience. 2011;173:37-56.
-
15. Lehman M, Coolen L, Goodman R. Minireview: kisspeptin/neurokinin B/dynorphin (KNDy) cells of the arcuate nucleus: a central node in the control of gonadotropin-releasing hormone secretion. Endocrinology. 2010;151: 3479-89.
-
16. Dufourny L, Caraty A, Clarke I, Robinson J, Skinner D. Progesterone- receptive betaendorphin and dynorphin B neurons in the arcuate nucleus project to regions of high gonadotropin-releasing hormone neuron density in the ovine preoptic area. Neuroendocrinology. 2005;81:139-49.
-
17. Skorupskaite K, George J, Anderson R. Role of a neurokinin B receptor antagonist in the regulation of ovarian function in healthy women. Lancet. 2015;385. Suppl 1:S92.
-
18. Skorupskaite K, George JT, Veldhuis JD, Millar RP, Anderson RA. Neurokinin 3 Receptor Antagonism Reveals Roles for Neurokinin B in the Regulation of Gonadotropin Secretion and Hot Flashes in Postmenopausal Women. Neuroendocrinology. 2018;106(2):148-157.
-
19. Mittelman-Smith AM, Williams H, Krajewski- Hall SJ, McMullen NT, Rance NE. Role for kisspeptin/neurokinin B/dynorphin (KNDy) neurons in cutaneous vasodilatation and the estrogen modulation of body temperature. PNAS, 2012;109(48):19846-51.
-
20. Modi M, Dhillo WS. Neurokinin 3 Receptor Antagonism: A Novel Treatment for Menopausal Hot Flushes. Neuroendocrinology. 2019;109:242-8.