El enfoque propuesto (figura 2) conduce al diagnóstico etiológico de la HUA. Para cualquier causa, actualmente, se cuenta con muchas alternativas para poder aplicarlas en forma individualizada. En primer lugar, a todas las pacientes se les debe estimular a adoptar hábitos de vida saludable; y, a cada una en particular, acorde a la causa de la HUA, se le selecciona el mejor tratamiento médico y/o quirúrgico disponible (tabla 2):
- Expectante, algunas veces.
- Tratamientos médicos no hormonales:
a. Antiinflamatorios no esteroideos (AINES).
b. Ácido tranexámico. - Tratamientos médicos hormonales:
a. Progestágenos cíclicos o de acción prolongada.
b. Anticonceptivos orales combinados (ACOS).
c. Análogos de GnRH (GnRHa).
d. Moduladores selectivos del receptor de progesterona (SPRM): ulipristal, vilaprisan. - Dispositivo cargado con levonorgestrel (DIU-LNG).
- Ablación endometrial.
- Embolización arterial uterina.
- Histerectomía.
No obstante, y acorde a guías de manejo, es prudente tratar todas las hemorragias perimenopáusicas y posmenopáusicas: primero, con medicamentos o DIU-LNG; entre otras cosas, porque las estructurales como leiomiomatosis y adenomiosis se pueden llevar con medicamentos a empatar con la menopausia, en su tratamiento natural, para en adelante seguirlas en forma expectante; y, con procedimientos quirúrgicos, en segundo lugar.23-25
Adopción de hábitos de vida saludable.
Se deben recomendar a todas las pacientes. Así, se disminuyen los síntomas climatéricos, los efectos adversos de la terapia hormonal y otros medicamentos, la obesidad, la enfermedad cardiovascular (ECV), la diabetes II, la hipertensión arterial, el cáncer mamario, la osteoporosis, y las alteraciones psicológicas, sexuales y sociales:26
- Dieta sin grasas, rica en omega 3, con ácidos grasos esenciales poliinsaturados EPA y DHA (nueces, atún, sierra, bonito, salmón, sardinas), carnes blancas, frutas, verduras, cacao, calcio, agua y cereales ricos en fibra. Vitamina D, si la 25OH-D está baja en sangre.
- Ejercicio físico tipo aeróbico moderado, 30 min/día 3 veces por semana, para mantener el índice de masa corporal (IMC) entre 20 y 25 y el perímetro abdominal menor de 88 cm; y para bajar citoquinas inflamatorias, IL -1â, IL- 6, TNF-á.
- Ejercicios mentales y relajación espiritual para mantener la función cognitiva y manejar el estrés.
- Evitar cigarrillo, bebidas calientes y alcohol, conocidos disparadores de los síntomas vasomotores.
Para un enfoque práctico, en este artículo se revisan primero las causas de la HUA (tabla 1), siguiendo la clasificación PALM-COEIN. Se mostrarán, en cada causa, sus aspectos básicos, sugiriendo los medicamentos y los procedimientos quirúrgicos, manejados desde consulta externa (tabla 2). Y, al final, se verá el manejo urgente de las hemorragias severas (tabla 3).
1. Pólipo endometrial
El pólipo endometrial es un sobrecrecimiento hiperplásico local de estroma y glándulas endometriales alrededor de un núcleo vascular que se proyecta hacia la cavidad uterina. Es generalmente benigno, digitiforme, pediculado, sésil, simple o múltiple, con tamaños de milímetros a centímetros llenando la cavidad uterina.27
Fisiopatología: El hiperestrogenismo produce angiogénesis con aumento de metaloproteinasas de matriz tisular y ciclooxigenasa, generando vasos frágiles e irregulares que se rompen y sangran.
Diagnóstico: Se hace con ECO-TV y se confirma con SHG.
Tratamiento: Cualquier medicamento oral o parenteral (tabla 3). Resección por histeroscopia, en caso necesario. El legrado uterino no es tan seguro.
2. Adenomiosis
Es la penetración progresiva del endometrio en el miometrio con proliferación e hipertrofia del músculo liso que lo rodea. Generalmente es difusa pero también focal como adenomioma. Afecta al 10 a 75% de mujeres y produce hemorragia en el 20 y 11% de perimenopáusicas y posmenopáusicas, respectivamente28.
Diagnóstico: La ECO-TV (doppler color y 2D), bien realizada, permite observar:
- Asimetría de paredes miometriales.
- Quistes miometriales.
- Islas hiperecoicas.
- Sombreados en abanico.
- Botones o líneas hiperecoicas subendometriales.
- f) Presencia de vasos translesionales.
- Zonas irregulares de unión endometriomiometrio.
- Zonas interrumpidas de unión endometrio- miometrio.
No obstante, a veces hay dudas diagnósticas y se hace necesaria la RNM, como método más preciso.
Tratamiento:
- Acetato de medroxiprogesterona (AMP) 150 mg IM, cada 1 a 3 meses.
- DIU-LNG o análogos de la GnRH (GnRHa).
- Histerectomía, cuando la paciente está lejos de la menopausia.
3. Leiomiomatosis
La leiomiomatosis tiene una prevalencia entre 40 y 70% de mujeres caucásicas y hasta en el 80% de afroamericanas29. No obstante, solo causa hemorragia anormal en el 20 a 50% de perimenopáusicas y en el 10% de posmenopáusicas, respectivamente. Sucede cuando son leiomiomas tipos 0-1-2-3 e híbridos que hacen contacto con el endometrio (figura 3).
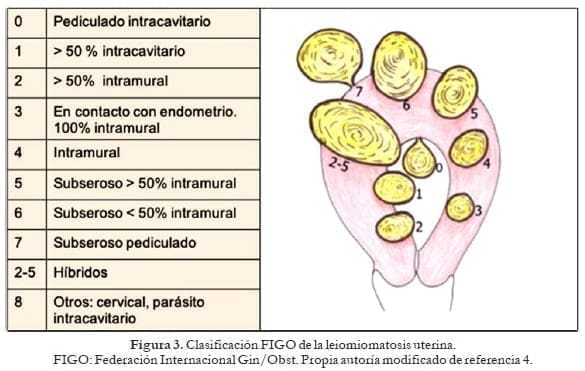
Fisiopatología:
Los miomas se desarrollan a partir de la expansión clonal de un miocito junto con abundante matriz extracelular. Es una patología fundamentalmente estrógeno y progestágeno dependiente, dado que sus receptores son abundantes en comparación con el tejido miometrial sano, y su crecimiento decae con la menopausia.30 Sin embargo, el estímulo de crecimiento miomatoso es multifactorial, semejando un tejido de cicatrización con remodelación, fibrosis e inflamación, comandado por citoquinas e integrinas que controlan factores de proliferación celular, en miocitos con frecuentes alteraciones genéticas (traslocaciones, inversiones). La hipoxia es significativa en el tejido miomatoso en relación con al normal, especialmente en los miomas submucosos y el endometrio subyacente, como consecuencia de la neovascularización emergente con inflamación asociada y expresión de factores de crecimiento (Ang-2, VEGF, EGF, FGF y TGF-â), dando como resultado angiogénesis aberrante, rupturas y hemorragias.
Diagnóstico.
Clínico, ECO-TV, SHG e histeroscopia.
Tratamiento:
Opciones con medicamentos para disminuir la HUA y el tamaño de los leiomiomas. Recomendados para disminuir el tamaño de los miomas antes de procedimientos quirúrgicos o para empatar con la menopausia, dado el hipoestrogenismo resultante que los va atrofiando paulatinamente:
a. GnRHa: Bloquean las gonadotropinas ocasionando amenorrea hipogonadotrópica- hipoestrogénica30. Una ampolla IM de 11,25 mg en tres meses reduce la HUA en el 85 a 90% de las veces y el volumen uterino en el 47%. Cuando se administra por más de tres meses es necesario agregar tibolona para manejo de los síntomas vasomotores resultantes del hipoestrogenismo (ad-back).
b. Ulipristal: Es un SPRM oral, con efectos antiproliferativos, antifibróticos y proapoptóticos sobre las células de los leiomiomas. Reduce el tamaño de miomas y HUA casi igual que los GnRHa y aparentemente con menores efectos colaterales. 31 Sin embargo, se reportaron casos de daños hepáticos severos que requirieron trasplante, por lo cual la FDA en 2018 rechazó su uso32. No obstante, estudios recientes lo siguen aconsejando en mujeres sin riesgo, realizando monitoreo de la función hepática antes y cada tres meses durante el tratamiento.33,34 Pero, en marzo del 2020, se informó otro caso de daño hepático severo relacionado con el ulipristal que requirió trasplante, por lo que su uso actual es cuestionado.35
c. Vilaprisan: Es otro SPRM oral emergiendo como un tratamiento prometedor, dado que 1 mg día por 3 meses tiene efectos parecidos a los GnRHa y al ulipristal, acorde a un estudio multicéntrico en 12 países, con 309 pacientes, y pocos efectos colaterales.36
Medicamentos para disminuir la HUA sin efecto en el volumen de los leiomiomas, para casos leves:29,30
a. DIU-LNG: Libera levonorgestrel 20 mcg/día durante 5 años. Este progestágeno disminuye la HUA, pero solamente se puede aplicar en caso de leiomiomas tipos 3 o híbridos que no distorsionen la cavidad uterina.
b. Ácido tranexámico: Es un antifibrinolítico inhibidor de los receptores de lisina en el plasminógeno, así previene la degradación de la fibrina y estabiliza funcionalmente la formación de coágulos. Se debe utilizar como monoterapia para no aumentar riesgos de tromboembolismo (tabla 3).
c. ACOS: Seleccionar el que más se ajuste al perfil de cada paciente. Se formulan 1-2 tabletas los primeros días del sangrado, para continuar una cada día hasta terminar la caja.
d. AINES: Ácido mefanámico, en casos muy leves, 500 mg cada 6 horas los días del sangrado.30
Procedimientos quirúrgicos:
a. Miomectomías por histeroscopia: Útiles para resecar miomas submucosos tipos 0 y 1 menores de 5 cm y tipo 2 menores de 2 cm; aunque son posibles en casos tipo 2 mayores de 2 cm, realizan varios tiempos quirúrgicos, haciendo manejo previo con GnRHa y ECO-TV tras operatoria.37
b. Miomectomías por laparoscopia, cirugía robótica o laparotomía: Poco recomendadas cuando, a esta edad, ya no hay deseos de embarazos. Se justificarían solo para resecar miomas híbridos productores de hemorragia, pero en estos casos es major el tratamiento médico para empatar con la menopausia, el tratamiento natural. Como las miomectomías por laparoscopia o cirugía robótica necesitan morcelación de los miomas, la Administración de Comidas y Medicamentos (FDA, por sus siglas en inglés) ha recomendado que los tejidos resultantes sean empaquetados cuidadosamente en bolsas intraperitoneales para ser extraídos evitando diseminación de tejido miomatoso y complicaciones posteriores de miomatosis parasitaria o leiomiomatosis intraperitoneal diseminada38.
c. Embolización arterial uterina: Indicada en pacientes perimenopáusicas no aptas para cirugía.39 Se deben seleccionar bien las pacientes para minimizar los riesgos de dolor isquémico persistente y tromboembolismo.40
d. Histerectomía: Se puede realizar por laparoscopia, laparotomía o vaginalmente, como último recurso.
4. Malignas: hiperplasia y cáncer endometrial
Hiperplasia endometrial:
Esta se sospecha en pacientes con menarquia temprana y menopausia tardía, nulíparas, expuestas crónicamente a estrógenos sin oposición con progestágenos, obesidad, diabetes, anovulación crónica (síndrome del ovario poliquístico, SOP), infertilidad, y presencia de células glandulares atípicas en la citología. Causa hemorragia anormal en la perimenopausia 10 a 24 % y en la posmenopausia 5 a 19% (tabla 1), sin tratamiento puede progresar a cáncer endometrial, así:
- sin atipias y simple 1%,
- sin atipias y compleja 3%,
- con atipias y simple 8%,
- con atipias y compleja 29%.3
Un metaanálisis de 65 artículos mostró que el riesgo de cáncer de endometrio por hiperplasia sin atipias fue del 0,33 (IC del 95% 0,23-0,48%, n a 29 059; 97 casos); y de hiperplasia con atípicas 1,31 (95% CI 0,96-1,80, n a 15 772; 207 casos). También se notó que el riesgo de cáncer es menor si la hemorragia es abundante (0,11%, IC 95% 0,04-0,32%, n a 8352; 9 casos) vs. (0,52%, 95% IC 0,23-1,16%, n a 3109; 14 casos).41
Carcinoma endometrial:
Este carcinoma ocasiona ± 8% y ± 10% de hemorragias perimenopáusicas y posmenopáusicas, respectivamente. 12 Sin embargo, a lo largo de la vida, se diagnostican 10% en la premenopausia y 90% a lo largo de la posmenopausia. En EUA es el cuarto cáncer en mujeres, después del de seno, pulmón y colorrectal, en dos formas de presentación: tipo 1 (90%), relacionado con hiperplasia endometrial y exposición a estrógenos, y tipo 2 (10%) seroso o de células claras no relacionadas con la exposición a estrógenos, pero de pronóstico relativamente pobre.42 Los riesgos de cáncer endometrial son los siguientes:
- Hiperplasia endometrial, con todos los riesgos de esta.
- Edad, directamente relacionado. El riesgo por 100.000 mujeres es de 2,8 entre los 30 y 34 años; 6,1 entre los 35 y 39 años; y 36,5 entre los 40 y 49 años; y 8/100.000 cada año después de los 50.43
- Terapia hormonal: Si es solo con estrógenos, OR de 2,42; y si es combinada cíclica, 1,63.44
- Tamoxifeno. Es un modulador selectivo de receptores de estrógenos (SERM) con efectos antiestrogénicos en seno y estrogénicos en endometrio. Las usuarias en manejo por carcinoma de seno tienen 10% de riesgo, incrementado 3 a 6 veces por exposición mayor a 5 años.45
- Genéticos con historia familiar o personal de cáncer colorrectal no polipoide (S. de Lynch), con 42 a 60% de riesgo de sufrirlo a lo largo de la vida.
Diagnóstico de malignidad:
- Se sospecha en pacientes con hemorragia anormal, GE > 4 mm, y factores de riesgo.
- El GE > 4 mm en perimenopáusicas y posmenopáusicas es actualmente el umbral determinado. Un análisis de varios metaanálisis sobre GE realizado por Monro12 muestra que el GE < 3 mm tiene 0,4% de probabilidad de cáncer endometrial; el GE < 4 mm 1,2%; y el GE < 5 mm 4,0%; sin embargo, el Colegio Americano de Obstetricia y Ginecología (ACOG, por sus siglas en inglés) definió que se debe dejar el umbral de GE 4 mm al tener un valor predictivo negativo superior al 99% para el cáncer de endometrio.46
- La biopsia endometrial se puede tomar oficinalmente, aun sin estudio ecográfico en pacientes con HUA y GE > 4 mm. Pero a veces no se puede realizar por estenosis cervical y, además, como se explicó en el enfoque de manejo de las hemorragias, cuando la biopsia es tomada a ciegas con cualquier tipo de cureta, con D&C o por aspiración, falla en ± 10% de las veces.
- La biopsia con guía histeroscópica es el mejor método para tomar la muestra observando y tomando la porción endometrial sospechosa para hacer el diagnóstico histopatológico, con sensibilidad de 96% y especificidad de 100%.
Tratamiento de la hiperplasia47,48
- Primero, Hiperplasia simple sin atipias: AMP oral 10 mg/día (5-25 días mes) o DIU-LNG, y controles posteriores.
- Segundo, Hiperplasia compleja sin atipias: AMP 20 mg/día, acetato de megestrol 40 mg/día o histerectomía, si varios riesgos.
- Tercero, Hiperplasia con atipias y premenopáusicas: altas dosis de progestinas o histerectomía.
- Cuarto, Hiperplasia con atipias y posmenopáusica: histerectomía con oforectomía bilateral por los riesgos de metástasis ováricas y cáncer de mama futuros.
Tratamiento del cáncer endometrial:
Se debe remitir a oncología ginecológica para manejo apropiado.
5. Coagulopatías
Enfermedad de Von Willebrand:
La hemorragia por coagulopatías es poco frecuente en perimenopausia (0,3%) y en posmenopausia (8%). El factor de Von Willebrand (vWF) favorece la agregación plaquetaria a las paredes vasculares lesionadas a través de la glicoproteína IB y transporta el factor VIII. Hay tres tipos de alteraciones:
- Primero, Tipo I, disminución leve o moderada del vWF (80%).
- Segundo, Tipo II, disminución cualitativa.
- Tercero, Tipo III, disminución severa o total del cWF.
Diagnóstico: Sospecha clínica, PTTa, cofactor de ristocetina y estudio genético del vWF.
Tratamiento: Ácido tranexámico y desmopresina en espray nasal por 2 a 3 días durante la menstruación (tablas 5 y 6). En casos graves y en cirugía: desmopresina (0,3 pg/kg en 50 cc de SS 0,9% en infusión lenta), ácido tranexámico (10 mg/kg inicial, seguido de 1 mg/kg/hora) y a veces concentrados del FVIII/vWF.49
Otras anomalías de coagulación y HUA:
Déficit de factores XI, IX (hemofilia B) y VII (hemofilia A) y disfunciones plaquetarias, las más comunes.
6. Ovulación disfuncional o anovulación
Es la más frecuente en la perimenopausia (tabla 1), y obviamente no hay en la posmenopausia. Todas las alteraciones del eje HHO, en su camino involutivo, terminan en anovulación, primero por falta de progesterona y después por falta de estrógenos, alterando los mecanismos hemostáticos endometriales y produciendo sangrados irregulares; y con el hipoestrogenismo se llega a la atrofia endometrial con leve capa funcional expuesta a vasos aberrantes que sangran. También pueden confluir causas tiroideas y suprarrenales.
Diagnóstico:
Sospecha clínica y perfil endocrino consecuente: FSH, TSH, PRL, por lo menos.
Tratamiento:
Existen varias posibilidades, médicas y quirúrgicas, para tomarlas progresivamente acordes a cada paciente y la severidad de la HUA (tabla 3):
- AINES: Recomendados en pacientes con riesgos a los ACOS y progestágenos.50
- Progestágenos: Los progestágenos se recomiendan ante la sospecha de hiperplasia.51 Son más recomendados los orales.
- ACOS: Los anticonceptivos orales combinados regulan los ciclos menstruales, tratan la HUA y evitan riesgos de embarazo. Cuando no es necesaria la anticoncepción, una terapia hormonal cíclica con estradiol (1mg) más didrogesterona funciona bien y de paso trata los síntomas vasomotores si los tiene.10
- Ácido tranexámico: Es un antifibrinolítico igualmente efectivo a los ACOS, pero con menos contraindicaciones.50,51 Se deben cuidar riesgos tromboembólicos, usándolo como monoterapia oral los primeros 3 a 5 días del sangrado (tabla 3).
- DIU-LNG: Libera 20 μg/día de levonorgestrel por 5 años. Reduce la HUA en el 71 a 95% de las veces. Desde los 6 meses produce atrofia endometrial y amenorrea en el 33% de las pacientes. Las contraindicaciones incluyen cáncer de mama, anomalía uterina que distorsiona la cavidad, infección pélvica o cervical aguda, y cirrosis grave o cáncer de hígado.52
- Ablación endometrial: Por histeroscopia (láser, roller-ball o resectoscopia) y por procedimientos no histeroscópicos (balones térmicos, crioablación, microondas o radiofrecuencia) con igual efectividad.53
- Histerectomía: Solo como último recurso y excepcionalmente necesaria. Se puede realizar con técnica laparoscópica, vaginal o abdominal.
7. Endometriales
Posibles causas: trastorno local de mecanismos hemostáticos, deficiencias de vasoconstrictores como la endotelina 1 y PG-F2â, producción excesiva de activador de plasminógeno, o vasodilatación por prostaglandina E2 y prostaciclina. También se puede incluir aquí la endometritis crónica.54
Diagnóstico: Exclusión de otras causas de sangrado. En caso de endometritis son necesarios laboratorios acordes incluyendo investigación de gonococo y clamidia.
Tatamiento:
- HUA, como en las disfunciones ovulatorias.
- Si hay endometritis crónica: terapia antibiótica de primera línea dirigida por cultivo (cuando este estuvo disponible) o tratamiento empírico con doxiciclina 200 mg/día por dos semanas o bien, levofloxacina más metronidazol 1 gr/día por dos semanas.55
8. Iatrogénicas
La lista de problemas iatrogénicos causantes de HUA es larga:50
- Anticoagulantes: warfarina, aspirina, clopidogrel.
- Medicamentos que afectan el control neuro-endocrino-psico-inmunológico del ciclo menstrual: (i) fenotiazinas y antidepresivos tricíclicos, serotoninérgicos y fenobarbital; (ii) hormonas esteroideas: estrógenos, progestágenos, andrógenos, glucocorticoides, incluida la terapia hormonal; (iii) otras hormonas: danazol, GnRHa, tamoxifeno, tiroxina.
- Citostáticos y antipalúdicos.
- El dispositivo intrauterino (DIU) como cuerpo extraño.
Diagnóstico: Buena historia clínica.
Tratamiento: Retirar la iatrogenia si es posible y tratar la hemorragia con medicamentos.
(Lea También: Vacunación contra el Virus del Papiloma Humano 2020)
9. No clasificadas
Son hemorragias por causas excepcionales y aun no clasificadas, tales como traumas, malformaciones arteriovenosas, hipertrofia miometrial e istmocele y, desde luego, podrán existir otras en el futuro, para incluirlas aquí. No son reveladas por los métodos de diagnóstico convencionales sino intraoperatoriamente o en el estudio histopatológico de la pieza quirúrgica, entre otros.50 Aquí se puede incluir la atrofia endometrial, dado que es estructural y no está en las PALM.
10. Atrofia endometrial
Diagnóstico: GE < 2-3mm y biopsia afirmativa.
Tratamiento: Estradiol oral o IM, adicionando progesterona oral diez días después, en forma cíclica o continua como terapia hormonal, con seguimiento cuidadoso.56
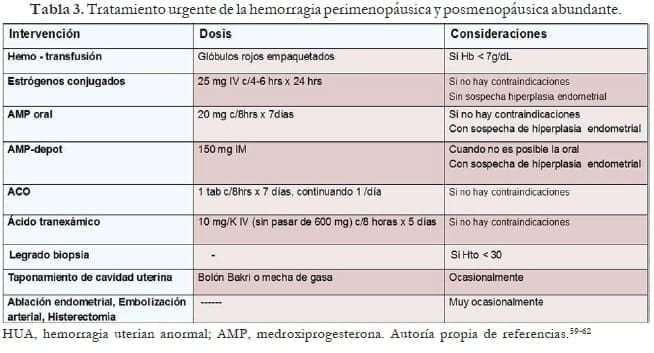
Manejo urgente de la hemorragia abundante
La HUA aguda se refiere a un episodio de sangrado abundante que, en opinión del médico, requiere una intervención inmediata para prevenir una mayor pérdida de sangre.57,58 En estos casos se debe proceder a lo siguiente:
- Evaluar rápidamente el cuadro clínico para determinar la urgencia del manejo. Grado de anemia e hipovolemia, inestabilidad hemodinámica.
- Determinar la etiología más probable del sangrado. Causas extragenitales de la hemorragia. Examen ginecológico lo más completo posible. Simultáneamente solicitar β-HCG en perimenopáusicas, CH, hemoclasificación, perfil de coagulación, hierro, ferritina, TSH, pruebas de función hepática y renal, clamidia y ECO-TV en paciente estable.
- Elegir el tratamiento más adecuado:
Tratamiento:
Médico (tabla 4) y en última instancia quirúrgico. La necesidad de tratamiento quirúrgico se basa en la estabilidad clínica de la paciente, la gravedad del sangrado, las contraindicaciones al manejo médico, la falta de respuesta de la paciente al manejo y la condición médica- subyacente de la paciente.
Previamente es necesaria la rápida estabilización hemodinámica: hemotransfusión.59-62
- Estrógenos a altas dosis: Promueven rápida proliferación endometrial para recubrir áreas desprovistas de epitelio, incrementan el fibrinógeno y favorecen la agregación plaquetaria. Recomendados cuando en la ECO-TV hay atrofia endometrial, poco material al realizar la biopsia endometrial y HUA por progestágenos. Se deben continuar con un ciclo de progestágenos orales o ACOS. Contraindicados en tromboembolismo arteriovenoso, enfermedad hepática, trastornos cardiovasculares y cáncer de seno.
- Progestágenos: Recomendados si la ECO-TV muestra endometrio engrosado o se obtiene mucha materia al realizar la biopsia o el legrado. La medroxiprogesterona oral, cuando es posible, da mejores resultados que en ampollas. Contraindicada en cáncer de mama, tromboembolismo arteriovenoso y enfermedad hepática.
- ACOS: 2 a 4 tabletas al día por dos semanas, continuando con una al día hasta completar 21 días. Si no hay contraindicaciones, fumadoras, hipertensas, ECV, tromboembolismo, enfermedad hepática.
- Ácido tranexámico: 10 mg/kg IV (sin pasar de 600 mg) cada 8 horas por 5 días; se debe ser cuidadoso en pacientes con historia de enfermedad tromboembólica.63
- Legrado-biopsia: En pacientes inestables hemodinámicamente, con hematocrito menor de 30. Se quita temporalmente la hemorragia, por lo que se debe continuar con un ciclo de estrógenos-progestágenos o de solo progestágeno acorde a la cantidad de material obtenido, mientras lleguen los resultados del estudio citopatológico.
- Ablación endometrial: Los equipos de segunda generación (ablación endometrial de globo térmico, ablación endometrial de microondas, ablación hidrotermal, ablación endometrial de radiofrecuencia bipolar, crioterapia endometrial) son de eficacia equivalente para el sangrado abundante, son procedimientos cortos en tiempo y se realizan con más frecuencia bajo anestesia local.64
- Taponamiento uterino, embolización arterial uterina o histerectomía: En última instancia.
Conclusiones
- El manejo de la HUA en la perimenopausia y la posmenopausia es frecuente motivo en consulta externa y de intervención en salas de urgencias.
- Afortunadamente, la mayoría casos no implican, como causa, neoplasia maligna o condiciones premalignas avanzadas.
- Sus causas se pueden agrupar, aunque separadas, con el acrónimo PALM-COEIN.
- Existen buenos métodos de diagnóstico y diferentes tratamientos, tanto médicos como quirúrgicos, para adoptarlos en forma individualizada, en estas etapas de la vida de la mujer, donde es más prudente iniciar los manejos con medicamentos y, en caso de ser necesario, los quirúrgicos, utilizando los procedimientos menos invasivos, en lo posible.
Referencias
-
1. Harlow SD, Gass M, Hall JE, Lobo R, Maki P, Rebar RW, Sherman S, Sluss PM, de Villiers TJ, STRAW 10 Collaborative Group. Executive summary of the Stages of Reproductive Aging Workshop + 10: addressing the unfinished agenda of staging reproductive aging. Menopause. 2012 Apr;19(4):387-95.
-
2. Palacios S, Nappi RE, Bruyniks N, Particco M, Panay N. The European Vulvovaginal Epidemiological Survey (EVES): prevalence, symptoms and impact of vulvovaginal atrophy of menopause. Climacteric. 2018;21(3):286- 91. Available from: https://doi.org/10.1080/13697137.2018.1446930
-
3. Goldstein S R. Lumsden MA. Abnormal uterine bleeding in perimenopause. Review. Climateric J. 2017;20(5). Available from: http://dx.doi.org/10.1080/13697137.2017.1358921
-
4. Pérez LE. Hemorragia uterina anormal. En: Pérez LE. Infertilidad y endocrinología reproductiva. Cuarta edición. Bogotá: Brand Studio Ed; 2015. p. 455-477.
-
5. Betha K, Malavatu L, Talasani S. Distribution of causes of abnormal uterine bleeding using new FIGO classification system-PALM COEIN: a rural tertiary hospital-based study. JPMA. 2013;63(8): 973. Available from: http://dx.doi.org/10.18203/2320-1770.ijrcog20173476
-
6. Bacon J. Abnormal Uterine Bleeding: Current Classification and Clinical Management. Review Obstet Gynecol Clin North Am. 2017;44:179-93. Available from: https://doi.org/10.1016/j.ogc.2017.02.012
-
7. Damle RP, Dravid NV, Suryawanshi KH, Gadre AA, Bagale PS, Ahire N. Clinicopathological Spectrum of Endometrial Changes in Peri-menopausal and Post-menopausal Abnormal Uterine Bleeding: A 2 Years Study. J Clin Diagn Res. 2013 Dec;7(12):2774-6. Published online 2013 Dec 15. Available from: https://doi.org/10.7860/JCDR/2013/6291.3755
-
8. Ayala FD y Col. Histopatología de endometrio en sangrado uterino en la postmenopausia. Instituto Nacional Materno Perinatal. Rev Per Investig Mater Perinat. 2015;4(1):22-5.
-
9. Espindola D, Kennedy K, Fischer E. Tratamiento de la hemorragia uterina anormal y patología de la hiperplasia endometrial. Clínicas Obstétricas y Ginecológicas de Norteamérica. USA, 2007. Elsevier Saunders. Págs.717-737.
-
10. Munro MG, Critchley HOD, Fraser IS. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years. Int J Gynaecol Obstet. 2018;143(3):393-408. Available from: https://doi.org/10.1002/ijgo.12666
-
11. Sweet MG, Schmidt-Dalton TA, Weiss PM, Madsen KP. Review. Evaluation and management of abnormal uterine bleeding in premenopausal women. Am Fam Physician. 2012 Jan 1;85(1):35-43.
-
12. Munro MG. Investigation of Women with Postmenopausal Uterine Bleeding: Clinical Practice Recommendations. Perm J. 2014 Winter;18(1):55-70. Available from: https://doi.org/10.7812/TPP/13-072
-
13. Talukdar B, Mahela S. Abnormal uterine bleeding in perimenopausal women: Correlation with sonographic findings and histopathological examination of hysterectomy specimens. J Midlife Health. 2016 Apr-Jun;7(2):73-7. Available from: https://doi.org/10.4103/0976-7800.185336
-
14. Renaud MC, Le T, SOGC-GOC-SCC policy and practice guidelines committee. Special contributors. Epidemiology and investigations for suspected endometrial cancer. J Obstet Gynaecol Can. 2013 Apr;35(4):380-1.
-
15. Goncharenko VM, Beniuk VA, Kalenska OV, Demchenko OM, Spivak MY, Bubnov RV. Predictive diagnosis of endometrial hyperplasia and personalized therapeutic strategy in women of fertile age. EPMA J. 2013 Dec 6;4(1):24-32.
-
16. Veena P, Baskaran D, Maurya DK, Kubera NC, Dorairaj J. Addition of power Doppler to grey scale transvaginal ultrasonography for improving the prediction of endometrial pathology in perimenopausal women with abnormal uterine bleeding. Indian J Med Res. 2018 Sep;148(3):302-8. Available from: https://doi.org/10.4103/ijmr.IJMR_96_1
-
17. Moradan S, Darzi S, Ghorbani R. Diagnostic value of saline infusion sonohysterography for detecting endometrial focal lesion. Pan Afr Med J. 2019;33:211. Available from: https://doi.org/10.11604/pamj.2019.33.211.16563
-
18. Moradan S, Ghorbani R, Lotfi A. Agreement of histopathological findings of uterine curettage and hysterectomy specimens in women with abnormal uterine bleeding. Saudi Med J. 2017 May;38(5):497-502. Available from: https://doi.org/10.15537/smj.2017.5.19368
-
19. National Institute for Health and Care Excellence Heavy menstrual bleeding: assessment and management. 04/05/2020. Available from: https://www.nice.org.uk/guidance/ng88/resources/heavy-menstrualbleeding-assessment-and-management-pdf-1837701412549.
-
20. van Dongen H, de Kroon CD, Jacobi CE, Trimbos JB, Jansen FW. Review. Diagnostic hysteroscopy in abnormal uterine bleeding: a systematic review and meta-analysis. BJOG. 2007 Jun;114(6):664-75.
-
21. Elfayomy AK, Habib FA, Elkablawy MA. Role of hysteroscopy in the detection of endometrial pathologies in women presenting with postmenopausal bleeding and thickened endometrium. Arch Gynecol Obstet. 2012 Mar;285(3):839-43.
-
22. Cochrane Database of Systematic. Reviews. Screening for breast cancer with mammography. Cochrane Systematic Review-Intervention Version published: 04 June 2013. Available from: https://www.cochranelibrary.com/search.
-
23. Khrouf M, Terras K. Review. Diagnosis and Management of Formerly Called «Dysfunctional Uterine Bleeding» According to PALMCOEIN FIGO Classification and the New Guidelines. J Obstet Gynaecol India. 2014 Dec;64(6):388-93.
-
24. Mendoza N, Sánchez-Borrego R, Cancelo MJ, Calvo A, Checa MA, Cortés J, Et al. Spanish Menopause Society, EMAS. Position of the Spanish Menopause Society regarding the management of perimenopause. Maturitas. 2013 Mar;74(3):283-90.
-
25. Ayala FD, Rodríguez MA, Izaguirre H, Ayala R, Quiñones Vásquez, Ayala D, et al. Sangrado uterino anormal en la postmenopausia: diagnóstico y manejo. Rev Peru Investig Matern Perinat. 2016;5(1):56-64.
-
26. Pérez LE. Menopausia. En: Pérez LE. infertilidad y endocrinología reproductiva. Cuarta edición. Bogotá: Brand Studio Ed; 2015. p. 513-537.
-
27. M. Wong, B. Crnobrnja, V. Liberale, K. Dharma rajah, M. Widschwendter, D. Jurkovic. The natural history of endometrial polyps. Human Reproduction. 2017;32:340- 5. Available from: https://doi.org/10.1093/humrep/dew307
-
28. Pontis A, D’Alterio M, Pirarba S, de Angelis C, Tinelli R, Angioni S. Adenomyosis: a systematic review of medical treatment. Gynecol Endocrinol. 2016;32:696-700.
-
29. Donnez J, Dolmans M. Uterine fibroid management: from the present to the future. Hum Reprod Update. 2016;22:665-86. Available from: https://doi.org/10.1093/humupd/dmw023
-
30. Florence A, Fatehi M. Leiomyoma. Updated: 2/13/2019. Available from: file:///Users/ luerpe/Documents/3.%20LIBRO%20de% 20GINECOLOGIA/Leiomyoma%20 Article% 20-%20StatPearls.html
-
31. Murji A, Whitaker L, Chow TL, Sobel ML. Selective progesterone receptor modulators (SPRMs) for uterine fibroids. Cochrane Systematic Review. 2017;4:1-94. Available from: https://doi.org/10.1002/14651858.CD010770.pub2
-
32. Keown A. FDA Rejects Allergan’s Uterine Fibroid Treatment Following EMA Concerns Over Liver Damage. Fecha de consulta: 03, mayo, 2020. Available from: https://www.biospace.com/article/fda-rejects-allergan-suterine-fibroid-treatment-following-emaconcerns-over-liver-damage/
-
33. Donnez J, Courtoy GE, Dolmans MM. Fibroid management in premenopausal women. Climacteric. 2019;22:27-33. Available from: https://doi.org/10.1080/13697137.2018.1549216
-
34. European medicines agency. PRAC Recommends New Measures to Minimise Risk of Rarebut Serious Liver Injury with Esmya for Fibroids. Fecha de consulta: 21, diciembre, 2019. Available from: https://www.ema.europa.eu/en/news/prac-recommends-newmeasures-minimise-risk-rare-serious-liverinjury-esmya-fibroids
-
35. Meunier L, Meszaros M, Pageaux GP, Delay JM, Herrero A, Pinzani V, et al. Acute liver failure requiring transplantation caused by ulipristal acetate. Clinics and Research in Hepatology and Gastroenterology. 2020; 44(3):e45-e49.Available from: https:// doi.org/10.1016/j.clinre.2020.02.008
-
36. Bradley LD, Singh SS, Simon J, Gemzell K, Petersdorf K, Groettrup E, et al. Vilaprisan in women with uterine fibroids: the randomized phase 2b asteroid 1 study. Fertility and Sterility. 2019;111:240-8. Available from: https://doi.org/.doi:10.1016/j.fertnstert.2018.10.012
-
37. Vitale S, Sapia F, Rapisarda A, Valenti G, Santangelo F, Rossetti F, et al. Hysteroscopic Morcellation of Submucous Myomas: A Systematic Review. Biomed Rest In. 2017; 2017:1-6. Available from: https://doi.org/10.1155/2017/6848250
-
38. Brower V. FDA considers restricting or banning laparoscopic morcellation. J Natl Cancer Inst. 2014;106:2-4. Available from: https://doi.org/.10.1093/jnci/dju339.
-
39. De Bruijn AM, Ankum WM, Reekers JA, Birnie E, van der Kooij SM, Volkers NA, et al. Uterine artery embolization vs hysterectomy in the treatment of symptomatic uterine fibroids: 10-year outcomes from the randomized EMMY trial. American Journal of Obstetrics and Gynecology. 2016;215: 745.e1-745.e12. Available from: https://doi.org/10.1016/j.ajog.2016.06.051
-
40. Imankulova B, Terzic M, Ukybassova T, Bapayeva G, Lesbekov T, Mustafinova G, et al. Repeated pulmonary embolism with cardiac arrest after uterine artery embolization for uterine arteriovenous malformation: A case report and literature review. Taiwan J Obstet Gynecol. 2018;57: 890-3. Available from: https://doi.org/10.1016/j.tjog.2018.10.021.
-
41. Clachar Hernández G. Hemorragia postmenopáusica. Revista Médica de Costa Rica y Centroamérica. 2015;LXXII(615):483-486.
-
42. Pennant ME, Mehta R, Moody P, Hackett P, Prentice A, Sharp SJ, et al. Premenopausal abnormal uterine bleeding and risk of endometrial cancer. BJOG. 2017 Feb;124(3): 404-11. Published online 2016 Oct 20. Available from: https://doi.org/10.1111/1471-0528.14385
-
43. Burbos N, Musonda P, Giarenis I, Shiner AM, Giamougiannis P, Morris E, Nieto JJ. Agerelated differential diagnosis of vaginal bleeding in postmenopausal women: a series of 3047 symptomatic postmenopausal women. Menopause Int. 2010 Mar;16(1):5-8.
-
44. Furness S, Roberts H, Marjoribanks J, Lethaby A, Hickey M, Farquhar C. Review Hormone therapy in postmenopausal women and risk of endometrial hyperplasia. Cochrane Database Syst Rev. 2009 Apr 15;(2):CD000402.
-
45. Raglan O, Kalliala L, Markozannes G, Cividini S, Gunter MJ, et al. Risk Factors for Endometrial Cancer: An Umbrella Review of the Literature. Review Int J Cancer. 2019 Oct 1;145(7):1719-30. Available from: https://doi.org/10.1002/ijc.31961
-
46. Duong LM, Wilson RJ, Ajani UA, Singh SD, Eheman CR. Trends in endometrial cancer incidence rates in the United States, 1999- 2006. J Womens Health (Larchmt). 2011 Aug;20(8):1157-63.
-
47. Chandra V, Kim J, Benbrook D, Dwivedi A, Rai R. Therapeutic options for management of endometrial hyperplasia. J Gynecol Oncol. 2016;27:1-25. Available from: https://doi.org/10.3802/jgo.2016.27.e8
-
48. Cochrane Database of Systematic. Reviews. Oral and intrauterine progestogens for atypical endometrial hyperplasia. Cochrane Systematic Review – Intervention Version published: 04 December 2018. Available from: https://www.cochranelibrary.com/search.
-
49. Hernández E, Zavala C, Quintana S, Reyes E. von Willebrand disease, molecular biology and diagnosis. Cirugía y Cirujanos. 2015;83: 255-64. Available from: https://doi.org/10.1016/j.circen.2015.09.024
-
50. Cochrane Database of Systematic. Reviews. Non-surgical interventions for treating heavy menstrual bleeding (menorrhagia) in women with bleeding disorders. Cochrane Systematic Review – Intervention Version published: 10 November 2016. Available from: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010338.pub3/full?highlightAbstract=abnorm%7Cabnormal%7Cbleeding%7Cuterin%7Cuterine%7Cbleed.
-
51. Pinkerton J. Sangrado uterino anormal debido a disfunción ovulatoria (SUA-O). Fecha de consulta: 25, marzo, 2020. Available from: https://www.msdmanuals.com/es/professional/ginecolog%C3%ADa-y-obstetricia/anomal%C3%ADas-menstruales/sangradouterino-anormal-debido-a-disfunci%C3% B3n-ovulatoria0-sua-o.
-
52. Lethaby A, Hussain M, Rishworth J, Rees M. Progesterone or progestogen-releasing intrauterine systems for heavy menstrual bleeding. Cochrane Database Syst Rev. 2015 Apr 30;(4):CD002126. Available from: https://doi.org/10.1002/14651858.CD002126.pub3
-
53. Kroft J, Liu G. First- versus second-generation endometrial ablation devices for treatment of menorrhagia: a systematic review, metaanalysis and appraisal of economic evaluations. J Obstet Gynaecol Can. 2013;35:1010-19. Available from: https://doi.org/10.1016/S1701-2163(15)30789-1
-
54. Nicula R, Costin N. Management of endometrial modifications in perimenopausal women. Clujul Med. 2015;88(2):101-10. Available from: https://doi.org/10.15386/cjmed-421
-
55. Moreno I, Cicinelli E, Garcia-Grau I, et al. The diagnosis of chronic endometritis in infertile asymptomatic women: a comparative study of histology, microbial cultures, hysteroscopy, and molecular micro- biology. Am J Obstet Gynecol. 2018;218(6):602.e1-16.
-
56. Piróg M, Kacalska-Janssen O, Bereza T, Jach R. Postmenopausal abnormal uterine bleeding with endometrial thickness less than 4 mm. Contemp Oncol (Pozn). 2019;23(1):43-6. Published online 2019 Apr 5. Available from: https://doi.org/10.5114/wo.2019.83816
-
57. Leotoing L, Chaize G, Fernandes S, Toth D, Descamps P, Dubernard G. The surgical treatment of idiopathic abnormal uterine bleeding: An analysis of 88 000 patients from the French exhaustive national hospital discharge database from 2009 to 2015. PloS One. 2019;14:1-13. Available from: https://doi.org/10.1371/journal.pone.0217579
-
58. ACOG. Committee on Gynecologic Practice. Management of Acute Abnormal Uterine Bleeding in Nonpregnant Reproductive-Aged Women. Reaffirmed 2017. Available from: https://www.acog.org/clinical/clinicalguidance/committee-opinion/articles/2013/04/management-of-acute-abnormal-uterinebleeding-in-nonpregnant-reproductive-agedwomen.
-
59. Malcolm G Munro, Perm J. Acute Uterine Bleeding Unrelated to Pregnancy: A Southern California Permanente Medical Group Practice Guideline 2013;17(3):43-56. Available from: https://doi.org/10.7812/TPP/13-018
-
60. Malcolm G Munro. Investigation of Women with Postmenopausal Uterine Bleeding: Clinical Practice Recommendations. Perm J. 2014 Winter;18(1):55-70. Available from: https://doi.org/10.7812/TPP/13-072.
-
61. Maybin J, Critchley H. Medical management of heavy menstrual bleeding. Womens Health. 2016;12:27-34. Available from: https://doi.org/.10.2217/whe.15.100
-
62. Ray S, Ray A. Non-surgical interventions for treating heavy menstrual bleeding (menorrhagia) in women with bleeding disorders. Cochrane Database Syst Rev. 2016;11:1-28. Available from: https://doi.org/10.1002/14651858.CD010338.pub3
-
63. Lukes AS, Moore KA, Muse KN, Gersten JK, Hecht BR, Edlund M, et al. Tranexamic acid treatment for heavy menstrual bleeding: a randomized controlled trial. Obstet Gynecol 2010;116:865-75.
-
64. Rodriguez MB, Lethaby A, Grigore M, Brown J, Hickey M, Farquhar C. Endometrial resection and ablation techniques for heavy menstrual bleeding. Cochrane Gynaecology and Fertility Group. Cochrane Database Syst Rev. 2019;(1):CD001501. Published online 2019 Jan 22. Available from: https://doi.org/10.1002/14651858.CD001501.pub5.