El perfil del estudio se muestra en la figura 1. Las características de base fueron similares en los dos grupos de población de ITT (tabla 1). La edad promedio fue de 52.7 años (DS 7.3) y el tiempo promedio desde la cirugía por cáncer de mama fue de 2.1 años (DS 1.3). 1487 de 3098 mujeres (48%) estaban entre 50 y 59 años de edad, 88 mujeres (3.8%) eran menores de 40 años y 43 mujeres (1.4%) tenían 70 años o más. El IMC promedio fue de 27 kg/m2 (DS 4.9). 2452 de 3098 mujeres (79.1%) eran blancas y 536 (17.3%) asiáticas. El estado del tumor era IIA o superior en 2170 de 3098 mujeres (70%) y los ganglios eran positivos (N1-2) en 1792 mujeres (57.8%). La cirugía había sido conservadora tan solo en 1323 de 3098 mujeres (42.7%). El estado de receptores de estrógenos fue positivo en 2185 mujeres (77.8%) de las 2808 en quienes se conocía el estado de los receptores. Al ingresar al estudio la mayoría de mujeres usaba tamoxifeno (n=2068 [66.8%]) y otras recibían inhibidores de aromatasa adyuvantes (n=202 [6.5%]), quimioterapia (n=150 [4.8%]) o análogos de GnRH (n=134 [4.3%]). Durante el tiempo del estudio, 464 de 2068 mujeres (22.4%) que recibían tamoxifeno fueron cambiadas a inhibidores de aromatasa (242 en el grupo de tibolona, 222 en el grupo placebo). El número promedio de oleadas de calor por día fue 6.4 globalmente (DS 5.1) y 12.5 (DS 4.8) en el subgrupo de la EMEA con quejas severas (tabla 1).
LIBERATE empezó a reclutar pacientes en junio de 2002 y terminó de manera prematura el 31 de julio de 2007. En marzo de 2007 el DSMB reportó una tendencia a mayor recurrencia de cáncer de mama en el grupo de tibolona. Ya que parecía muy poco probable que los criterios estadísticos predefinidos para no inferioridad aún pudiesen ser cumplidos, el comité asesor científico recomendó suspender la medicación y el patrocinador decidió terminar el estudio prematuramente.
Figura 1. Perfil del estudio.
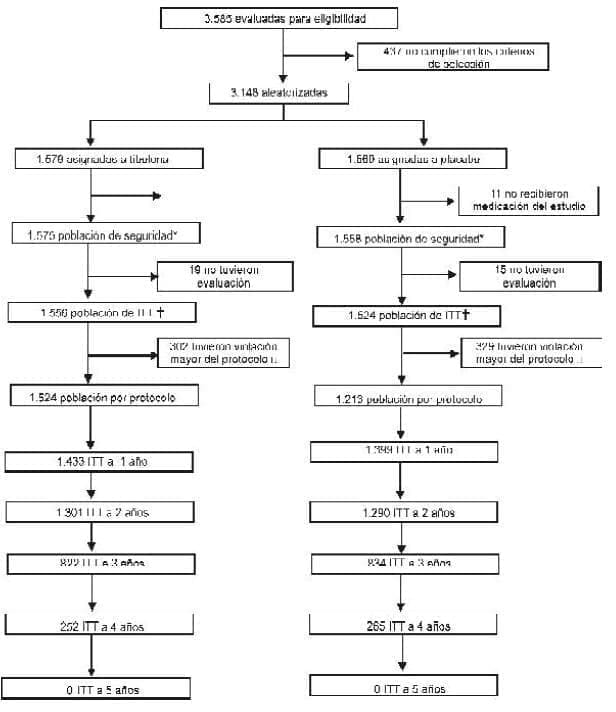
Razones para descontinuar hasta 5 años luego de la aleatorización incluyen aparición de recurrencia de cáncer de mama, mortalidad, eventos adversos serios, alivio insuficiente de los síntomas del climaterio, retiro del consentimiento informado y pérdida del seguimiento. * Población de todas las pacientes tratadas. † Evaluación del desenlace primario (recurrencia de cáncer de mama). Extensión de la exposición al medicamento del estudio <60% de la participación en el estudio, historia de otro cáncer de mama diferente a T1-3N0-2M0, presencia de recurrencia de cáncer de mama u otro tumor maligno o uso de comedicación hormonal (excepto crema vaginal de estriol).

GnRH – Hormona liberadora de gonadotropinas. *Uso en los 14 días antes de la línea de base o al iniciar de acuerdo a códigos definidos Anatómico Terapéutico Químico (ATC), algunas pacientes recibieron más de una droga.
La duración media de participación en el estudio fue 3.07 años (rango 0.01-4.99; 4666 mujeres-año en total) en el grupo tibolona y de 3.14 años (rango 0.01-4.94; 4633 mujeres-año en total) en el grupo placebo. La duración media del tratamiento fue de 2.74 años (rango 0.01- 4.79) para la tibolona y de 2.76 años (rango 0.01-4.72) para el grupo placebo, con un total de 3.901 y 3.874 mujeres-año de exposición a tibolona y placebo, respectivamente.
En la población de ITT, las recurrencias de cáncer de mama fueron reportadas y confirmadas por evaluación en 402 pacientes: 237 de 1556 mujeres (15.2%) en el grupo de tibolona y 165 de 1542 mujeres (10.7%) en el grupo placebo (HR 1.40 [IC 95% 1.14-1.70]; p = 0.001; tabla 2). En la población por protocolo los resultados fueron similares (209 de 1254 [16.7%] mujeres en el grupo de tibolona tuvieron una recurrencia frente a 138 de 1213 [11.4%] en el grupo placebo; HR 1.44 [IC 95% 1.16-1.79]; p = 0.0009). La mayoría de recurrencias en la población de ITT fueron metástasis a distancia (n = 292), 81 metástasis fueron locales y el número de tumores contralaterales detectados fue 42; 13 pacientes tuvieron recurrencia en más de un sitio. Los HRs para los diversos sitios fueron similares (tabla 2 y figura 2). El tratamiento con tibolona se asoció con un riesgo absoluto de 51 recurrencias de cáncer de mama por 1000 mujeres- año y el placebo con 36 recurrencias por 1000 mujeres-año. Como se esperaba, la incidencia global de recurrencias fue menor en pacientes con ganglios negativos comparadas con aquellas con ganglios positivos (5.6% [HR 1.85 (IC 95% 1.14-2.99; p = 0.013) frente a 18.4% [HR 1.36 (IC 95% 1.09-1.69; p = 0.006)], respectivamente; figuras 2 y 3). Las pacientes con tumores negativos para receptores de estrógenos no tuvieron incremento en el riesgo de recurrencia (HR 1.15 [IC 95% 0.73-1.80]; p = 0.058) en contraste con pacientes con tumores con receptores positivos para estrógenos (HR 1.56 [IC 95% 1.22-2.01]; p = 0.0005). Las usuarias de inhibidores de aromatasa tuvieron mayor riesgo de recurrencia que aquellas que recibían tamoxifeno (HR 2.42 [IC 95% 1.01- 5.79; p = 0.047] frente a HR 1.25 [IC 95% 0.98- 1.59; p = 0.047]). En el subgrupo de pacientes que no recibía tamoxifeno, inhibidores de aromatasa o análogos de GnRH al ingresar al estudio (26.7% de la población ITT; n = 827) la HR fue 1.73 (IC 95% 1.18-2.53); p = 0.005.
Los resultados para otros desenlaces de seguridad, analizados en toda la población tratada se muestran en las tablas 3 y 4. Durante el período del estudio 19 de 1575 mujeres tratadas (1.2%) murieron en el grupo tibolona frente a 20 de 1558 (1.3%) en el grupo placebo (HR 0.94 [IC 95% 0.50-1.76]; p = 0.844). Globalmente, incluyendo el período desde la visita individual al finalizar el estudio hasta el cierre de la base de datos del estudio, 72 de 1575 mujeres (4.6%) murieron en el grupo tibolona, comparadas con 63 de 1558 mujeres(4.0%) en el grupo placebo (HR 1.12 [IC 95% 0.80-1.57]; p = 0.509). De éstas, 54 (75%) y 49 mujeres (78%), respectivamente habían sido diagnosticadas con recurrencia del cáncer de mama antes de la muerte. Las causas restantes de muerte fueron predominantemente cardiovasculares.

* Tibolona comparada con placebo. † Prueba de Wald en el modelo de Cox estratificado por país para la hipótesis nula de no diferencia en el tratamiento. ∫ 402 pacientes fueron reportadas con recurrencias de cáncer de mama, de las cuales 13 tuvieron recurrencia en más de un sitio.
Figura 2. Probabilidad acumulada de recurrencia de cáncer de mama frente a tiempo en la población ITT.

No se detectaron diferencias clínicamente significativas entre los grupos durante el período de tratamiento con respecto a la incidencia de eventos adversos (tabla 4), eventos adversos serios y la incidencia de eventos adversos que condujeran a suspender el medicamento del estudio. Eventos adversos ocurrieron en 1.342 de 1.575 pacientes (85.2%) en el grupo tibolona comparadas con 1.285 de 1.558 pacientes (82.5%) en el grupo placebo; eventos adversos serios se presentaron en 323 de 1.575 pacientes (20.5%) en el grupo tibolona frente a 297 de 1.558 pacientes (19.1%) en el grupo placebo y descontinuaciones se dieron en 127 pacientes (8.1%) frente a 112 pacientes (7.2%), respectivamente. Los principales eventos adversos serios fueron trastornos del sistema reproductivo y de la mama (77 pacientes [4.9%] en el grupo tibolona, 47 [3.0%] en el grupo placebo); los eventos adversos más comunes que llevaron a suspensión del tratamiento también fueron desórdenes del sistema reproductivo y la mama (22 pacientes [1.4%] en el grupo tibolona, 13 [0.8%] en el grupo placebo). El número de mujeres con eventos adversos juzgados por el investigador como posible, probable o definitivamente relacionados con la medicación del estudio fue 437 de 1.575 (27.7%) en el grupo tibolona y 340 de 1.558 (21.8%) en el grupo placebo (p = 0.0002). Una fractura clínica fue reportada como evento adverso durante el período del estudio en 60 de 1575 mujeres (3.8%) en el grupo tibolona frente a 77 de 1.558 (4.9%) en el grupo placebo (p = 0.137); de éstas las más notadas fueron en la muñeca (tabla 3).
Durante el tiempo de tratamiento, sangrado, manchado o ambos, fueron reportados en 208 de 1.575 mujeres (13.2%) en el grupo tibolona frente a 127 de 1.558 mujeres (8.2%) en el grupo placebo. Un adenocarcinoma de endometrio confirmado fue diagnosticado durante en período del estudio en siete de 1575 mujeres (0.4%) en el grupo tibolona comparadas con cuatro de 1.558 mujeres (0.3%) en el grupo placebo. Nueve de estas once mujeres habían usado tamoxifeno por varios años antes o al momento del diagnóstico del cáncer uterino. Biopsias de endometrio fueron tomadas 1.8 veces más frecuente durante el tiempo del estudio en el grupo de tibolona (n = 249) comparado con el grupo placebo (n = 141).
Con base en el registro diario, la diferencia en el número medio de oleadas de calor por día estuvo significativamente a favor de la tibolona en la semana 4 (p = 0.004), semana 8 (p < 0.0001) y semana 12 (p < 0.0001) (figura 4). En el grupo altamente sintomático de acuerdo a las guías de la EMEA, la tibolona produjo reducciones mayores en el número medio de oleadas de calor por día desde la línea de base comparada con placebo hasta la semana 8 (p = 0.002) y semana 12 (p < 0.0001; figura 4). A la semana 12 el cambio medio desde la línea de base para el promedio del número de oleadas de calor fue de -5.4 (DS 4.7) en el grupo tibolona comparado con -3.2 (3.4) en el grupo placebo (p < 0.0001). Evaluadas a lo largo del estudio por el uso de la Forma de Síntomas Climatéricos, el grupo tibolona mostró una reducción significativamente mayor desde la línea de base que lo que hizo el placebo en todas las valoraciones (p < 0.0001; figura 4).
Tabla 3. Principales desenlaces de seguridad en la población de todas las pacientes tratadas.

Figura 3. Gráficas de razones de riesgo para recurrencias de cáncer de mama para tibolona comparada con placebo en la población ITT.

Continuación Figura 3. Gráficas de razones de riesgo para recurrencias de cáncer de mama para tibolona comparada con placebo en la población ITT.

Los valores de p se han calculado de la prueba de Wald en el modelo de Cox. * peor situación posible. † Uso reciente hace referencia tan solo al momento del ingreso (14 días antes o al momento del ingreso) de acuerdo a los códigos de ATC; alguna vez usuarias se refiere a uso antes del estudio.
Tabla 4. Eventos adversos durante el tratamiento con una incidencia > 2% en la población de todas las pacientes tratadas.

Continuación Tabla 4.

Los datos están organizados de acuerdo a la clase de órganos y término preferidos del Diccionario Médico para Actividades Regulatorias (MedDRA). * Considerada como relacionada con el tratamiento por el investigador en 134 pacientes (8.5%) en tratamiento con tibolona y en 62 pacientes con placebo. † Considerada como relacionada con el tratamiento por el investigador en 71 pacientes (4.5%) en tratamiento con tibolona y en 50 pacientes (3.2%) con placebo. ∫ Reportada como un evento adverso serio en 26 pacientes (1.7%) en tratamiento con tibolona y en 31 pacientes (2.0%) con placebo.
Figura 4. Cambio en el número de oleadas de calor en el tiempo en la población de ITT

Porcentaje de cambio en el número de oleadas de calor por día desde la línea de base y el IC 95% de la media. * Número de oleadas de calor registradas a lo largo del período del estudio (n=3098). † Subgrupo de la Agencia Europea para la Evaluación de Productos Medicinales (EMEA) con por lo menos cinco oleadas de calor moderadas o severas por día en la línea de base (n=660); número de oleadas de calor tomadas de las tarjetas de diario registradas durante 12 semanas.
En las mujeres que tuvieron evaluación de la densidad ósea, se observó aumento en la DMO desde la línea de base de 3.3% en la columna lumbar y de 2.9% en el fémur en el grupo de tibolona (ambos p < 0.0001) comparado con el grupo placebo. La calificación de WHQ mostró una mejoría clínicamente relevante en los dominios de comportamiento sexual, trastornos del sueño y síntomas vasomotores (datos no mostrados).
