Los sulfatos de estrógenos son cuantitativamente una de las formas más importantes de estrógenos circulantes. Concentraciones elevadas de estos conjugados se encuentran en los compartimientos fetales y maternos de los humanos y de varias especies animales22. Durante el ciclo menstrual y en la mujer posmenopáusica, los niveles de sulfato de estrona (SE1) son cinco a diez veces aquellos de los estrógenos no conjugados (estrona, estradiol y estriol)23,24.
La mayoría de autores concuerda en que los niveles plasmáticos de estrona (E1) y E2 no conjugados son similares en mujeres normales y en pacientes de cáncer de seno, tanto antes como después de la menopausia. Sin embargo el nivel de SE1 es significativamente mayor en la fase folicular de las pacientes premenopáusicas con cáncer de seno respecto a mujeres normales25 .
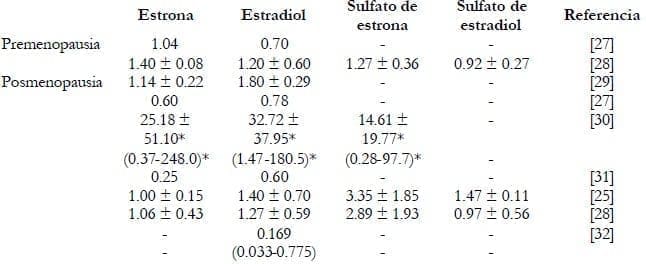
Los tejidos de cáncer mamario tienen una gran capacidad de acumular varios estrógenos, particularmente en mujeres posmenopáusicas, Además, estudios comparativos indican que los niveles de estrógeno en los tejidos de cáncer son significativamente más altos que en el área del seno considerado como normal26. La Tabla 3 muestra las concentraciones tisulares de varios estrógenos en pacientes pre y postmenopáusicas con cáncer de seno27, 32.
Enzimas comprometidas en la formación y la transformación de los estrógenos en el tejido mamario y su control por progestinas
Diferentes estudios en varios laboratorios han establecido claramente que los tejidos mamarios tienen la capacidad de bioformación local de estrógenos a partir de precursores circulantes.
Dos vías principales están implicadas en los pasos finales de la formación de E2 en los tejidos de cáncer mamario: la ‘vía de la aromatasa’ que transforma andrógenos en estrógenos33-35 y, la ‘vía de la sulfatasa’, que convierte SE1 en E1 a través de la sulfatasa de estrona (EC: 3.1.6.2)36, 40.
El paso final de la esteroidogénesis es la conversión de la débil E1 en el potente y activo biológicamente E2 por la acción reductora de la 17ß-hidroxiesteroide deshidrogenasa tipo 1 (EC: 1.1.1.62)41, 42. La evaluación cuantitativa indica que en tumores mamarios humanos el SE1 por ‘vía de la sulfatasa’ es mucho más probable como precursor para el E2 que los andrógenos ‘vía aromatasa’25,43.
Tabla 3. Concentraciones de estrógenos no conjugados y sus sulfatos en
tejidos mamarios malignos (pmol/g tejido).
También está bien establecido que las sulfotransferasas de esteroides, que convierten a los estrógenos en sus sulfatos, se encuentran presentes en los tejidos de cáncer mamario44,45. La Figura 2 da una visión general de la formación y la transformación de los estrógenos en el cáncer de seno humano.
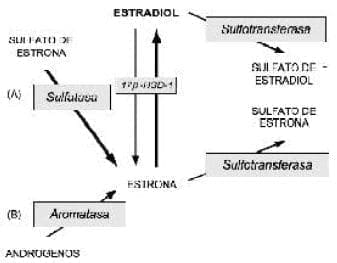
Figura 2. Mecanismo enzimático comprometido en la formación y la transformación de los estrógenos en el cáncer mamario humano; la vía de la sulfatasa (A) es cuantitativamente 100-500 veces mayor que la vía de la aromatasa (B) (17ß-HSD-1, 17ß-hidroxiesteroide deshidrogenasa tipo 1).
Efecto de las progestinas en la actividad de la sulfatasa de estrona
La actividad de la sulfatasa de estrona en los tumores mamarios es significativamente mayor en mujeres posmenopáusicas que en premenopáusicas y su actividad se incrementa en el sitio del tumor comparada con el área que lo rodea o en áreas consideradas como ‘normales’25,26. No se ha encontrado ninguna correlación entre los niveles de actividad de la sulfatasa y el estado de RE46,47.
Sin embargo, en cultivos de células intactas de cáncer de seno, existe una marcada diferencia en la actividad de la sulfatasa entre células hormonodependientes (MCF-7, T-47D) y hormono-independientes (MDA-MB-231, MDA-MB-468).
Mientras las primeras poseen gran actividad, las últimas tienen poco efecto sobre la hidrólisis del SE1 28,48. Pero cuando estas células hormono-independientes son expuestas a hormonas, la actividad de la sulfatasa es restaurada49,50. Los datos respecto al mecanismo comprometido en la hidrólisis del sulfato sugieren que ‘factores estimuladores’ necesarios para actividad de la enzima están presentes en las células hormonodependientes y posiblemente están ausentes en las células hormono-independientes.
Actividad de la sulfatasa en el cáncer de seno
El efecto de las progestinas en la actividad de la sulfatasa en el cáncer de seno ha sido explorado hasta la fecha tan solo en estudios in vitro. En tumores mamarios, progestinas tales como demegestona o acetato de clormadinona en concentraciones de 10-5 M inhiben la actividad de la sulfatasa en 25 a 50%51,52. Otras progestinas como el acetato de medroxiprogesterona (MPA) y el norgestrel, en la misma concentración, estimulan moderadamente la actividad52.
En células de cáncer de seno (MCF-7, T-47D), la promegestona, el acetato de nomegestrol, la medrogestona y la noretisterona, así como el danazol, en un rango de concentraciones que oscilan en 5 x 10-7 y 5 x 10-6 M, disminuyen la actividad de la sulfatasa entre 40 y 70%53-58. La tibolona y sus metabolitos (Org 4094, Org 30126, Org OM38) en dosis bajas (5 x 10-8 M) son agentes anti-sulfatasa muy potentes ya que inhiben la actividad de esta enzima en 80 a 90% en las mismas líneas celulares59. R-5020 es un inhibidor competitivo de la enzima sulfatasa en homogenizados de células de cáncer de seno (MCF- 7, T-47D)60.
Esta progestina también puede reducir la expresión de ARNm de la sulfatasa en ambas células, un efecto que se correlaciona con reducción en la actividad enzimática61. También se ha demostrado que la didrogesterona (Duphaston®) y sus derivados 20-dihidro son inhibidores potentes de la sulfatasa de estrona en células de cáncer de seno MCF-7 y T-47D62. La actividad inhibitoria relativa de las progestinas y la tibolona y sus metabolitos se muestra en la Tabla 455,59,63-65.
Tabla 4. Efecto comparativo de varias progestinas, tibolona y sus metabolitos y estradiol sobre la inhibición de la sulfatasa de estrona en células de cáncer de seno T-47D55,59,63-65.

Las progestinas también pueden bloquear la actividad de la sulfatasa en tejidos mamarios totales. Se ha demostrado que el acetato de nomegestrol a 5 x 10-7 M puede inhibir la actividad de la sulfatasa (conversión de SE1 a E2) en 23% en el tejido mamario normal y 32% en el tejido de cáncer66.
En un estudio interesante, Miyoshi y sus colegas67 sugirieron que los niveles de ARNm de la sulfatasa pueden servir como un factor pronóstico independiente en cáncer de seno RE – positivo y que niveles más altos de esta enzima se asocian con peor pronóstico.
Efectos de las progestinas en la actividad de la 17ß-hidroxiesteroide deshidrogenada
La 17ß-hidroxiesteroide deshidrogenada (17ß-HSD)es la enzima que interconvierte los 17-oxo y los 17ß-hidroxi esteroides. Hasta el momento se han caracterizado 14 tipos de esta enzima. En células mamarias, las más importantes con respecto a los estrógenos son la 17ß- HSD tipo 1, que convierte E1 en E2 y la 17ß-HSD tipo 2 que transforma E2 en E1.
En células epiteliales del seno normal, la progestina promegestona ha mostrado que incrementa la actividad de la 17ß-HSD en la dirección oxidativa (E2 a E1) (tipo 2). Este efecto estimulador de las progestinas depende de la sensibilización primaria por los estrógenos68,69.
Las progestinas pueden inducir la actividad de la 17ß-HSD tipo 1, con un aumento tanto en las especies de ARNm de 1.3-kb como de proteína de la enzima, en las células hormono-dependientes T-47D de cáncer de seno70,77. Coldham y James72 encontraron que la MPA estimulaba la actividad reductiva (E1 a E2) de las células MCF-7 cuando el rojo fenol era excluido del medio de cultivo tisular.
Ellos sugirieron que esta podía ser la vía por la cual las progestinas incrementan la proliferación celular in vivo. Por otro lado, Couture y sus asociados73 observaron que cuando las células de cáncer de seno hormono-dependientes ZR-75-1 eran incubadas con MPA, la vía oxidativa (E2 a E1) era la predominante; este efecto parece implicar el receptor de andrógenos.
Otras progestinas, como progesterona, levonorgestrel y noretisterona, aumentaron tanto la actividad oxidativa como reductiva de la 17ß-HSD en células MCF-774 mientras que la promegestona no tuvo efecto significativo sobre la actividad reductiva de la 17ß-HSD75 pero aumentó la oxidativa (E2 a E1) en células T-47D76 .
Efecto de las progestinas en la actividad de la sulfotransferasa
Estudios comparativos sobre la formación de sulfatos de estrógeno luego de la incubación de E1 con células de cáncer de seno hormono-dependientes (MCF-7, T-47D) y hormono-independientes (MDA-MB231) muestran sulfotransferasas más altas en las primeras77,78.
La medrogesterona es un derivado preengaño sintético usado en el tratamiento de la deficiencia patológica de la progesterona natural. Tiene actividad secretora en el endometrio previamente estimulado por estrógenos, es termogénica y actúa como antiestrógeno y anti-gonadotropinas.
Su efecto sobre la actividad de la sulfotransferasa en células de cáncer de seno MCF-7 y T-47D es bifásico: en bajas concentraciones (5 x 10-8 M) estimula la formación de sulfatos de estrógeno en ambas líneas celulares, mientras que en una concentración mayor (5 x 10-5 M) la actividad de la sulfotransferasa no sufre modificación en las células MCF-7 y se inhibe en las T-47D79. Un efecto dual similar sobre la sulfotransferasa fue observado con las progestinas acetato de nomegestrol y promegestona78,80 (Tabla 5).
Los efectos en la actividad de sulfotransferasa de la tibolona y sus metabolitos
Los efectos en la actividad de sulfotransferasa de la tibolona y sus metabolitos 3ß-hidroxitibolona (Org 4094), 3ß-hidroxitibolona (Org 30126) y el isómero 4-ene (Org OM 38) se han evaluado en las células de cáncer de seno MCF- 7 y T-47D. Estos compuestos también conducen a un efecto dual sobre la actividad de la sulfotransferasa: estimulador en dosis bajas (5 x 10-8 M) pero inhibidor en dosis mayores (5 x 10-5 M).
El derivado 3ß-hidroxi es el compuesto más potente respecto a los efectos estimuladores sobre las sulfotransferasas77. La tabla 5 muestra los efectos comparativos de varias progestinas, así como aquel de la tibolona y sus metabolitos sobre la actividad de la sulfotransferasa en las células de cáncer de seno T-47D77-81.
Ya que algunas progestinas, así como la tibolona, pueden estimular la actividad de sulfotransferasa, y que estos compuestos pueden inhibir el crecimiento de células de cáncer de seno o el tamaño de tumores transplantados, surgió la hipótesis de que existe una correlación entre la proliferación celular y la actividad de sulfotransferasa82,83.
Usando la amplificación de la reacción en cadena de la polimerasa – transcriptasa reversa, se detectó la expresión de ARNm de sulfotransferasa de estrógenos en células humanas de cáncer de seno hormonodependientes MCF-7 y T-47D, así como hormono-independientes MDA-MB-231 y MDA-MD-468.
Una correlación interesante con la expresión relativa del ARNm de la sulfotransferasa tipo 1 se encontró en varias de las células de cáncer de seno estudiadas78.
Estudio sobre los efectos de la promegestona
Un estudio sobre los efectos de la promegestona en la actividad de la sulfotransferasa humana de estrógenos tipo 1 y su ARNm en las células MCF-7 y T-47D mostró que en dosis bajas, había un incremento significativo en los niveles de ARNm, lo que se correlacionaba con actividad de la enzima.
Sin embargo, en dosis mayores se observó un efecto inhibitorio sobre el ARNm y la actividad de la enzima78. Falany y sus colaboradores84 sugirieron que la pérdida de la expresión de la sulfotransferasa de estrógenos en la transformación de un tejido mamario normal hacia un cáncer de seno puede ser un factor importante para aumentar la respuesta de crecimiento de células preneoplásicas al estímulo estrogénico.
Efecto de las progestinas en la actividad de la aromatasa
Aunque los niveles de actividad de la aromatasa son relativamente bajos en el tejido mamario normal o canceroso36,43, esta producción local de estrógenos ‘en el sitio’ puede contribuir a la patogénesis de tumores de seno estrógeno-dependientes.
El papel de las progestinas sobre la actividad de la aromatasa en el seno es muy limitado. Perel y colaboradores85 observaron que las progestinas pueden inhibir la actividad de la aromatasa en cultivos de células de carcinoma de seno. En otra serie de estudios se demostró que el acetato de nomegestrol puede inhibir la actividad de la aromatasa en células de cáncer de seno86.
Tabla 5. Efecto comparativo de varias progestinas, tibolona y sus metabolitos y estradiol sobre la
actividad de la sulfotransferasa en células de cáncer de seno T-47D77,81.

Las células T-47D fueron incubadas con concentraciones fisiológicas de [3H] sulfato de estrona (5 x 10-9 M) con o sin adición de varios compuestos (5 x 10-7 M). El valor del control para la conversión de sulfato de estrona a estrona se consideró ser de 100%
La inhibición de esta enzima con agentes anti-aromatasa es ampliamente utilizada, con resultados muy positivos, en el tratamiento de pacientes con cáncer de seno87-90.
Estos inhibidores incluyen compuestos esteroideos y no esteroideos, siendo los más útiles 4-hidroxiandrostenediona, anastrazole (Arimidex®), examestane (Aromasin®) y letrozole (Femara®). Una serie de revisiones ha sido publicada recientemente sobre los efectos biológicos y las aplicaciones clínicas de estas anti-aromatasas91-93.
Efecto de las progestinas en el cáncer de seno: consecuencias clínicas
El uso de progestinas solas o en combinación con estrógenos en terapia de reemplazo hormonal (TRH) es controversial. En una serie de estudios en los que se evaluó el efecto del MPA o el acetato de noretisterona en un gran número de mujeres, un aumento significativo en la incidencia de cáncer de seno fue observado94-96.
Sin embargo, en otro estudio reciente97 en 10.000 pacientes japonesas se mostró que la TRH puede disminuir el riesgo relativo de cáncer de seno.
El Estudio del Millón de Mujeres tuvo múltiples errores, suficientes para hacer surgir dudas respecto al cuidado con el que se llevó a cabo y la forma como fue revisado. Shapiro98 concluyó que no es posible distinguir entre sesgos y causas como explicaciones alternas para las asociaciones observadas y la conclusión de este estudio, que la TRH aumenta el riesgo de cáncer de seno, no es justificada.
Algunos aspectos sobre la relación entre la TRH y el tipo de tumor permanecen sin ser clarificados. Se ha observado que la incidencia de cáncer de seno en pacientes RE-positivos era mayor que en pacientes RE-negativos 99 .
Además se ha sugerido que la TRH aumenta la incidencia de carcinoma lobular más que la de carcinoma ductal100.
Otro aspecto importante es el efecto de las progestinas sobre la proliferación mamaria y, como se ha indicado previamente, estos datos también son controversiales ya que las diversas progestinas pueden bloquear, estimular o no tener ningún efecto sobre el crecimiento de las células.
Conclusiones
Algunos estudios muestran que la TRH puede aumentar el riesgo relativo de cáncer de seno; sin embargo, es notable que muy pocas progestinas han sido evaluadas. Como se mencionó previamente, es importante entender que no todas las progestinas son similares en estructura y función biológica. El Estudio del Millón de Mujeres, que ha tenido un impacto drástico en el tratamiento de mujeres posmenopáusicas usando progestinas, ha provocado una serie de comentarios que suscitaron críticas serias e importantes.
Heikkinen101 consideró que un incremento leve aparente en el riesgo de cáncer de seno con la terapia hormonal combinada debe balancearse contra la reducción en la morbilidad y mortalidad significativas asociadas con fracturas, así como la mejoría en el bienestar, la calidad de vida y la protección potencial contra el cáncer colorrectal y la enfermedad cardiovascular.
Una propiedad interesante de las progestinas es su acción sobre las enzimas involucradas en la formación y la transformación de estrógenos, como se describió anteriormente en la sección sobre progestinas y proliferación de cáncer de seno.
Una serie de estudios ha mostrado que varias progestinas pueden tener un efecto benéfico al bloquear la sulfatasa y la 17ß-HSD tipo 1 (las principales enzimas comprometidas en la biosíntesis de estradiol en células de cáncer de seno o tejido total). Estas progestinas pueden también estimular la sulfotransferasa que transforma estrógenos en sulfatos inactivos.
Otro aspecto para considerar es la transformación metabólica de la progesterona y las progestinas.
A este respecto es interesante anotar que la conversión de progesterona a 5ßpregnanos se aumenta, mientras que la conversión a 4-pregnanos disminuye en tejido de carcinoma de seno. El 5ß-pregnano 5ßpregnano- 3,20-diona estimula la proliferación celular, mientras que el 4-pregnano 3ß-hidroxi- 4-pregnen-20-ona lo inhibe102.
En el seno y otros tejidos, E2 y E1 son transformados en derivados hidroxilados: el metabolito 2-hidroxi es considerado como un agente anti-proliferativo mientras que el 4- hidroxi es una sustancia carcinogénica103-106. La Figura 3 resume estas transformaciones metabólicas en el cáncer de seno.
En conclusión, ya que los hallazgos con referencia a la TRH y la incidencia de cáncer de seno son contradictorios, se requiere mayor información sobre nuevas rutas de administración y nuevos regímenes (dosis y período de administración) de manera tal que se pueda evaluar el impacto de la TRH sobre el riesgo y la mortalidad por cáncer de seno.
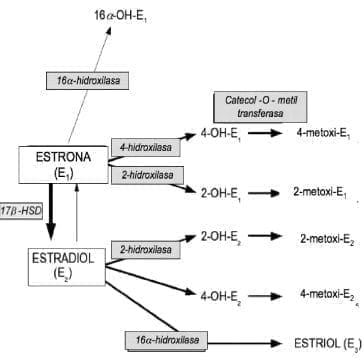
Figura 3. Vías hidroxilo de los estrógenos en el cáncer de seno humano (2-OH-E, 2-hidroxiestrona; 2-OH-E, 2-hidroxiestradiol; 4-OH-E, 4-hidroxiestrona; 4-OH-E, 4-hidroxiestradio; 16-OH-E1, 16-hidroxiestrona; 17ß-HSD, 17ßhidroxiesteroide deshidrogenasa).
Referencias
- 1. Schindler AE, Campagnoli C, Druckmann R, Huber J, Pasqualini JR, Schweppe H-W, Thijssen JHH. Progestins: present and future. J Steroid Biochem Mol Biol 1996; 59: 357-363.
- 2. Pasqualini JR, Paris J, Sitruk-Ware R, Chetrite G, Botella J. Progestins and breast cancer. J Steroid Biochem Mol Biol 1998; 65: 225-235.
3. Rozenbaum H. Les progestatifs. Paris: ESKA; 2002. - 4. Sitruk-Ware R, Michelle R, editors. Progestins and antiprogestins in clinical practice. New York: Marcel Decker; 2000.
- 5. De Lignie’res B, Dennerstein L, Backstrom T. Influence of route of administration on progesterone metabolism. Maturitas 1995; 21: 251-257.
- 6. Neumann F, Duesterberg D. Entwicklung auf dem Gebiet der Gestagen. Reproduktionsmedizin 1998; 14: 257-264.
- 7. Kuhl H. Pharmacology of progestins. Basic aspects – progesterone derivatives. Menopause Rev 2001; VI: 9-16.
- 8. Kirschner MA. The role of hormones in the development of human breast cancer. In: McGuire WL, editor. Current topics: Breast cancer. Vol. 3, Advances in research and treatment. New York: Plenum; 1979. pp 199-226.
- 9. Lippman ME, Dickson RB, Bates S, Knabbe K, Huff S, Swain Y, McManaway M, Bronzert D, Kasid A, Gelmann EP. Auto and paracrine growth regulation of human breast cancer. Breast Cancer Res Treat 1986; 7: 59-70.
- 10. Henderson BE, Ross R, Bernstein L. Estrogens as a cause of human cancer: the Richard and Hinda Rosenthal Foundation Award Lecture. Cancer Res 1988; 48: 246-253.
Otras Referencias
- 11. Raam S, Robert N, Pappas CA, Tamura H. Defective estrogen receptors in human mammary cancers: their significance in defining hormone dependence. J Natl Cancer Inst 1988; 80: 756-761.
- 12. Fuqua SAW, Fitzgerald SD, Chamness GC, Tandon AK, McDonnell DP, Nawaz Z, O’Malley BW, McGuire WL. Variant humanbreast tumor estrogen receptor with constitutive transcriptional activity. Cancer Res 1991; 51: 105-109.
- 13. McGuire WL, Chamness GC, Fuqua SAW. Abnormal estrogen receptor in clinical breast cancer. J Steroid Biochem Mol Biol 1992; 43: 243-247.
- 14. Castles CG, Fuqua SAW, Klotz DM, Hill SM. Expression of a constitutively active estrogen receptor variant in the estrogen receptornegative BT-20 human breast cancer cell line. Cancer Res 1993; 53: 5934-5939.
- 15. Edwards DP, Chamness GC, McGuire WL. Estrogen and progesterone receptors in breast cancer. Biochem Biophys Acta 1979; 560: 457- 486.
- 16. Litherland JS, Jackson IM. Antiestrogens in the management of hormone-dependent cancer. Cancer Treat Rev 1988; 15: 183-194.
- 17. Russo J, Russo IH. Mechanism involved in carcinogenesis of breast. In: Pasqualini JR, editor. Breast cancer prognosis, treatment and prevention. New York, Basel: Marcel Dekker Inc.; 2002. pp 1-18.
- 18. Bove BA, Dunbrack RL Jr, Godwin AK. BRCA1, BRCA2, and hereditary breast cancer. In: Pasqualini JR, editor. Breast cancer prognosis,
treatment and prevention. New York, Basel: Marcel Dekker Inc.; 2002. pp 555-624. - 19. Lage JM, Leamon JH, Pejovic T, Hamann S, Lacey M, Dillon D, Segraves R. Whole genome analysis of genetic alterations in small DNA samples using hyperbranched stand displacement amplification and array-CGH. Genome Res 2003; 13: 294-307.
- 20. Emmert-Buck MR, Bonner RF, Smith PD, Chauqui RS, Zuang Z, Golstein SR, Weiss RA, Liotta LA. Laser capture microdissection. Science 2001; 274: 998-1001.
Bibliogafías
- 21. Ma XJ, Salunga R, Tuggle JT, Gaudet J, Enright E, McQuary P, Payette T, Pistone M, Stecker K, Zhang BM, et al. Gene expression profiles of human breast cancer progression. Proc Natl Acad Sci U S A 2003; 100: 5974- 5979.
- 22. Pasqualini JR, Kincl F. Hormones and the fetus. Vol. I. Oxford: Pergamon; 1985. pp 173-334.
- 23. Hawkins RA, Oakey RE. Estimation of oestrone sulphate, oestradiol-17ß and oestrone in peripheral plasma: concentrations during the menstrual cycle and in man. J Endocrinol 1974; 60: 1-17.
- 24. Roberts KD, Rochefort JG, Bleau G, Chapdelaine A. Plasma estrone sulfate levels in postmenopausal women. Steroids 1980; 35: 179-187.
- 25. Pasqualini JR, Chetrite G, Blacker C, Feinstein M-C, Delalonde L, Talbi M, Maloche C. Concentrations of estrone, estradiol, and estrone sulfate and evaluation of sulfatase and aromatase activities in pre- and postmenopausal breast cancer. J Clin Endocrinol Metab 1996; 81: 1460-1464.
- 26. Chetrite G, Cortes-Prieto J, Philippe JC, Wright F, Pasqualini JR. Comparison of estrogen concentrations, estrone sulfatase and aromatase activities in normal, and in cancerous, human breast tissues. J Steroid Biochem Mol Biol 2000; 72: 23-27.
- 27. van Landeghem AAJ, Poortman J, Nabuurs M, Thijssen JHH. Endogenous concentration and subcellular distribution of estrogens in normal and malignant human breast tissue. Cancer Res 1985; 45: 2900-2906.
- 28. Pasqualini JR, Chetrite G, Nguyen B-L, Blacker C, Feinstein M-C, Maloche C, Talbi M, Delalonde L. Control of estrone sulfatase activity and its expression in human breast cancer. In: Motta M, Serio M, editors. International Congress Series. Vol. 1064, Sex hormones and antihormones in endocrine dependent pathology: Basic and clinical aspects. Amsterdam: Excerpta Medica; 1994. pp 257-265.
Otras Bibliogafías
- 29. Reed MJ, Cheng RW, Noel CT, Dudley HAF, James VHT. Plasma levels of estrone, estrone sulfate, and estradiol and the percentage of unbound estradiol in postmenopausal women with and without breast disease. Cancer Res 1983; 43: 3940-3943.
- 30. Vermeulen A, Deslypere JP, Paridaens R, Leclercq G, Roy F, Heuson JC. Aromatase, 17ß-hydroxysteroid dehydrogenase and intratissular sex hormone concentrations in cancerous and normal glandular breast tissue in postmenopausal women. Eur J Cancer Clin Oncol 1986; 22: 515-525.
- 31. Thijssen JHH, Blankenstein MA. Endogenous oestrogens and androgens in normal and malignant endometrial and mammary tissues. Eur J Cancer Clin Oncol 1989; 25: 1953-1959.
- 32. Recchione C, Venturelli E, Manzari A, Cavalleeri A, Martinetti A, Secreto G. Testosterone, dihydrotestosterone and oestradiol levels in postmenopausal breast cancer tissues. J Steroid Biochem Mol Biol 1995; 52: 541-546.
- 33. Abul-Hajj J, Iverson R, Kiang DT. Aromatization of androgens by human breast cancer. Steroids 1979; 33: 205-222.
- 34. Lipton A, Santner SJ, Santen RJ, Harvey HA, Feil PD, White-Hershey D, Bartholomew MJ, Antle CE. Aromatasa activity in primary and metastatic human breast cancer. Cancer 1987; 59: 779-782.
- 35. Bhatnagar AS, Batzl C, Haüsler A, Schielweck K, Lang M, Trunet PF. Pharmacology of nonsteroidal aromatase inhibitors. In: Katznellenbogen JR, Katznellenbogen BS, editors. Hormone-dependent cancer. New York: Marcel Dekker; 1996. pp. 115-168.
- 36. Dao TL, Hayes C, Libby PR. Steroid sulfatase activities in human breast tumors. Proc Soc Exp Biol Med 1974; 146: 381-384.
- 37. Vignon JF, Terqui M, Westley B, Derocq D, Rochefort H. Effects of plasma estrogen sulfates in mammary cancer cells. Endocrinology 1980; 106: 1079-1086.
Lecturas Recomendadas
- 38. Pasqualini JR, Gelly C, Lecerf F. Estrogen sulfates: biological and ultrastructural responses and metabolism in MCF-7 human breast cancer cells. Breast Cancer Res Treat 1986; 8: 233-240.
- 39. Maclndoe JR, with the technical assistance of Woods G, Jeffries L, Hinkhouse M. The hydrolysis of estrone sulfate and dehydroepiandrosterone sulfate by MCF-7 human breast cancer cells. Endocrinology 1988; 123: 1281-1288.
- 40. Pasqualini JR, Gelly C, Nguyen B-L, Vella C. Importance of estrogen sulfates in breast cancer. J Steroid Biochem 1989; 34: 155-163.
- 41. Bonney RC, Reed MJ, Davidson K, Beranek PA, James VHT. The relationship between 17ß-hydroxysteroid dehydrogenase activity and oestrogen concentrations in human breast tumours and in normal breast tissue. Clin Endocrinol (Oxf) 1983; 19: 727-739.
- 42. Nguyen BL, Chetrite GS, Pasqualini JR. Transformation of estrone and estradiol in hormone-dependent and hormona-independent human breast cancer cells. Effects of the antiestrogen ICI 164,384, danazol, and promegestone (R-5020). Breast Cancer Res Treat 1995; 34: 139-146.
- 43. Santner SJ, Feil PD, Santen RJ. In situ estrogen production via the estrone sulfatase pathway in breast tumors: relative importance versus the aromatase pathway. J Clin Endocrinol Metab 1984; 59: 9-33.
- 44. Pasqualini JR. Steroid sulphotransferase activity in human hormone-independent MDA-MB- 468 mammary cancer cells. Eur J Cancer 1992; 28A: 758-762.
- 45. Falany JL, Falany CN. Expression of cytosolic sulfotransferases in normal mammary epithelial cells and breast cancer cell lines. Cancer Res 1996; 56: 1551-1555.
- 46. Wilking N, Carlstro¨m K, Gustafsson SA, Skodelfors H, Tollborn O. Oestrogen receptors and metabolism of oestrone sulphate in human mammary carcinoma. Eur J Cancer 1980; 16: 1339-1344.
Otras Lecturas Recomendadas
- 47. Evans TRJ, Rowlands MG, Law M, Coombes R. Intratumoral oestrone sulphatase activity as a prognostic marker in human breast carcinoma. Br J Cancer 1994; 69: 555-561.
- 48. Pasqualini JR, Chetrite G, Le Nestour E. Control and expression of oestrone sulphatase activities in human breast cancer. J Endocrinol 1996; 150: S99-S105.
- 49. Pasqualini JR, Schatz B, Varin C, Nguyen B-L.Recent data on estrogen sulfatase and sulfotransferase activities in human breast cancer. J Steroid Biochem Mol Biol 1992; 41: 323- 329.
- 50. Pasqualini JR, Nguyen B-L. Estrone sulfatase activity and effect of antiestrogens on the transformation of estrone sulfate in hormonedependent vs -independent human breast cancer cells lines. Breast Cancer Res Treat 1991; 18: 93-98.
- 51. Prost-Avallet O, Oursin J, Adessi GL. In vitro effect of synthetic progestogens on estrone sulfatase activity in human breast carcinoma. J Steroid Biochem Mol Biol 1991; 39: 967-973.
- 52. Santner SJ, Santen RJ. Inhibition of estrone sulfatase and 17-hydroxysteroid dehydrogenase by antiestrogens. J Steroid Biochem Mol Biol 1993; 45: 383-390.
- 53. Pasqualini JR, Ebert C, Chetrite G. Control of estradiol in human breast cancer. Effect of medrogestone on sulfatase, 17ß-hydroxysteroid dehydrogenase and sulfotransferase activities in human breast cancer cells. In: Proceedings of the IV European Congress on Menopause. Paris, France: Editions ESKA; 1998. pp 625-633.
- 54. Pasqualini JR, Varin C, Nguyen B-L. Effect of the progestagen R-5020 (promegestone) and of progesterone on the uptake and on the transformation of estrone sulfate in the MCF- 7 and T-47D human mammary cancer cells: correlation with progesterone receptor levels. Cancer Lett 1992; 66: 55-60.
Fuentes
- 55. Chetrite G, Paris J, Botella J, Pasqualini JR. Effect of nomegestrol acetate on estronesulfatase and 17ßhydroxysteroid dehydrogenase activities in human breast cancer. J Steroid Biochem Mol Biol 1996; 58: 525-531.
- 56. Nguyen B-L, Ferme I, Chetrite G, Pasqualini JR. Action of danazol on the conversion of estrone sulfate to estradiol and on the sulfatase activity in the MCF-7, T-47D and MDAMB- 231 human mammary cancer cells. J Steroid Biochem Mol Biol 1993; 46: 17-23.
- 57. Carlström K, Doberl A, Pousette A, Rannevik G, Wilking N. Inhibition of steroid sulfatase activity by danazol. Acta Obstet Gynecol Scand 1984; 123: 107-111.
- 58. Evans TRJ, Rowlands MG, Jarman M, Coombes RC. Inhibition of estrone sulfatase enzyme in human placenta and human breast carcinoma. J Steroid Biochem Mol Biol 1991; 39: 493-499.
- 59. Chetrite G, Kloosterboer HJ, Pasqualini JR. Effect of tibolone (Org ODI4) and its metabolites on estrone sulphatase activity in MCF-7 and T-47D mammary cancer cells. Anticancer Res 1997; 17: 135-140.
- 60. Chetrite G, Varin C, Delalonde L, Pasqualini JR. Effect of promegestone, tamoxifen, 4- hydroxytamoxifen and ICI 164,384 on the oestrone sulphatase activity of human breast cancer cells. Anticancer Res 1993; 13: 931-934.
- 61. Pasqualini JR, Maloche C, Maroni M, Chetrite G. Effect of the progestagen promegestone (R-5020) on mRNA of the oestrone sulphatase in the MCF-7 human mammary cancer cells. Anticancer Res 1994; 14: 1589-1594.
- 62. Chetrite GS, Thole HH, Philippe J-C, Pasqualini JR. Dydrogesterone (Duphaston1) and its 20-dihydro-derivative as selective estrogen enzyme modulators in human breast cancer cell lines. Effect on sulfatase and on 17-hydroxysteroid dehydrogenase (17ß- HSD) activity. Anticancer Res 2004; 24: 1433- 1438.
Otras Fuentes
- 63. Chetrite G, Ebert C, Wright F, Philippe J-C, Pasqualini JR. Control of sulfatase and sulfotransferase activities by medrogestone in the hormone-dependent MCF-7 and T-47D human breast cancer cell. J Steroid Biochem Mol Biol 1999; 70: 39-45.
- 64. Pasqualini JR, Caubel P, Friedman AJ, Philippe J-C, Chetrite GS. Norelgestromin as selective estrogen enzyme modulator in human breast cancer cell lines. Effect on sulfatase activity in comparison to medroxyprogesterone acetate. J Steroid Biochem Mol Biol 2003; 84: 193-198.
- 65. Pasqualini JR, Chetrite GS. Paradoxical effect of estradiol: it can block its own bioformation in human breast cancer cells. J Steroid Biochem Mol Biol 2001; 78: 21-24.
- 66. Chetrite G, Thomas JL, Shields-Botella J, Cortes-Prieto J, Philippe J-C, Pasqualini JR. Control of sulfatase activity by nomegestrol acetate in the normal and cancerous human breast tissues. Anticancer Res 2005; 25: 2827- 2830.
- 67. Miyoshi Y, Ando A, Hasegawa S, Ishitobi M, Taguchi T, Tamaki Y, Noguchi S. High expression of steroid sulfatase mRNA predicts poor prognosis in patients with estrogen receptor- positive breast cancer. Clin Cancer Res 2003; 9: 2288-2293.
- 68. Prudhomme JF, Malet C, Gompel A, Lalardie JP, Ochoa C, Boue A, Mauvais-Jarvis P, Kuttenn F. 17ß-Hydroxysteroid dehydrogenase activity in human breast epithelial cells and fibroblast cultures. Endocrinology 1984; 114: 1483-1489.
- 69. Gompel A, Malet C, Spritzer P, Lalardrie JP, Kuttenn F, Mauvais-Jarvis P. Progestin effect on cell proliferation and 17ß-hydroxysteroid dehydrogenase activity in normal human breast cells in culture. J Clin Endocrinol Metab 1986; 63: 1174-1180.
- 70. Poutanen M, Moncharmont B, Vihko R. 17ß- Hydroxysteroid dehydrogenase gene expression in human breast cancer cells: regulation of expression by a progestin. Cancer Res 1992; 52: 290-294.
Citas Bibliográficas
- 71. Peltoketo H, Isomaa VV, Poutanen MH, Vihko R. Expresión and regulation of 17ßhydroxysteroid dehydrogenase type 1. J Endocrinol 1996; 150: S21-S30.
- 72. Coldham NJ, James VHT. A possible mechanism for increased breast cell proliferation by progestins through increased reductive 17ß-hydroxysteroid dehydrogenase activity. Int J Cancer 1990; 45: 174-178.
- 73. Couture P, Theriault C, Simard J, Labrie F. Androgen receptor-mediated stimulation of 17ß-hydroxysteroid dehydrogenase activity by dihydrotestosterone and medroxyprogesterone acetate in ZR-75-1 human breast cancer cells. Endocrinology 1993; 132: 179-185.
- 74. Adams EF, Coldham NO, James VHT. Steroidal regulation of oestradiol-17ßdehydrogenase activity of the human breast cancer cell line MCF-7. J Endocrinol 1988; 1l8: 149-154.
- 75. McNeill JM, Reed MJ, Beranek PA, Newton CJ, Ghilchik MW, James VHT. The effect of epidermal growth factor, transforming growth factor and breast tumor homogenates on the activity of oestradiol 17ß-hydroxysteroid dehydrogenase in cultured adipose tissue. Cancer Lett 1986; 31: 213-219.
- 76. Malet C, Vacca A, Kuttenn F, Mauvais-Jarvis P. 17ß-Estradiol dehydrogenase (E2DH) activity in T47D cells. J Steroid Biochem Mol Biol 1991; 39: 769-775.
- 77. Chetrite GS, Kloosterboer HJ, Philippe J-C, Pasqualini JR. Effect of Org OD14 (Livial1) and its metabolites on human estrogen sulphotransferase activity in the hormone-dependent MCF-7 and T47D, and the hormoneindependent MDA-MB-23I, breast cancer cells lines. Anticancer Res 1999; 19: 269-276.
- 78. Chetrite G, Le Nestour E, Pasqualini JR. Human estrogen sulfotransferase (hEST1) activities and its mRNA in various breast cancer cell lines. Effect of the progestin, promegestone (R-5020). J Steroid Biochem Mol Biol 1998; 66: 295-302.
Otras Citas Bibliográficas
- 79. Chetrite GS, Ebert F, Wright F, Philippe J-C, Pasqualini JR. Control of sulfatase and sulfotransferase activities by medroxyprogesterone in the hormone-dependent MCF-7 and T-47D human breast cancer cells. J Steroid Biochem Mol Biol 1999; 70: 39-45.
- 80. Chetrite GS, Paris J, Shields-Botella J, Philippe J-C, Pasqualini JR. Effect of nomegestrol acetate on human estrogen sulfotransferase activity in the hormone-dependent MCF-7 and T-47D breast cancer cell lines. Anticancer Res 2003; 23: 4651-4656.
- 81. Chetrite GS, Pasqualini JR. The selective estrogen enzyme modulator (SEEM) in breast cancer. Oncol Res 1997; 9: 589-596.
- 82. Pasqualini JR. Selective estrogen enzyme modulators in breast cancer: a review. Biochem Biophys Acta 2004; 1654: 123-143.
- 83. Pasqualini JR, Chetrite GS. Correlation of the estrogen sulfotransferase activity and proliferation in normal and carcinomous human breast. An hypothesis. Anticancer Res 2007; in press.
- 84. Falany JL, Macrina N, Falany CN. Regulation of MCF-7 breast cancer cell growth by 17ßestradiol sulfation. Breast Cancer Res Treat 2002; 74: 167-176.
- 85. Perel E, Daniilescu D, Kharlip L, Blankenstein M, Killenger DW. Steroid modulation of aromatase activity in human cultured breast carcinoma cells. J Steroid Biochem 1988; 29: 393-399.
- 86. Chetrite GS, Shields-Botella J, Pasqualini JR. Effect of nomegestrol acetate on aromatase activity in MCF-7 aro breast cancer cells. Breast Cancer Res Treat 2005; 94(Suppl 1): 205 (abstr 4113).
- 87. Harris AL, Mitchell MD, Smith IE, Powles TJ. Aminoglutethimide in the treatment of advanced postmenopausal breast cancer. Cancer Res 1982; 42: 3405-3408.
- 88. Combes RC, Coos PE, Dowsett M, Hutchinson G, Cunningham D, Jarman M, Brodie AMH. 4-Hydroxyandrostenedione treatment for postmenopausal patients with advanced breast cancer. Steroids 1987; 50: 245-252.
Autores Recomendados
- 89. de Jong PC, van de Ven J, Nortier HWR, Maitimu-Smeele I, Donker TH, Thijssen JHH, Slee PHTJ, Blankenstein RA. Inhibition of breast cancer tissue aromatase activity and estrogen concentrations by the third-generation aromatase inhibitor vorozole. Cancer Res 1997; 57: 2109-2111.
- 90. Miller WR. Aromatase inhibitors. Endocr Relat Cancer 1996; 3: 65-79.
- 91. Brodie AMH. Aromatase inhibitors and their application to the treatment of breast cancer. In: Pasqualini JR, editor. Breast cancer, prognosis, treatment and prevention. New York: Marcel Dekker; 2002. pp 251-269.
- 92. Aromatase 2002. In: Brodie A, Dowsett M,Harada N, Lonning P, Miller B, Pasqualini JR, Santen R, Sasano H, Simpson E, editors. Proceedings of the VI International Aromatase Conference. J Steroid Biochem Mol Biol 2003; 86: 219-507.
- 93. Aromatase 2004. In: Miller WR, Paqualini JR,editors. Proceedings of the VI International Aromatase Conference, Edinburgh, Scotland, UK 6-8 September 2004. J Steroid Biochem Mol Biol 2005; 95: 1-187.
- 94. Million Women Collaborators. Breast cancer and hormone replacement therapy in the Million Women Study. Lancet 2003; 362: 419-427.
95. Beral V. Breast cancer and hormonereplacement therapy in the Million Women Study. Lancet 2003; 362: 419-427. - 96. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BH, Johnson KC, et al. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. J Am Med Assoc 2002; 288: 321-333.
Otros Autores Recomendados
- 97. Saeki T, Takashima S, Takeuchi M, Sano M, Honjo H, Sonoo H, Ochiai K, Komoike K, Kobayashi T, Sawai K, et al. Hormone replacement therapy (HRT) may not increase the incidence of breast cancer in Japan. Breast Cancer Treat 2005; 94(Suppl 1): 159 (abstr 3099).
- 98. Shapiro S. Comments: The Million Women Study: potential biases do not allow uncritical acceptance of the data. Climacteric 2004; 7: 415-416.
- 99. Delgado RC, Lubian Lopez DM. Prognosis of breast cancers detected in women receiving hormone replacement therapy. Maturitas 2001; 38: 147-156.
- 100. Li CI, Weiss NS, Stanford JL, Dating JR. Hormone replacement therapy in relation to risk of lobular and ductal breast carcinoma in middle-aged women. Cancer 2000; 88: 2570- 2577.
- 101. Heikkinen J. Hormone therapy: maximizing the benefits. Gynecol Endocrinol 2006; 22: 160-162.
- 102. Wiebe JP, Lewis MJ, Cialacu V, Pawlak KJ, Zhang G. The role of progesterone metabolites in breast cancer: potential for new diagnostics and therapeutics. J Steroid Biochem Mol Biol 2005; 93: 201-208.
- 103. Zhu BT, Conney AH. Is 2-methoxyestradiol an endogenous estrogen metabolite that inhibits mammary carcinogenesis? Cancer Res 1998; 58: 2269-2277.
- 104. Mueck AO, Seeger H, Lippert TH. Estradiol metabolism and malignant disease. Maturitas 2002; 43: 1-10.
- 105. Lippert C, Seeger H, Mueck AO. The effect of endogenous estradiol metabolites on the proliferation of human breast cancer cells. Life Sci 2003; 72: 877-883.
- 106. Schütze N, Vollmer G, Tiemann I, Geiger M, Knuppen R. Catecholestrogens are MCF-7 cell estrogen receptor agonists. J Steroid Biochem Mol Biol 1993; 46: 781-789.