Trabajos de Investigación
Volumen 12 – No. 4 – Año 2006
Juan Camilo Guzmán 1, 2, Ronald Gerardo García 1, Federico Arturo Silva 1,
Hermes Jaimes 3, Patricio López-Jaramillo 1, Carlos Arturo Morillo 1, 2
Resumen
Antecedentes: el déficit de estrógenos, propio de la etapa posmenopáusica, puede contribuir al desarrollo de un imbalance autonómico con reducción del reflejo cardiovagal, lo cual puede incrementar el riesgo cardiovascular. Los mecanismos fisiopatológicos subyacentes de esta alteración no se han aclarado totalmente. El presente artículo discute el efecto de la TRH sobre la función autonómica en mujeres histerectomizadas.
Métodos: mujeres histerectomizadas y con amenorrea al menos un año antes de la cirugía fueron incluidas en un ensayo clínico cruzado, placebo-controlado, doble ciego. Se aleatorizaron para recibir estrógenos conjugados 0.625 mg/d o placebo durante 12 semanas, con un período intermedio de dos semanas sin medicación. Se evaluó la función autonómica usando oclusión venosa por pletismografía para calcular el flujo sanguíneo en el antebrazo (FSA) y la resistencia vascular periférica (RVP) basal, durante la prueba de mesa basculante (PMB) y presión negativa en miembros inferiores (PNMI).
Resultados: no se encontraron diferencias en la función autonómica cardiovagal entre los grupos de tratamiento en condiciones de reposo ni durante la PMB Y PNMI. Se encontraron diferencias significativas tanto en el FSA [1.9(0.5) frente a 1.5(0.5), p=0.02] así como en la RVP [53.5(18.2) frente a 68.6(34), p=0.02], comparando TRH con placebo.
Conclusiones: la TRH a corto plazo no mejoró las respuestas reflejas autonómicas cardiovasculares en mujeres posmenopáusicas, pero sí incrementa la relación vascular por reducción de RVP. La TRH puede utilizarse, bajo supervisión adecuada, para mejorar los síntomas de la menopausia durante corto tiempo, principalmente en mujeres posmenopáusicas jóvenes no hipertensas.
Palabras clave: menopausia, sistema nervioso autónomo, terapia de reemplazo hormonal, pletismografía.
Abstract
Background: Estrogen deficit during menopause may be related to cardiac autonomic function imbalance, reducing the cardiovagal reflex response which could potentially increase cardiovascular risk. The physiological mechanisms that lead to this alteration in postmenopausal women remain unclear.
Methods: Fifty women with previous hysterectomy and amenorrhea for 1 year prior to surgery were enrolled in a prospective, randomized, crossover double-blind placebo controlled trial. Either oral estrogen replacement therapy (ERT) (Conjugated estrogens 0.625 mg once a day) or placebo were randomly administered during 12 weeks, with a 2 week washout period. Cardiovagal autonomic function was assessed by conventional techniques. Venous occlusion plethysmography was used to evaluate the vascular autonomic function by calculating forearm blood flow (FBF) and peripheral vascular resistance (PVR) at baseline, and during head-up tilt (HUT) and a no-hypotensive stimuli (–10mmHg) lower-body negative pressure (LBNP).
Results: No differences were found in cardiovagal autonomic function comparing ERT vs. placebo at baseline resting conditions as well as during HUT and LBNP. A significant difference was identified in supine FBF [1.9(0.5) vs. 1.5(0.5), p=0.02] as well as in PVR [53.5(18.2) vs. 68.6(34), p=0.02] comparing ERT vs. placebo interventions.
Conclusions: Short term ERT did not improve cardiovascular autonomic reflex responses in postmenopausal women, but increased vascular relaxation primarily by reducing peripheral vascular resistance.
Key words: menopause, autonomic nervous system, estrogen replacement therapy, plethysmography.
Introducción
La reducción paulatina en los niveles de estrógenos durante la menopausia conduce a múltiples cambios sistémicos los cuales pueden lesionar potencialmente a la mujer posmenopáusica 1, 2. Tradicionalmente reconocidos como cardioprotectores 3, los estrógenos han sido objeto de debate ante hallazgos de un aumento en la mortalidad de causa cardiovascular en mujeres 4, 5.
Sin embargo, la utilización de TRE en mujeres con antecedente de histerectomía no demostró aumento del riesgo cardiovascular6. En un estudio con 10.739 mujeres histerectomizadas se sugirió un menor riesgo de enfermedad coronaria, en aquellas mujeres entre 50 y 59 años con TRE7. Varios mecanismos han sido propuestos para la reducción potencial de eventos cardiovasculares en mujeres posmenopáusicas, incluyendo regulación del metabolismo lipídico 8, aumento en la producción de óxido nítrico 9-11 e inhibición de la proliferación de placas de ateromas 12. Los estrógenos restauran los reflejos cardiovasculares simpatovagales y aumentan la sensibilidad/densidad de receptores autonómicos o la disponibilidad de neurotransmisores en modelos animales 13-15.
Sin embargo, los efectos de la TRE sobre el sistema autonómico cardiovascular y la función refleja vascular no se han evaluado sistemáticamente en mujeres posmenopáusicas histerectomizadas.
Métodos
Cincuenta mujeres, evaluadas en dos clínicas de menopausia afiliadas a la Fundación Cardiovascular de Colombia (FCV), fueron incluidas.
Un ginecólogo del estudio evaluó a las participantes en una visita inicial la cual incluyó historia clínica y examen físico. Los criterios de inclusión y exclusión se presentan en la Tabla 1.
Las medidas antropométricas fueron obtenidas usando recomendaciones internacionales 16. Se determinaron niveles de glucemia (Biosystems BTS-303 Photmetric, España), hormona folículo estimulante (FHS; Immulite, Randolph, New Jersey, USA) y perfil lipídico (Biosystems BTS-303 Photometric, España). Se obtuvieron electrocardiogramas de 12 derivaciones y mamografía de tamizaje, previo a la intervención.
Se obtuvo consentimiento informado verbal y escrito de todas las participantes. El protocolo fue revisado y aprobado por el Comité de Ética de la FCV.
Intervención
Las participantes fueron aleatorizadas en estudio doble-ciego, cruzado, para recibir TRE (Estrógenos conjugados 0.625 mg/día, Climatrol ®, Gynopharm SA, Barranquilla, Colombia) o placebo. La TRE o el placebo fueron administrados por 12 semanas, seguidos por dos semanas de lavado para cruzarse al otro brazo del estudio durante otras 12 semanas. Los eventos adversos fueron reportados al Comité Institucional de ética.
El desenlace primario fue el cambio en la función autonómica refleja cardiovagal y vascular, tras la intervención con TRE o placebo.
Tabla 1. Criterios de inclusion y exclusion

Mediciones
Las participantes fueron evaluadas en el Laboratorio de Fisiología Autonómica de la Fundación Cardiovascular de Colombia en dos etapas. Las pruebas de función autonómica se realizaron en un cuarto a temperatura controlada (20º), en condiciones de ayuno de 8 horas, sin consumo de bebidas con xantinas el día previo a la evaluación. Una vena periférica fue canalizada para la infusión de solución salina normal a 20 cc/hora y la infusión de medicación del protocolo. Se obtuvo registro electrocardiográfico continuo en DII y se realizó monitorización continua no invasiva de la presión arterial latido a latido (Colin Pilot 9200, Colin Medicals, USA). Para el almacenamiento de estos datos se utilizó un microcomputador compatible con IBM-PC con un sistema de adquisición de señales DATAQ 720-WINDAQ PRO+ (DataQ Instruments, USA) y, para su análisis, un sistema winCPRS (Absolutely Aliens, Finland).
Variables hemodinámicas latido a latido: se obtuvieron mediciones de la frecuencia cardiaca (latidos/minuto, lpm), presión arterial sistólica (mmHg, PAS), diastólica (mmHg, PAD), y media (mmHg, PAM), volumen latido (ml/min, VL) y gasto cardiaco (GC) en reposo, en posición supina (5 minutos), así como durante un estímulo no hipotensor de presión negativa de –10mmHg aplicada en miembros inferiores (PNMI, 5 minutos) y realizando una inclinación de 60 grados (PMB, 5 minutos). La variabilidad de la frecuencia cardiaca (VFC) y de la presión arterial (VPA) fue analizada en reposo en posición supina, durante un estímulo no hipotensor de PNMI y en PMB. Se calcularon los índices de VFC en dominio de tiempo (RMSSD) y en dominio de frecuencia:
banda de baja frecuencia [LF (0.04-0.15 Hz)], banda de alta frecuencia [HF (0.15-0.4 Hz)] y balance simpato-vagal (LF/HF) (44). Igualmente, se analizó la VPA sistólica utilizando técnicas de poder espectral. Se calcularon índices de dominio de frecuencia del espectro de poder total (SAP-TPS) y bajo normalizado (SAP-LF) utilizando algoritmos previamente publicados17. Se realizó la prueba de respiración profunda para valorar la respuesta cardiovascular refleja a la respiración controlada. Se registró la frecuencia cardiaca latido a latido durante un periodo de un minuto con una frecuencia estandarizada de seis respiraciones por minuto. La diferencia entre la frecuencia cardiaca máxima y mínima para cada uno de los seis ciclos fue calculada y promediada para obtener la diferencia inspiratoria-espiratoria de respiración profunda (DRP) en latidos/minuto (valor norm al >15 lpm)18.
La sensibilidad barorrefleja arterial (SBR) fue obtenida utilizando la técnica modificada de Oxford19. Los cambios en el intervalo RR y PAS fueron correlacionados en respuesta a un bolo endovenoso de fenilefrina (150µg) seguido por un bolo endovenoso de nitroprusiato de sodio (100µg), un minuto después de la primera intervención. Se utilizó el análisis de regresión lineal para calcular la pendiente para un cambio dado en el intervalo RR después del cambio previo en la PAS. Sólo correlaciones mayores de 0.8 fueron aceptadas para el análisis.
Pletismografía del antebrazo: se utilizó un dispositivo de medición de pletismografía de mercurio para establecer el flujo sanguíneo del antebrazo (FSA) en reposo, en posición supina, con estímulo no hipotensor de PNMI y PMB. Un instrumento de presión de silastic fue situado en el antebrazo derecho 5cm distal al pliegue antecubital y conectado a un dispositivo de pletismografía (EC6, Hokanson Inc, USA). El brazo fue sostenido sobre el nivel de la aurícula derecha y se instaló un manguito para la región superior del brazo y para la muñeca. El manguito de la muñeca fue insuflado hasta 200 mmHg para excluir la circulación de la mano de la medición, un minuto antes y durante la medición del FSA.
El manguito de la región superior del brazo fue insuflado a 40mmHg durante 7 segundos en cada ciclo de 15 segundos para ocluir el flujo venoso proveniente del brazo, utilizando un insuflador rápido (EC-20, Hokanson Inc, USA). El FSA (ml/100ml antebrazo/min) en reposo en posición supina y posterior a cada Estímulo, fue calculado por medio de la media de todas las curvas registradas durante el periodo de 5 minutos 20. La resistencia vascular periférica (RVP) fue también calculada dividiendo la PAM y FSA.
Actividad simpática vascular: las respuestas vasculares simpáticas fueron registradas aplicando PNMI no hipotensora (5 minutos) para estimular los receptores cardiovasculares21, produciendo un aumento de la actividad simpática en los nervios de los miembros superiores, llevando a una reducción del 20% en el FSA asociado con un aumento relativo en la RVP sin ningún cambio concomitante en la presión arterial o en la frecuencia cardiaca 20.
Doble ciego y aleatorización
El personal del estudio, así como los participantes, fue ciego a la asignación del tratamiento durante el período del estudio. Todos los participantes fueron aleatorizados utilizando una tabla de números aleatorios. Los códigos fueron almacenados en sobres cerrados por el Comité de Ética de la Fundación Cardiovascular de Colombia, hasta la finalización del estudio.
Análisis Estadístico
Con el fin de comparar la función refleja vascular y cardiovagal después de la terapia cruzada con TRE o placebo, se realizó un análisis de intención de tratar. Las variables continuas fueron informadas como promedios con desviación estándar (SD). Se realizó la Prueba de Anderson-Darling para determinar la normalidad de la distribución de los datos. La Prueba de t-student fue empleada para comparar las muestras con distribución normal y el test Kruskal-Wallis para variables con distribución no normal.
Se asumió el teorema del límite central por ser un estudio con una muestra mayor a 30 participantes. Para analizar las variables categóricas así como las proporciones en los casos apropiados, se utilizaron la prueba del Chi Cuadrado y el test exacto de Fisher. El nivel de significancia del nivel alfa de dos colas fue definido como 0.05. El tamaño de la muestra para el estudio fue calculado con base en los cambios en la VFC después de tres meses de TRE. Con un tamaño de muestra calculado de 42 pacientes (21 por cada grupo), el estudio tiene un poder del 95% para detectar diferencias de grupo en la VFC de 1.7 (Intervalo RR HF) con una DE de 2.8. Para el análisis de datos se utilizó MINITAB versión 14.20 (Minitab Inc, US).
Resultados
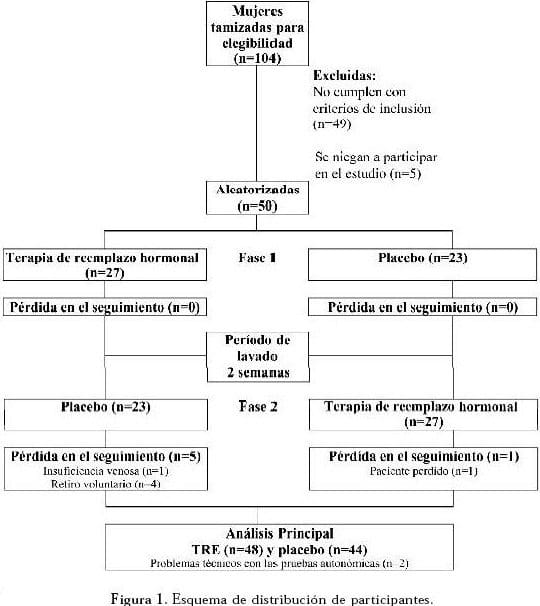
Ciento cuatro mujeres fueron incluidas entre septiembre del 2003 y diciembre del 2004. Cuarenta y nueve fueron excluidas y cinco no firmaron el Consentimiento Informado para participar en el estudio (Figura 1). Las participantes del estudio fueron seguidas al momento de la aleatorización y por cuatro semanas se evaluó la adherencia al tratamiento y los potenciales efectos adversos durante ambas secuencias. Las participantes asistieron al laboratorio de fisiología autonómica al final de ambas intervenciones a la evaluación refleja autonómica.
Cincuenta mujeres fueron aleatorizadas y destinadas cada una para secuencias TRE placebo (n=27) o placebo-TRE (n=23) y se cruzaron para alternar el tratamiento después de un periodo de lavado de dos semanas. Tras un seguimiento de 26 semanas, 44 participantes completaron el estudio; seis pacientes se retiraron durante la segunda fase del tratamiento por diferentes razones (Figura 1).
Una paciente fue retirada tras presentar un evento adverso de insuficiencia venosa leve, documentada por eco doppler, la cual se asoció a manifestaciones cutáneas. La paciente no presentó complicaciones tras seis meses de seguimiento. Una mujer fue perdida en el seguimiento y no completó la evaluación autonómica de la segunda fase. Cuatro participantes retiraron el consentimiento por eventos adversos leves (estreñimiento y dolor mamario). El análisis computarizado por bioseñal no fue realizado en dos pacientes debido a dificultades técnicas.
El cuadro de seguimiento de los pacientes está resumido en la Figura 1. La adherencia en los grupos TRE y placebo fue alta (98.8% frente a 98.9%, respectivamente) (p>0.05). La Tabla 2 presenta las características demográficas. No se encontraron diferencias significativas en las variables demográficas, ni en los marcadores bioquímicos, comparando las dos secuencias de tratamiento (TRE – Placebo vs. Placebo – TRE).
1. Laboratorio de Fisiología Autonómica. Instituto de Investigaciones, Fundación Cardiovascular de Colombia. Floridablanca, Santander, Colombia jplopezj@fcv.org
2. Unidad de Síncope. Laboratorio de Función Autonómica, Servicio de Arritmias, División de Cardiología, Departamento de Medicina, Universidad de McMaster. Hamilton, Ontario, Canadá.
3. Departamento de Ginecología y Obstetricia, Universidad Industrial de Santander, Bucaramanga, Santander, Colombia.
* Recibido: agosto 15 de 2006. Aceptado: octubre 15 de 2006.
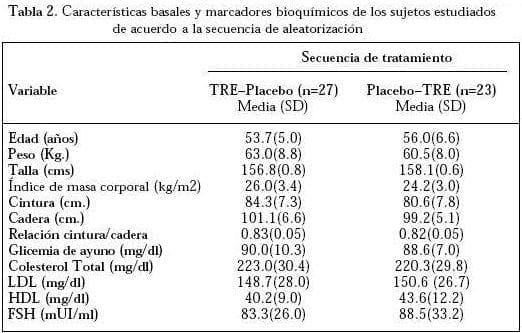
LDL= Lipoproteína de baja densidad, HDL= lipoproteína de alta densidad y FSH= hormona folículo estimulante.
Variables hemodinámicas en reposo, latido a latido, y función autonómica cardiovascular tras las intervenciones.
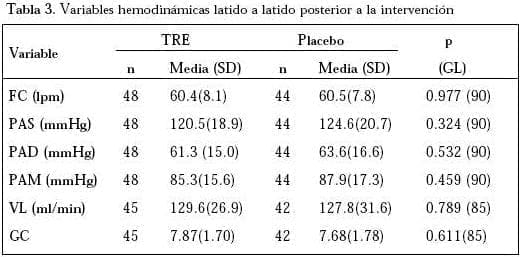
No se encontraron diferencias significativas en variables hemodinámicas latido a latido entre los grupos intervenidos. Sin embargo, los valores de PAS, PAD y PAM tendieron a ser más bajos durante el período de tratamiento activo (Tabla 3).
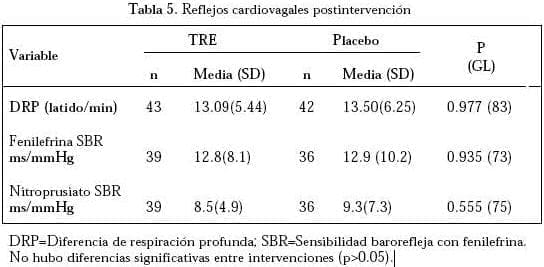
No se documentaron diferencias en los índices de VFC (Tabla 4) y en la VPA sistólica (datos no mostrados) durante la evaluación supina, PMB ni con el estímulo no hipotensor de PNMI entre los grupos activo y placebo. El delta de la PMB (PMB menos supino) también como el delta de la PNMI (PNMI menos basal) fue similar, tanto en el grupo de TRE como en el de placebo. Además, los índices de reflejo cardiovagal postintervención (SBR y DRP) fueron similares, comparando los grupos (Tabla 5).
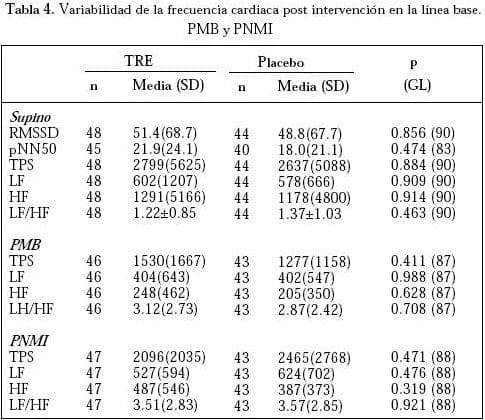
GL= Grados de libertad; RMSSD= Raíz cuadrada del promedio de las diferencias al cuadrado entre intervalos R-R; pNN50= Proporción derivada de la división del número de diferencias de intervalos de RR sucesivos normales, mayores de 50 ms por el número total de intervalos RR; TPS=Espectro de poder total; LF=Banda de baja frecuencia; HF= Banda de alta frecuencia y LF/HF=Razón de balance simpatovagal. La variabilidad de la presión arterial sistólica fue también analizada con técnicas de poder espectral. No hubo diferencias significativas entre intervenciones.
Función refleja autonómica vascular
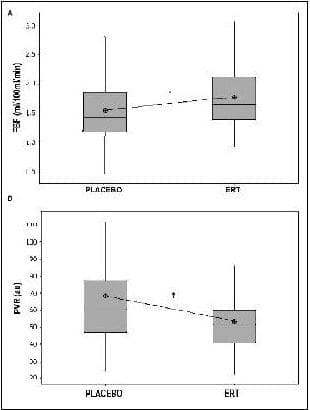
Se encontraron diferencias significantes en los valores de FSA y RVP comparando los grupos de TRE (n=47) y placebo (n=43). Mayores valores de FSA (1.78±0.52 frente a 1.54±0.56, p=0.039 con 88 grados de libertad) se asociaron con valores menores de RVP (53.6±18.2 frente a 68.7±34.7, p=0.011 con 88 grados de libertad). Las cuantificaciones de pletismografia durante la PMB y PNMI no fueron significativamente diferentes entre los grupos intervenidos (Figura 2).
Discusión
El déficit de estrógenos propio de la menopausia puede contribuir al desarrollo de un imbalance autonómico, con reducción del reflejo cardiovagal, lo que puede incrementar el riesgo cardiovascular. En el presente estudio se observó un aumento en la relajación vascular en las mujeres histerectomizadas con TRE, el cual se podría interpretar como una mejoría a corto plazo en la respuesta vascular. Sin embargo, no se encontraron diferencias en la función del reflejo autonómico cardiaco.
El impacto de la TRE sobre las alteraciones autonómicas inducidas por la hipoestrogenemia de la etapa posmenopáusica ha sido discutido por varios autores en múltiples publicaciones 17, 22-31. El efecto de la terapia ha sido evaluado mediante diversos estudios, los cuales han reportado resultados no concluyentes. Estas diferencias son consecuencia de factores como el empleo de las técnicas para la valoración de la respuesta autonómica, la comparación de grupos no pareados y del uso de diferentes vías de administración del medicamento 17, 24-28, 31.
Un estudio poblacional reportado por Carnethon y colaboradores, en el cual se incluyeron 2.621 participantes, con ajustes por edad y factores de riesgo cardiovasculares, no encontró diferencias en la VFC asociadas a la implementación de TRH23.
Hasta el momento sólo se registra cinco experimentos clínicos aleatorizados , doble ciego, en los cuales se valoró el efecto de la TRE o la TRH sobre la respuesta del reflejo autonómico cardiaco mediante la determinación de los índices de dominio de tiempo y de frecuencia de la VFC 17, 24, 26, 27, 28.
En tres de estos estudios 24, 26, 27 se registró la respuesta autonómica cardiaca al principio del estudio y nuevamente después de periodos variables de tratamiento (desde tres semanas hasta
tres meses). Dos de los estudios 24, 26 encontraron diferencias estadísticamente significativas a favor de la terapia al valorar VFC.
La principal diferencia entre dos estudios y el tercero, en el cual no se hallaron diferencias entre el grupo de terapia y el grupo control 27, es la forma como se evaluó la función autonómica. En los dos estudios que reportaron diferencias significativas, se determinó la variabilidad del intervalo RR en registros de 10 minutos, mientras que en el que no hubo diferencias significativas, se utilizó un registro de 24 horas realizado por medio de Holter.
En nuestro estudio tampoco se encontraron diferencias significativas en los índices de dominio de tiempo y frecuencia de la VFC, a pesar de analizarse en un registro cardíaco por corto tiempo. Otros estudios han analizado la liberación (spillover) de noradrenalina y el tráfico simpático a nivel muscular como marcadores de la respuesta autonómica cardiaca 32-35.
La administración transdérmica de TRE a corto plazo se asoció a reducción del tráfico simpático a nivel muscular, la cual a su vez no se asoció con cambios en la ganancia barorrefleja 34, 35. Sin embargo, esta forma de tratamiento no demostró disminución en la liberación de norepinefrina como parte del reflejo autonómico 33.
Los hallazgos son compatibles con los resultados de nuestro estudio, en el cual la ganancia barorrefleja no mostró cambios. En nuestro estudio no se llevó a cabo la medición directa de marcadores de actividad simpática. En cambio, se valoró la resistencia vascular periférica, la cual es modulada principalmente por el tono simpático.
La administración de TRE durante estímulo no hipotensor con PNMI se asoció a una disminución significativa de la resistencia vascular periférica y a un aumento en FSA. En las mujeres posmenopáusicas se ha documentado una alteración en la reactividad vascular la cual conduce a la pérdida de la respuesta vasodilatadora. Esta alteración parece estar implicada en el desarrollo de enfermedad cardiovascular en estas mujeres 12. La administración de TRE ha sido asociada a mejoría en la reactividad vascular con la consiguiente vasodilatación periférica y aumento en el FSA, tanto en mujeres con factores de riesgo para enfermedad cardiovascular36, como en aquellas sin estos factores37.
Este efecto puede ser consecuencia de un aumento en la producción de óxido nítrico (NO), el cual conlleva a una mejor función endotelial 11. En estudios recientes se observó un aumento en los metabolitos del NO9 y mejoría en la actividad del sistema nervioso central 38). Por lo tanto, los estrógenos pueden incrementar la producción de óxido nítrico-sintasa endotelial y reducen la degradación de NO, disminuyendo así, la formación de superóxido 39.
El aumento en la liberación de NO por parte de la célula endotelial puede ser debido a un aumento en el calcio intracelular mediado por estrógenos10-40. En un estudio previo, nosotros reportamos un aumento en los niveles plasmáticos de NO y una mejoría en la vasodilatación dependiente del endotelio, asociados a la TRE en posmenopáusicas jóvenes, sugiriendo que los efectos de la TRE pueden estar en gran parte explicados por su acción sobre la función endotelial 9.
Recientemente se publicaron seis experimentos clínicos aleatorizados, doble ciego, en los cuales se evaluó la función endotelial por medio de la vasodilatación mediada por flujo en mujeres posmenopaúsicas a quienes se les asignó TRE o TRH. En todos ellos se documentó mejoría en la función endotelial 5-41-45.
Estos resultados respaldan los hallazgos de nuestro estudio. En conclusión, la TRE de corta duración no demostró mejoría en las respuestas reflejas cardiovasculares autonómicas en mujeres posmenopáusicas. La TRE se asoció a reducción de la resistencia vascular periférica y aumento en la relajación vascular. La prescripción de TRE de corta duración se debe hacer en forma individualizada y con precaución, especialmente en las mujeres posmenopáusicas no hipertensas.
Agradecimientos
El presente manuscrito fue realizado con el apoyo financiero del Instituto para el Desarrollo de la Ciencia y Tecnología de Colombia, COLCIENCIAS (Código 6566-04-11788)16.
Referencias
1. Greendale GA, Lee NP, Arriola ER. Them enopause. Lancet 1999; 353: 571-580.
2. Sullivan JM, Fowlkes LP. The clinical aspects of estrogen and the cardiovascular system. Obstet Gynecol 1996; 87: 36S-43S.
3. Hishikawa K, Nakaki T, Marumo T, Susuki H, Kato R, Saruta T. Up-regulation of nitric oxide synthase by estradiol in human aortic endotelial cells. FEBS 1995; 360: 291-293.
4. Hulley S, Grady D, Bush T, Furberg C, Herrington D, Riggs B, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/ progestin Replacement Study (HERS) Research Group. JAMA 1998; 280: 605-613.
5. Saitta A, Altavilla D, Cucinotta D, Morabito N, Frisina N, Corrado F, et al. Randomized, double-blind, placebo-controlled study on the effects of raloxifene and hormone replacement therapy on plasma concentrations, endothelin-1 levels, and endothelium-dependent vasodilation in postmenopausal women. Arterioscler Thromb Vasc Biol 2001; 21: 1512-1519.
6. Anderson GL, Limacher M, Assaf AR, Bassford T, Beresford SA, Black H, et al. Effects of conjugated equine estrogens in postmenocon pausal women with hysterectomy: the Women’s Health Initiative randomized controlled trial. JAMA 2004; 291: 1701-1712.
7. Hsia J, Langer RD, Manson JE, Kuller L, Johnson KC, Hendrix SL, et al. Conjugated Equine Estrogens and Coronary Heart Disease: The Women’s Health Initiative. Arch Intern Med 2006; 166: 357-365.
8. Walsh BW, Schiff I, Rosner B, Greenberg L, Ravnikar V, Sacks FM. Effects of postmenopausal estrogen replacement on the concentrations and metabolism of plasma lipoproteins. N Engl J Med 1991; 325: 1196-1204.
9. Lopez-Jaramillo P, Diaz LA, Pardo A, Parra G, Jaimes H, Chaudhuri G. Estrogen therapy increases plasma concentrations of nitric oxide metabolites in postmenopausal women but increases flow-mediated vasodilatation only in younger women. Fertil Steril 2004; 82: 1550-1555.
10. Lopez-Jaramillo P, Gonzáles MC, Palmer RsMJ, Moncada S. The crucial role of physiological calcium concentration in the production of endothelial nitric oxide and the control of vascular tone. Br J Pharmacol 1990; 101: 489-493.
11. Lopez-Jaramillo P, Teran E. Improvement in functions of the central nervous system by estrogen replacement therapy might be related with an increased nitric oxide production. Endothelium 1999; 6: 263-266.
12. Oparil S. Hormones and vasoprotection. Hypertension 1999; 33: 170-176. 13. el-Mas MM, Abdel-Rahman AA. Estrogen enhances baroreflex control of heart rate in conscious ovariectomized rats. Can J Physiol Pharmacol 1998; 76: 381-386.
13. He XR, Wang W, Crofton JT, Share L. Effects of 17beta-estradiol on the baroreflex control of sympathetic activity in conscious ovariectomized rats. Am J Physiol 1999; 277: R493-R498.
14. O’Malley CA, Hautamaki RD, Kelley M, Meyer EM. Effects of ovariectomy and estradiol benzoate on high affinity choline uptake, ACh synthesis, and release from rat cerebral cortical synaptosomes. Brain Res 1987; 403: 389-392.
15. Standarizaton of anthropometric measurements. In: Lohman T, Roche A, Martorel R, eds. The Airle (VA) consensus Conference. Champaign, I11: Human Kinetics, pp 39-80. 1988.
16. Parati G, Bilo G, Vettorello M, Groppelli A, Maronati A, Tortorici E, et al. Assessment of overall blood pressure variability and its different components. Blood Press Monit 2003; 8: 155-159.
17. Faulkner MS, Hathaway D, Tolley B. Cardiovascular autonomic function in healthy adolescents. Heart Lung 2003; 32: 10-22.
18. Rudas L, Crossman AA, Morillo CA, Halliwill JR, Tahvanainen KU, Kuusela TA, et al. Human sympathetic and vagal baroreflex responses to sequential nitroprusside and phenylephrine. Am J Physiol 1999; 276: H1691-H1698.
19. Whitney RJ. The measurement of volume changes in human limbs. J Physiol 1953; 121: 1-27.
20. Wilkinson IB, Webb DJ. Venous occlusion plethysmography in cardiovascular research: methodology and clinical applications. Br J Clin Pharmacol 2001; 52: 631- 646.
21. Brockbank CL, Chatterjee F, Bruce SA, Woledge RC. Heart rate and its variability change after the menopause. Exp Physiol 2000; 85: 327-330.
22. Carnethon MR, Anthony MS, Cascio WE, Folsom AR, Rautaharju PM, Liao D, et al. Prospective association between hormone replacement therapy, heart rate, and heart rate variability. The Atherosclerosis risk in communities study. J Clin Epidemiol 2003; 56: 565-571.
23. Chao HT, Kuo CD, Su YJ, Chuang SS, Fang YJ, Ho LT. Short-term effect of transdermal estrogen on autonomic nervous modulation in postmenopausal women. Fertil Steril 2005; 84: 1477-1483.
24. Christ M, Seyffart K, Wehling M. Attenuation of heart-rate variability in postmenopausal women on progestin-containing hormone replacement therapy. Lancet 1999; 353: 1939-1940.
25. Farag NH, Nelesen RA, Parry BL, Loredo JS, Dimsdale JE, Mills PJ. Autonomic and cardiovascular function in postmenopausal women: the effects of estrogen versus combination therapy. Am J Obstet Gynecol 2002; 186: 954-61
26. Fernandes EO, Moraes RS, Ferlin EL, Wender MC, Ribeiro JP. Hormone replacement therapy does not affect the 24-hour heart
rate variability in postmenopausal women: results of a randomized, placebocontrolled trial with two regimens. Pacing Clin Electrophysiol 2005; 28: S172-S177.
27. Kaya D, Cevrioglu S, Onrat E, Fenkci IV, Yilmazer M. Single dose nasal 17betaestradiol administration reduces sympathovagal balance to the heart in postmenopausal women. J Obstet Gynaecol Res 2003; 29: 406-411. 29. Mercuro G, Podda A, Pitzalis L, Zoncu S, Mascia M, Melis GB, et al. Evidence of a role of endogenous estrogen in the modulation of autonomic nervous system. Am J Cardiol 2000; 85: 787-789.
28. Ribeiro TF, Azevedo GD, Crescencio JC, Maraes VR, Papa V, Catai AM, et al. Heart rate variability under resting conditions in postmenopausal and young women. Braz J Med Biol Res 2001; 34: 871-877.
29. Weissman A, Lowenstein L, Porat M, Geva A, Rosenstein Y. The effect of hormone replacement therapy cessation on heart rate variability in postmenopausal women. Clin Auton Res 2005; 15: 411-413.
30. Hunt BE, Taylor JA, Hamner JW, Gagnon M, Lipsitz LA. Estrogen replacement therapy improves baroreflex regulation of vascular sympathetic outflow in postmenopausal women. Circulation 2001; 103: 2909-2914.
31. Sofowora GG, Singh I, He HB, Wood AJ, Stein CM. Effect of acute transdermal estrogen administration on basal, mental stress and cold pressor-induced sympathetic responses in postmenopausal women. Clin Auton Res 2005; 15: 193-199.
32. Vongpatanasin W, Tuncel M, Mansour Y, Arbique D, Victor RG. Transdermal estrogen replacement therapy decreases sympathetic activity in postmenopausal women. Circulation 2001; 103: 2903-2908.
33. Weitz G, Elam M, Born J, Fehm HL, Dodt C. Postmenopausal estrogen administration suppresses muscle sympathetic nerve activity. J Clin Endocrinol Metab 2001; 86: 344-348.
34. Ching HL, Watts GF, Dhaliwal SS, Barrett PH, Stuckey BG. Vascular function of forearm microcirculation in postmenopausal women with type 2 diabetes: potential benefit of hormone replacement therapy? Climacteric 2003; 6: 31-37.
35. Sanada M, Higashi Y, Nakagawa K, Tsuda M, Kodama I, Kimura M, et al. A comparison of low-dose and standard-dose oral estrogen on forearm endothelial function in early postmenopausal women. J Clin Endocrinol Metab 2003; 88: 1303-1309.
36. Lopez-Jaramillo P, Teran E, Molina G, Rivera J, Lozano A. Oestrogens and depression. Lancet 1996; 348: 135-136.
37. Hishikawa K, Nakaki T, Marumo T, Susuki H, Kato R, Saruta T. Up-regulation of nitric oxide synthase by estradiol in human aortic endotelial cells. FEBS 1995; 360: 291-293.
38. Stefano GB, Prevot V, Beavillain J-C, Cadet P, Fimiani C, Welters I, et al Cellsurface estrogen receptors mediate calciumdependent nitric oxide release in human endothelial cells. Circulation 2002; 101: 1594-1597.
39. Cerquetani E, Vitale C, Mercuro G, Fini M, Zoncu S, Rosano GM. Comparative vascular effects of hormone replacement therapy and raloxifene in women at increased cardiovascular risk. Gynecol Endocrinol 2004; 18: 291-298.
40. de Kleijn MJ, Wilmink HW, Bots ML, Bak AA, van der Schouw YT, Planellas J, et al. Hormone replacement therapy and endothelial function. Results of a randomized controlled trial in healthy postmenopausal women. Atherosclerosis 2001; 159: 357-365.
41. Gerhard M, Walsh BW, Tawakol A, Haley EA, Creager SJ, Seely EW, et al. Estradiol therapy combined with progesterone and endothelium-dependent vasodilation in postmenopausal women. Circulation 1998; 98: 1158-1163.
42. Girdler SS, Hinderliter AL, Wells EC, Sherwood A, Grewen KM, Light KC. Transdermal versus oral estrogen therapy in postmenopausal smokers: hemodynamic and endothelial effects. Obstet Gynecol 2004; 103: 169-180.
43. Guzic-Salobir B, Keber I, Seljeflot I, Arnesen H, Vrabic L. Combined hormone replacement therapy improves endothelial function in healthy postmenopausal women. J Intern Med 2001; 250: 508-515.
