Artículos Originales
Santiago Palacios*
* Director del Instituto Palacios de Salud y Medicina de la Mujer, Madrid, España. ipalacios@institutopalacios.com
Resumen
Por cada 1.000 mujeres entre 50 y 60 años existirán aproximadamente 5 fracturas de muñeca, dos fracturas vertebrales y 0,5 de cuello femoral, al año. Desde un punto de vista clínico, el riesgo de fractura de una mujer menopáusica se calcula a partir de su DMO y de los factores de riesgo clínico.
Las medidas generales de ejercicio físico, aporte adecuado de calcio, vitamina D y otros nutrientes, serán fundamentales y básicas para todas las mujeres menopáusicas.
El estudio WHI ha confirmado la eficacia y efecto protector de la THS en prevención primaria sobre el riesgo de fracturas (vertebrales, muñeca y cadera) (nivel de evidencia 1). Y en concreto sobre mujeres entre 50 y 60 años. La THS ha demostrado la disminución de la incidencia en prevención primaria de las fracturas vertebrales (nivel de evidencia 1).
La THS, los bifosfonatos, el raloxifeno y la tibolona, han demostrado un efecto preventivo de la pérdida ósea postmenopáusica medida por absorciometría. Pero ningún estudio con estos fármacos ha demostrado prevención del riesgo de fracturas asociado con la mujer exclusivamente osteopénica.
No existen estudios que demuestren la eficacia antifractura de la THS en mujeres osteoporóticas. Tanto los bifosfonatos (alendronato, risedronato) como el raloxifeno y el ranelato de estroncio han demostrado en mujeres osteoporóticas, definidas por criterios densitométricos, con o sin fracturas, una reducción de fracturas del orden del 30-50% a los tres años.
Palabras clave: Osteoporosis, menopausia, fármacos antiosteoporóticos, osteopenia.
Abstract
In a population of 1000 women aged between 50 and 60 years of age, could be posteriorly 5 wrist fractures, 2 fractures of spinal vertebrae and 0.5 fractures of femoral neck. From a clinical point of view, the risk of fracture of a postmenopausal woman we can obtain it from a basal BMD and the clinical risk factors.
Physical exercise, normal ingestion of calcium and vitamin D and other nutrients will be very important and basic in every postmenopausal women.
WHI study had confirmed the efficacy and protector effect of HRT on primary prevention of fracture risk (vertebrae, wrist and hip) (Evidence Level I). In women ranged 50 and 60 years of age HRT had showed low incidence in primary prevention of spinal fractures (Evidence Level I).
HRT, bisfosfonates, raloxifen, and tibolone had showed preventive effect on bone loss in postmenopausal women when had been measured by absorciometry. Any of the above studies had demonstrated prevention of the fracture risk associated with osteopenic postmenopausal women.
There are not studies about the efficacy of fracture prevention of TRH in osteoporotic women. Bisfosfonates (alendronate, risedronate) as raloxifen and stroncio ranelate had demonstrated a 30%-50% fractures reduction of in BMD osteoporotic women with o without previous fractures, in a period of 3 years.
Key words: osteoporosis, menopause, antiosporotic drugs, osteopenia.
Introducción
La pérdida ósea es un proceso ineludible del envejecimiento del tejido óseo que comienza a suceder alrededor de los 30 años. El proceso de pérdida ósea se acentúa con la menopausia.
Si la pérdida llega a un grado que afecta a la fragilidad hablamos de osteoporosis. De tal manera que se calcula una pérdida aproximadamente de 0,6 % anual en la premenopausia, un 1,6 en los 2 años anteriores a la menopausia, 2,4% anual a los 3 años que siguen a la menopausia; posteriormente la pérdida vuelve al 0,6 % anual. Sin embargo, hay que tener en cuenta la gran variabilidad entre individuos1-2 .
La definición de osteoporosis ha ido evolucionando con el conocimiento de la fisiología del hueso. Una de las definiciones más utilizadas es la de la conferencia Consenso de 1993. Así, la osteoporosis es la reducción de masa ósea asociada con rotura de micro arquitectura ósea, implicando una mayor fragilidad y una mayor susceptibilidad para las fracturas. Sin embargo, hoy se prefiere hablar de dos riesgos principales: densidad y calidad ósea. Esta última hace referencia a la arquitectura, el recambio, la acumulación de daño y a la mineralización del hueso. De tal manera que hoy se valora tanto la masa ósea como la calidad del hueso, aunque todavía no tengamos un “calidómetro” que cuantifique este aspecto del hueso. La principal complicación de la osteoporosis son las fracturas; por ello, la prevención es el objetivo terapéutico principal.
Epidemiología
La osteoporosis es una entidad directamente relacionada con la edad. Así, según la OMS, a los 50 años el 66% de las mujeres tienen una masa ósea normal, el 33% son osteopénicas, el 1% osteoporóticas y el 1% tienen osteoporosis establecida. A los 65 años estas cifras son: 40% normales, 40% osteopénicas, 13% osteoporóticas y 7% tienen osteoporosis establecida. Estos datos empeoran claramente a los 80 años, pues solo existe un 10% de mujeres con masa ósea normal, el 35% tienen osteopenia, el 27% osteoporosis y el 27% osteoporosis establecida. Las cifras en España son peores ya que la osteopenia en columna lumbar en mujeres de 50-59 años, es de 42% y de osteoporosis de 9,1%. Y suben a 50% y 24,3% respectivamente, cuando hablamos de mujeres entre 60 y 69 años3 .
La incidencia de fracturas en función de la edad se expone en la tabla 1, hay que tener en cuenta que se trata de población norteamericana4. En el grupo control de 50-60 años del estudio WHI con útero conservado, se observó una tasa de 16 fracturas por 1.000 mujeres año5.
Tabla 1. Incidencia de fracturas osteoporóticas en la población general por 1.000 mujeres año
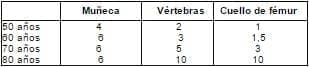
Para el riesgo de fractura de cuello de fémur, que es la que está más asociada a riesgo de mortalidad, podemos cifrar un riesgo de fractura en 10 años de 2,3% en la mujer de 60 años, de 3,5% en la mujer de 65 años, de 7,3% a los 70 años y de 11,7% a los 75 años6.
¿Cuándo hay riesgo de fractura?
El riesgo de fracturas puede ser estimado a partir de la densidad mineral ósea (DMO) y de los factores de riesgo clínicos de osteoporosis.
La única medida válida de osteoporosis es la densidad mineral ósea (DMO) por absorciometría. La densidad mineral ósea puede expresarse en términos absolutos medida en g/cm2 o en términos relativos como los puntajes T o Z. El puntaje expresa la DMO como el número de desviaciones estándar, por encima o por debajo de la media del valor de la DMO, de un adulto normal joven de 25-30 años y de raza caucásica. En el puntaje Z la comparación se establece entre la DMO individual y la DMO de individuos de la misma edad y sexo.
En esta clasificación se contemplan cuatro apartados: normalidad, baja masa ósea, osteoporosis y osteoporosis establecida. Se habla de normalidad cuando el valor de la DMO es superior a 1 desviación estándar por debajo de la media normal de adultos jóvenes puntaje T. Baja masa ósea u osteopenia hace referencia a cuando este valor está entre 1 y 2,5 desviaciones estándar por debajo de la media. Se considera osteoporosis a los valores inferiores a 2,5 desviaciones estándar por debajo de la media. Finalmente, osteoporosis establecida es cuando a esta situación se añade una fractura7. La disminución de una desviación estándar en un lugar específico multiplica por 2,5 el riesgo de fractura en ese mismo sitio6, 8. Una DMO inferior a –2,5 está asociada a un riesgo relativo de fractura de 4,09.
Otros diagnósticos complementarios de la DMO, son los marcadores de remodelado óseo. Los marcadores de remodelado óseo son sustancias procedentes de la actividad metabólica de las células óseas liberadas en el proceso de resorción y formación ósea. Pueden ser enzimas (fosfatas alcalinas, fosfatasa ácida tartrato resistente), fragmentos proteicos (telopéptidos del colágeno), aminoácidos o péptidos con función reguladora del proceso de remodelado (osteocalcina, osteopontina, etc.). Su cuantificación va a dar información de la actividad metabólica del hueso, tanto en su vertiente de resorción como de formación.
Aunque estos parámetros han sido correlacionados con la pérdida de la masa ósea en la postmenopausia10 y con el riesgo de fractura11, las grandes diferencias individuales y la variabilidad de sus medidas biológicas (5-10%), hacen que su utilización en la práctica clínica sea limitada.
Los factores de riesgo clínico más significativos a tener en cuenta para la indicación de una densitometría son: antecedentes personales de fractura, antecedentes familiares de fractura osteoporótica, un índice de masa corporal por debajo de 19 kg/m2, una menopausia precoz (por debajo de 40 años), y una terapia prolongada con corticoides. Se ha sugerido que el diagnóstico y tratamiento de la osteopenia y osteoporosis deberían depender de la valoración del riesgo base y no sólo de la puntuación T. Si se consideran los factores de riesgo conjuntamente con la masa ósea, probablemente mejoraría la capacidad de predecir el riesgo de fractura.
El estudio NORA (National Osteoporosis Risk Assesment)9 ha evaluado la relación existente entre la medición periférica de la masa ósea en mujeres, con los factores de riesgo de osteoporosis y la aparición de fracturas a corto plazo. El trabajo evalúa a más de 200.000 mujeres mayores de 50 años sin diagnóstico previo de osteoporosis, observándose que el 39,6% tenía osteopenia y el 7,2% tenía osteoporosis. Los principales factores de riesgo asociados fueron la edad, la historia de fractura, la raza, el tabaquismo y la toma de corticoides. Por otra parte, un índice alto de masa corporal, la raza negra, el uso de estrógenos o diuréticos, el ejercicio o el consumo de alcohol, son factores que aumentan la masa ósea. La presencia de osteoporosis aumentó el riesgo de fractura 4 veces con respecto al de la masa ósea normal, y la de osteopenia se asoció con un aumento del riesgo de 1,8 veces.
Medidas generales para todas las pacientes
Ejercicio Físico
Un meta-análisis de la Cochrane Library12 ha analizado 18 estudios aleatorios en mujeres de 45-70 años que han practicado un ejercicio físico, aeróbico o programas de musculación durante 1 ó 2 años. Se ha encontrado un aumento de la DMO a nivel de columna lumbar (+1,79% [0,58-3,01]). El ejercicio aeróbico también aumentaba la DMO a nivel femoral (+1,22% [0,71-1,74]). Los efectos de la marcha no fueron significativos a nivel de columna lumbar (+1,31% [–0,03-2,65]), pero sí fueron significativos a nivel del cuello femoral (+0,92% [0,21-1,64]). Ningún efecto significativo se observó sobre las fracturas. Dados estos resultados y otros efectos positivos conocidos del ejercicio físico, parece claro que deben realizarse y adaptarse a la vida cotidiana de todas las personas de esta edad.
Calcio
Un meta-análisis realizado por la Cochrane Library sobre 15 estudios en un total de 1.806 mujeres menopáusicas, ha analizado el efecto del calcio sobre la prevención de la pérdida de masa ósea y de las fracturas osteoporóticas13-14. Los autores encuentran un efecto positivo significativo sobre la densidad mineral ósea en casos de prevención secundaria (DMO + 1,66% [0,92-2,39]) y no significativa para la prevención primaria (+1,06% [–0,44-2,56]). Se han observado unos efectos positivos pero no significativos sobre la prevención secundaria de las fracturas vertebrales (RR= 0,77 [0,54-1,09]) y no vertebrales (RR= 0,86 [0,43-1,72]).
Vitamina D
Se ha realizado un meta-análisis sobre un total de 25 trabajos que analizan el papel de la vitamina D sobre la prevención de la osteoporosis15.
La vitamina D reduce la incidencia de fracturas vertebrales de manera significativa (RR= 0,63 [045-0,88]), aunque el efecto protector sobre las fracturas no vertebrales fue no significativo (RR= 0,77 [0,57-1,04]).
Otras medidas nutricionales: Magnesio
La buena calidad ósea depende también de una adecuada nutrición en proteínas, minerales y oligoelementos. Así por ejemplo, es indispensable la ingesta de vitamina “C”, necesaria para la formación de colágeno, y la vitamina “K” para la osteogénesis. El magnesio es un mineral intracelular. Cerca del 60% del magnesio corporal está depositado en nuestros huesos. El déficit de magnesio es muy común, especialmente en mujeres con hipermenorrea y/o metrorragias, y en ancianos. Además existen otras causas que facilitan el déficit de magnesio, como el uso de diuréticos y el alcohol.
Muchas de las mujeres que sufren de osteoporosis tienen un contenido óseo de magnesio más bajo de lo normal16. En estos casos el suplemento de magnesio es de gran ayuda.
Actuación sobre mujeres Menopáusicas en buen estado de Salud y sin factores de riesgo
THS
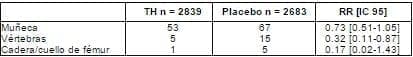
El estudio WHI de tratamiento con estrógenos y gestágenos, realizado en 16.608 mujeres no histerectomizadas17, señala que el uso de THS en mujeres menopáusicas en buen estado de salud y sin factores de riesgo de osteoporosis, tiene un claro efecto antifractura, en todos los lugares relacionados con la osteoporosis (tabla 2). Si consideramos sólo el subgrupo de 50-59 años, no se puede objetivar una significación estadística, debido al escaso número de fracturas existente en esta población, excepto en las fracturas vertebrales (tabla 3).
Tabla 2. Riesgo relativo de fracturas en población sana relacionadas con la TH (estudio WHI estrógenos-gestágenos)
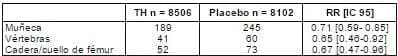
Tabla 3. Riesgo relativo de fracturas en población sana de 50-60 años con TH (estudio WHI estrógenos-gestágenos)
El estudio WHI, con estrógenos solos, aporta resultados similares sobre una población de 10.736 mujeres histerectomizadas (tabla 4)
Tabla 4. Riesgo relativo de diferentes fracturas en población histerectomizada (estudio WHI estrógenos-gestágenos)
![]()
Por otra parte un meta-análisis realizado sobre 22 estudios aleatorios de THS versus placebo18, cuyo objetivo principal fue el análisis del efecto hormonal sobre la DMO, en más de 8.000 mujeres, concluyó que el riesgo relativo de fracturas no vertebrales fue de 0,73 (0,56-0,94). Sin embargo, al no ser objetivo principal las fracturas, el nivel de evidencia es 2.
Otras alternativas
No existe ninguna publicación que analice el riesgo de fracturas tras la utilización de alguna terapia diferente a la THS en mujeres con buen estado de salud y sin riesgo de osteoporosis.
Actuación sobre mujer Menopáusica Osteopénica
THS
Un meta-análisis de 57 estudios aleatorizados entre THS y placebo19, indica que la ganancia de DMO, en columna lumbar, es constante con dosis estándar. La ganancia varía al cabo de tres años entre 1 y 6%, dependiendo de los estudios (nivel de evidencia 1). El estudio PEPI21, sugiere que la ganancia se produce el primer año, y que posteriormente se produce una estabilización. Los estudios no permiten evidenciar el papel de los gestágenos, del tipo y vía de los estrógenos, ni de la modalidad de esquema terapéutico19.
Raloxifeno
Existe un meta-análisis basado en 7 ensayos clínicos sobre el efecto del raloxifeno en la prevención y tratamiento de la osteoporosis21.
En general, en los ensayos tanto de prevención como de tratamiento, se ha observado un aumento significativo de la DMO a nivel de columna lumbar (prevención primaria+1.72% [1,32-2,11]). La disminución del riesgo de fractura ha sido demostrada esencialmente en protocolos de tratamiento.
Tibolona
Dos estudios22-23 realizados con 91 y 107 mujeres menopáusicas, y durante dos años, con una dosis de 2,5 mg/día, han concluido que existe un aumento de la DMO lumbar (+ 5,7% y 7,2% versus +0,4 y +0,9% en los grupos con tibolona versus placebo) y de cuello de fémur (+2,6% versus –1,6%). Los marcadores de resorción y de formación ósea también están disminuidos.
Bifosfonatos
Risedronato
Existe un meta-análisis sobre 8 ensayos realizados con risedronato para el tratamiento de la osteoporosis24. Los efectos observados sobre la DMO proceden tanto de protocolos de prevención como de tratamiento, por ejemplo, a nivel de columna lumbar se ha observado un efecto de prevención primaria con un aumento de la DMO de +4,71% (3,74-5,56).
La disminución del riesgo de fracturas proceden esencialmente de los protocolos de tratamiento. Los estudios de prevención primaria no aportan resultados significativos sobre fracturas.
Alendronato
Los datos de un meta-análisis sobre 11 ensayos clínicos25 con alendronato, en relación a la DMO, se basan en resultados tanto de protocolos de prevención, como de tratamiento. Así, a nivel de columna lumbar se ha observado en prevención primaria un aumento de la DMO de +8,05 (7,06-9,05). La disminución del riesgo de fracturas ha sido fundamentalmente basada en protocolos de tratamiento. Los ensayos solo de prevención primaria no aportan resultados significativos sobre reducción de fracturas.
Actuación sobre mujeres Menopáusicas Osteoporóticas con o sin fracturas
THS
No existe ningún estudio de eficacia suficiente sobre mujeres osteoporóticas con o sin fracturas.
Raloxifeno
Estudio MORE26. La eficacia antifractura vertebral ha sido demostrada sobre 7.705 mujeres osteoporóticas, con y sin fracturas (puntaje T <–2,5), la edad media ha sido de 65 años, y el tratamiento ha durado 4 años. El riesgo relativo de fracturas vertebrales con raloxifeno ha sido de 0,60 (0,50-0,70). No se ha demostrado efecto protector significativo sobre fracturas periféricas. (RR= 0,92 [0,79-1,07]). (Nivel de evidencia 1).
Risedronato
Estudio VERT27-28 . La eficacia antifractura se ha basado en estos dos ensayos con 2.458 y 1.226 mujeres osteoporóticas, con y sin fracturas (puntaje T <–2.5). La edad media ha sido de 69 y 71 años y la duración del tratamiento ha sido de tres años. En estos dos estudios el riesgo de fracturas vertebrales ha sido RR= 0,64 (0,47-0,87) y 0,60 (0,44-0,80) y el RR de fracturas periféricas ha sido de 0,64 (0,42-0,98) y 0,71 (0,47-1,06).
Alendronato
Estudio FIT29. En este ensayo se ha comprobado la eficacia antifractura en 2.027 mujeres osteoporóticas, con y sin fracturas (puntaje T <–2,5). La edad media ha sido de 71 años y el tratamiento ha durado 3 años. El RR de fracturas vertebrales con alendronato ha sido de 0,53 (0,41-0,69) y sobre las fracturas periféricas de 0,72 (0,58-0,90).
Ranelato de Estroncio
Estudio SOTI30 El ensayo ha sido realizado en 1.649 mujeres osteoporóticas con o sin fracturas (puntaje T <–2,5). Con una edad media de 69,7 años y una duración del tratamiento de tres años. Los resultados han demostrado una reducción del riesgo de fractura vertebral de RR= 0,59 (0,48-0,73). En este estudio no se ha podido demostrar efecto protector significativo sobre fracturas periféricas.
PTH 1-34 Recombinante Humana
En el estudio de Neer y cols.31 se comparan dos dosis de PTH (20 microgr y 40 microgr) versus placebo en mujeres postmenopáusicas con puntaje T < 2,6 y con fracturas vertebrales (media 2,3 fracturas). El ensayo se realizó en 1.636 mujeres durante 19 meses. Los resultados demostraron una reducción del RR de fractura vertebral de 0,35 (0.22-0.55) en el grupo con 20 µg y de 0,31 (0.19-0.50) en el grupo con 40 µg. Las fracturas no vertebrales se redujeron en los grupos terapéuticos RR 0,47 (0.25-0.88) y RR 0,46 (0.25-0.86) respectivamente.
Conclusión
Pot cada 1.000 mujeres entre 50 y 60 años existirán aproximadamente 5 fracturas de muñeca, dos fracturas vertebrales y 0,5 de cuello femoral, al año. Desde un punto de vista clínico, el riesgo de fractura de una mujer menopáusica se calcula a partir de su DMO y de los factores de riesgo clínico.
Las medidas generales de ejercicio físico, aporte adecuado de calcio, vitamina D y otros nutrientes, serán fundamentales y básicas para todas las mujeres menopáusicas.
El estudio WHI ha confirmado la eficacia y efecto protector de la THS en prevención primaria sobre el riesgo de fracturas (vertebrales, muñeca y cadera) (nivel de evidencia 1). Y en concreto sobre mujeres entre 50 y 60 años.
La THS ha demostrado la disminución de la incidencia en prevención primaria de las fracturas vertebrales (nivel de evidencia 1).
La THS, los bifosfonatos, el raloxifeno y la tibolona, han demostrado un efecto preventivo de la pérdida ósea postmenopáusica medida por absorciometría. Pero ningún estudio con estos fármacos ha demostrado prevención del riesgo de fracturas asociado con la mujer exclusivamente osteopénica.
No existen estudios que demuestran la eficacia antifractura de la THS en mujeres osteoporóticas.
Tanto los bifosfonatos (alendronato, risedronato) como el raloxifeno y el ranelato de estroncio han demostrado en mujeres osteoporóticas, definidas por criterios densitométricos, con o sin fracturas, una reducción de fracturas del orden del 30-50% a los tres años.
Referencias
1. Pouilles JM, Tremollieres F, Robot C. Vertebral bone loss in perimenopause. Results of a 7-year longitudinal study. Presse Med 1996; 25(7): 277-280.
2. Chapurlat RD, Gamero P, Somay-Rendu E, Arlot ME, Claustrat B, Delmas PD. Longitudinal study of bone loss in pre- and perimenopausal women: evidence for bone loss in perimenopausal women. Osteoporos Int 2000; 11(6): 493-498.
3. Díaz Curiel et al. Med Clin 2001; 116: 86- 88.
4. Melton LJI, Chrischilles EA, Cooper C, Lane AW, Riggs BL Perspective. How many women have osteoporosis? J Bone Miner Res 1992; 7(9): 1005-1010.
5. Cauley JA, Robbins J, Chen Z, Cummings SR, Jackson RD, LaCroix Az et al. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women’s Health Iniatiative randomized trial. JAMA 2003; 290(13): 1729-1738.
6. Kanis J, Johnell O, Oden A, Dawson A, de Laet C, Jonsson B. Ten years probabilities of osteoporotic fractures according to BMD and diagnostic thresholds, Osteoporos Int 2001; 12: 989-995.
7. Organisation mondiale de la santé. Évaluation du risque de fracture et son application au dépistage de l’osteoporose pré-ménopausique. Genève: OMS; 1994.
8. Kanis JA. Diagnosis of osteoporosis and assessment of fracture risk. Lancet 2002; 359(9321): 1929-1936.
9. Siris E, Miller P, Barett-Connor E, Faulkner K, Werthen L, Abbott T et al. Identification and fracture outcomes of undiagnosed low bone mineral density in post-menopausal women. JAMA 2001; 286: 2815-2822.
10. Christiansen C, Christensen MS, Transbol I. Bone mass in postmenopausal women after withdrawal of estrogen/gestagen replacement therapy. Lancet 1981; 1(8218): 459-461.
11. Garnero P, Sornay-Rendu E, Claustrat B, Delmas PD. Biochemical markers of bone turnover, endogenous hormones and the risk of fractures in postmenopausal women: the OFELY study. J Bone Miner Res 2000;15(8):1526-1536.
12. Bonaiuti D, Shea B, Lovine R, Negrini S, Robinson V, Kemper H et al. Exercise for preventing and treating osteoporosis in postmenopausal women (Cochrane Review). In: The Cochrane Library. Chichester (UK): John Willey and Sons Ltd; 2004.
13. Shea B, Wells G, Cranney A, Zytaruk N, Robinson V, Griffith L et al. Calcium supplementation on bone loss in postmenopausal women (Cochrane Review). In: The Cochrane Library. Chichester (UK): John Willey and Sons Ltd; 2004.
14. Shea B, Wells G, Cranney A, Zytaruk N, Robinson V, Griffith L et al. Meta-analyses of therapies for postmenopausal osteoporosis. Endocr Rev 2002; 23(4): 552- 559.
15. Papadimitropoulos E, Wells G, Shea B, Gillepsie W, Weaver B, Zytaruk N et al. Meta-analyses of therapies for postmenopausal osteoporosis. VIII: meta-analysis of the efficacy of vitamin D treatment in preventing osteoporosis in postmenopausal women. Endocr Rev 2002; 23(4): 560-569.
16. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288(3): 523-534.
17. The Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. The women’s health initiative randomized controlled trial. JAMA 2004; 291(14): 1701-1712.
18. Torgerson DJ, Bell-Syer SE. Hormone replacement therapy and prevention of nonvertebral fractures: a meta-analysis of randomized trials. JAMA 2001; 285(22): 2891-2897.
19. Wells G, Tugwell P, Shea B, Guyatt G, Peterson J, Zytaruk N et al. Meta-analyses of therapies for postmenopausal osteoporosis. V. Meta-analysis of the efficacy of hormone replacement therapy in treating and preventing osteoporosis in postmenopausal women. Endocr Rev 2002; 23(4): 529-539.
20. Effects of hormone therapy on bone mineral density: results from the postmenopausal estrogen/progestin interventions (PEPI) trial. The writing group for the PEPI. JAMA 1996;276(17):1389-96
21. Cranney A, Tugwell P, Zytaruk N, Robinson V, Weaver B, Adachi J et al Meta-analyses of therapies for postmenopausal osteoporosis. IV. Meta-analysis of raloxifene for the prevention and treatment of postmenopausal osteoporosis. Endocr Rev 2002; 23(4): 524-528.
22. Bjarnason NH, Bjarmason K, Haarbo J, Rosenquist C, Christiansen C. Tibolone: prevention of bone loss in late postmenopausal women. J Clin Endocrinol Metab 1996; 81(7): 2419-2422.
23. Pavlov PW, Ginsburg J, Kicovic PM, van der Schaff DB, Prevelic G, Bennink HJ. Double-blind, placebo-controlled study of the effects of tibolone on bone mineral density in postmenopausal osteoporotic women with and without previous fractures. Gynecol Endocrinol 1999; 13(4): 230-237.
24. Cranney A, Tugwell P, Adachi J, Weaver B, Zytaruk N, Papaioannou A et al. Metaanalyses of therapies for postmenopausal osteoporosis. III. Meta-analysis of risedronate for the treatment of postmenopausal osteoporosis. Endocr Rev 2002; 23(4): 517-523. 25. Cranney A, Wells G, Willan A, Griffith L, Zytaruk N, Robinson V et al. Meta-analyses of therapies for postmenopausal osteoporosis.
II. Meta-analysis of alendronate for the treatment of postmenopausal women. Endocr Rev 2002; 23(4): 508-516.
26. Ettinger B, Black DM, Mitlak BH, Knickerbocker RK, Nickelsen T, Genant HK et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes os Raloxifene Evaluation (MORE) Investigators. JAMA 1999; 282(7): 637-645.
27. Harris ST, Watts NB, Genant HK, McKeever CD, Hangartner T, Keller M et al. Effects of risedronate treatment on ver234 tebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. JAMA 1999; 282(14): 1344-1352.
28. Reginster J, Minne HW, Sorensen OH, Hooper M, Roux C, Brandi ML et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Osteoporos Int 2000; 11(1): 83-91.
29. Black DM, Cummings SR, Karpf DB, Cauley JA, Thompson DE, Nevitt MC et al. Randomized trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet 1996; 348(9041): 1535-1541.
30. Meunier P J , Roux C, Seeman E et al. The effects of stroncium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004; 350: 459-468.
31. Neer R, Arnaud C, Zanchetta JR ,Prince R, Gaich GA, Regenster JY et al. Effect of parathyroid hormone/1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344: 1434-1441.
