Contribuciones Originales
William Onatra*
* MD. Ginecólogo-Endocrinólogo. Profesor Universidad Nacional de Colombia. Docente de Ginecología y Obstetricia. Universidad de Ciencias Aplicadas y Ambientales. Bogotá.
Resumen
La progesterona natural y sus derivados sintéticos son sustancias de gran importancia en los procesos reproductivos, por lo cual se incluyen en tratamientos hormonales tales como la anticoncepción y durante la menopausia. Los diversos compuestos progestacionales, según su estructura química y la de sus predecesores, tienen diversos efectos sobre tejidos como la mama y el endometrio, por ejemplo. La potencia progestacional de cada compuesto varía, según su estructura química y puede ser medida por diversos métodos de evaluación, tales como la prueba de Kaufmann y la de Clauberg. Los progestágenos ejercen funciones diversas, generales y específicas sobre los diversos órganos y sistemas. Existen diversas presentaciones de los progestágenos y su administración puede ser por diversas vías (oral, transdérmica, intramuscular, transvaginal e intrauterina). Diversos estudios (CHART, PEPI, HOPE, WHI) han demostrado el efecto benéfico de la terapia de suplencia hormonal sobre la masa ósea administrada en dosis convencionales, efecto que no se ha demostrado aún con dosis bajas de THS.
Palabras clave: Progestágenos, THS, densidad de masa ósea, dosis bajas de THS.
Abstract
Natural and synthetic progesterone are substances with important influence on reproductive processes. They are of very common using alone or combined with estrogens as birth control and for relief of menopausal symptoms. Progestagenic compounds produce diverse effects on reproductive tissues as mammary gland and endometrium, depending on their chemical structure. Progestagenic potency also varies according to the chemical structure, which can be determined by different test like Kaufmann´s and Clauberg´s test. Progestagens may also have general and specific effects on different organs and systems. They are available in different presentations as oral, transdermal, intravaginal or intrauterine route. Recent studies (CHART, PEPI, HOPE, WHI), have demostrated a positive effect of HRT on bone mass when used at conventional doses, and effect which has not been so far observed with lowdose HRT regimes.
Key words: Progestagens, HRT, bone-mass density, low-dose HRT.
Presentación
Marzo 13 del 2003 durante el V Congreso Colombiano de Menopausia en Bogotá.
Mayo 28 del 2003 durante el Congreso Colombiano de Osteoporosis en Cartagena.
Tema: Diferencias entre los diversos progestágenos y sus vías de administración.
Coordinadores: William Onatra*, Israel Díaz**, Álvaro Monterrosa***, Ernesto Moscoso****.
* MD. Ginecólogo-Endocrinólogo. Profesor Universidad Nacional de Colombia. Docente de Ginecología y Obstetricia. Universidad de Ciencias Aplicadas y Ambientales. Bogotá.
** MD. Ginecología-Obstetricia. Unidad de Menopausia y Osteoporosis. Profesor Universidad San Martina área de Ginecología y Obstetricia. Miembro del Comité de Ética Universidad del Norte. Barranquilla.
*** MD. Ginecología y Obstetricia. Profesor Titular, Facultad de Medicina, Universidad de Cartagena. Presidente de la Asociación Colombiana de Menopausia. Miembro de la Academia de Medicina de Cartagena.
**** MD. Endocrinólogo. Hospital San José, Clínica Reina Sofía. Bogotá.
I. Definición de Progestágeno
Esteroide activo capaz de inducir efectos progestacionales en útero de ratas inmaduras y/o ovariectomizadas, previamente sensibilizadas con estrógenos.
La progesterona se ha aislado de tejido ovárico, placentario, testicular y suprarrenal. Sus receptores se han encontrado en cerebro, músculo, glándula mamaria, hueso, tejido adiposo, riñón, aparato respiratorio y digestivo.
II. Aspectos Históricos
Tabla 1. Aspectos históricos.

III. Farmacocinética de los Progestágenos
Composición química. La progesterona es la principal hormona del cuerpo lúteo. Es un derivado del grupo pregnano, sustancia de 21 carbonos y de la delta 5 pregnenolona.
Metabolismo. La progesterona se forma a partir del colesterol y por diferentes pasos enzimáticos forma testosterona (T) y estradiol (E2) en el tejido ovárico y la suprarrenal1. Fig. 1.
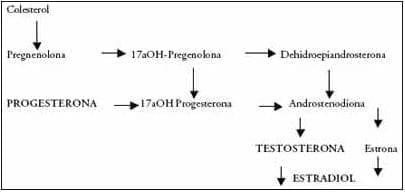
Figura 1. Biosíntesis de la progesterona.
Mecanismo de acción. El mecanismo de acción es similar al de todos los esteroides a nivel celular. Para transporte por vía sanguínea se une a una globulina transportadora (SHBG) en receptores específicos de la célula blanco (se han descrito 2 tipos de receptores: alfa y beta) y se acopla al receptor desencadenando un estímulo en el mecanismo de cascada de la fosforilación formando un complejo Hormona-Receptor (HR). Este HR activa los receptores nucleares de la adenilciclasa nuclear, produciendo una defosforilación y traslocación a nivel nuclear, modificando las proteínas del ADN con activación de la ARN polimerasa lo cual inicia el fenómeno de transcripción. El ADN activado por metilación desencadena la orden para que el ARN mensajero viaje hacia los ribosomas y produzca la respuesta deseada3.
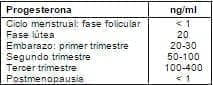
Mediciones. La medición de la progesterona se hace en la actualidad indirectamente con la citología vaginal, biopsia de endometrio, (secretor), metabolitos en orina y en plasma por radioinmunoanálisis, véase la tabla 2.
Tabla 2. Medición de progesterona por radioinmunoanálisis.
IV. Clasificación
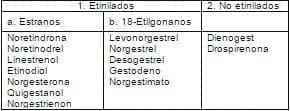
De acuerdo con el último Consenso de la Asociación Norteamericana de Menopausia, los progestágenos4,6 se clasifican como lo muestra la tabla 3.
Gestágenos
Tabla 3. Clasificación de los progestágenos.
A. Estructuralmente relacionados con la progesterona.

B. Estructuralmente relacionados con la testosterona.
V. Potencia de los Progestágenos
Para conocer la potencia de una sustancia se hace necesario medir la actividad biológica específica comparada con un estándar. Existen 27 diferentes medidas para conocer los efectos de los progestágenos, pero sólo hay 3 evaluaciones aceptadas: a) ensayos de unión in vitro a un receptor b) los bioensayos y c) los test clínicos5.
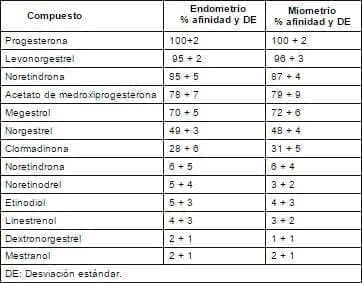
a) En la primera de estas evaluaciones la afinidad a un receptor, el receptor de progesterona, está determinada por la concentración del esteroide, el cual corresponde al 50% de la inhibición de la unión (IC50) del progestágeno marcado o tritiado, al receptor. La progesterona se ha catalogado como el prototipo en consideración. La evaluación se hace en endometrio humano y miometrio en mujeres que se sometieron a histerectomía. (Tabla 4).
Tabla 4. Porcentaje de afinidad del receptor de progesterona por el tejido uterino humano.
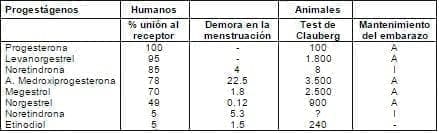
b) El mejor bioensayo es de Clauberg, en el cual la progesterona es administrada a conejas inmaduras e impregnada de estrógenos. La dosis de progesterona, necesaria para completar la transformación del endometrio, determina la potencia del progestágeno (test de Kaufman). Al resumir los estudios experimentales en humanos como el porcentaje de unión al receptor, demora de la menstruación, bioensayo en animales, test de Clauberg y mantenimiento del embarazo5 (tabla 5) podemos concluir que: el acetato de medroxiprogesterona (MPA) y el megestrol han mostrado ser más potentes, seguidos de levonorgestrel, noretisterona (NETA) y etinodiol. Los nuevos progestágenos, como el gestodeno y el desogestrel parecen ser 5 a 10 veces más potentes que la noretisterona. Un problema con estas determinaciones es la pobre estandarización y que los hallazgos en animales no se pueden extrapolar a los humanos.
Tabla 5. Actividad comparativa de varios progestágenos en diferentes ensayos experimentales.
B. Estructuralmente relacionados con la testosterona.
Gestágenos
A. Estructuralmente relacionados con la progesterona.
c) Las pruebas clínicas más utilizadas son la determinación de la dosis mínima para inhibir la ovulación (test de Kaufman) y la demora en la menstruación (test de Greenblatt). Tabla 6.
Tabla 6. Dosis mínima de inhibición de la ovulación de varios progestágenos en mujeres y transformación endometrial de acuerdo al test de Kaufmann.

En el test de Greenblatt el progestágeno se administra por 7 días después de la ovulación, por 3 semanas. El sangrado ocurre 2 a 3 días después de terminar el progestágeno. La dosis (D50), requerida en el 50% de los casos muestra que es de 4 mg para la NETA y norgestrel y de 22 mg para la MPA. Con la adición de un estrógeno la ED50 disminuye 30 veces con norgestrel a 0.125 mg, pero sólo 5 veces con NETA a 0.9 mg. En general, los C21 son pobres inhibidores comparados con los C19.
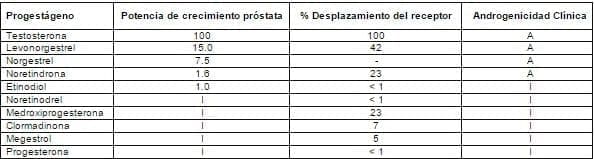
d) Potencial androgénico. Otra forma de evaluar los progestágenos ha sido medir su potencial androgénico, por el test de unión al receptor de andrógenos y un bioensayo de respuesta de crecimiento ventral en la próstata de ratas jóvenes castradas, con diferentes progestágenos2 (tabla 7). Estos datos demuestran que la testosterona tiene la actividad más potente y que el levonorgestrel es dos veces más potente que el norgestrel y 10 a 15 veces más que la noretindrona y el etinodiol. El noretinodrel, MPA, clormadinona megestrol y la progesterona, muestran una pobre actividad androgénica
Tabla 7. Actividad de diferentes progestágenos sobre la unión al receptor y crecimiento prostático.
VI. Funciones
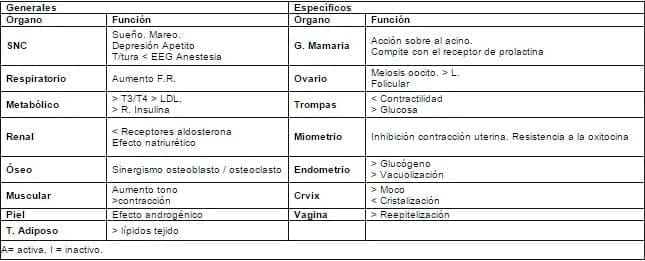
Las funciones de la progesterona se pueden dividir en generales y específicas, véase la tabla 8.
Tabla 8. Funciones de la progesterona.
VII. Vías de Administración
Los progestágenos tienen diferentes vías de administración:
Oral: tabletas, cápsulas o líquido.
Transdérmica: tópica, parches (sola o combinada con estrógenos) gel o crema.
Vagina: gel u óvulos.
Intramuscular: ampollas.
Rectal: supositorios.
Implantes: subcutáneos.
Intrauterino: (DIU).
VIII. Presentaciones
Los productos en el mercado colombiano se muestran en las tablas 9 a 16 de las páginas siguientes.
Tabla 9. Gestágenos vía oral.

Tabla 10. Gestágenos combinados orales anticonceptivos.

Tabla 11. Gestágenos combinados orales no anticonceptivos.

Tabla 12. Gestágenos transdérmicos combinados.
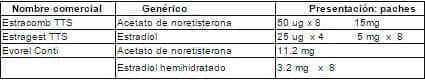
Tabla 13. Gestágenos solos IM.

Tabla 14. Gestágenos combinados IM.
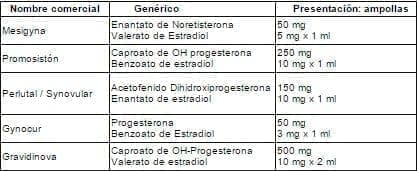
Tabla 15. Gestágenos implantes.
![]()
Tabla 16. DIU.
![]()
IX. Estudios clínicos sobre Progestágenos y Hueso
El estudio clásico de Lindsay en 19847 demostró que la dosis de 0.625 de EEC mantenía la densidad mineral ósea (DMO) y que al suspenderla perdía el efecto benéfico, con disminución a los 2 meses de la densidad ósea. Al mejorar las técnicas radiológicas aparece la absorciometría dual de Rx (DEXA), la cual detecta cambios del 5-20% a nivel de columna, después de 3 años de tratamiento, y un incremento del 1.5% en la DMO del metacarpo8-9. Trabajos posteriores con estradiol micronizado10 y otras hormonas calciotrópicas mostraron que prevenían el riesgo de fractura11. La vía transdérmica demostró un aumento de la DMO tanto en columna como en fémur12. Los estudios con bajas dosis han sido controversiales. Genant13 demostró que los estrógenos esterificados de 0.3 mg/día por 24 meses, combinados con suplemento de calcio, incrementaban la DMO comparados con el placebo. El estudio de hormonas continuas como Terapia de Reemplazo (CHART)14, se realizó en mujeres con 1 a 4 años después de la menopausia, con promedio de edad de 53 años, quienes recibieron dosis de etinil estradiol (1.0, 2.5, 5 y 10 ug/d) sin oposición continua combinada agregando acetato de noretindrona (0.2, 0.5, y 1mg/d) más suplemento de calcio por 2 años. Este estudio no demostró incremento de la DMO. Se observó aumento de la DMO en las mujeres que recibieron etinil estradiol a dosis de 5 o 10 ug, sin aumento de la DMO cuando se les agregó NETA.
Hay evidencia de otros estudios aleatorizados, multicéntricos, contra placebo, en seguimiento a 3 años, como el estudio PEPI15, que evalúa mujeres de 1 a 10 años de postmenopausia, promedio de edad 56 años, quienes recibieron EEC 0.625 mg día sin oposición y AMP 2.5 mg día, continua o cíclica 10 mg por 12 días, o progesterona micronizada 200 mg por 12 días/mes. La DMO medida por DXA, a nivel de columna y fémur y cadera después de 3 años, muestra un aumento del 5.1% en columna sin diferencias en columna o fémur con el resto de presentaciones de estrógenos solos o con progestágenos.
El estudio HOPE16, prospectivo, aleatorizado, multicéntrico, que incluyó 2.805 mujeres postmenopáusicas, con promedio de edad de 52 años, compara los efectos a nivel de hueso con varias dosis de EEC (0.3, 0.45, y 0.625 mg/día) solos o con oposición de AMP (1.5,2.5 mg/día) durante 2 años. El aumento de 1% al nivel de columna se observa en el grupo que recibió 0.625 mg solos y a los que se les agregó 2.5 mg AMP, confirmando los hallazgos del estudio PEPI. No hubo incremento de DMO en cadera o cuerpo total cuando se añadió 1.5 ó 2.5 de AMP. El presente estudio confirma las observaciones anteriores, que indican que la baja dosis tiene una pobre respuesta sobre el hueso a largo plazo.
El estudio WHI17 (Women’s Health Initiative), es un estudio orientado a definir riesgos y beneficios de la THR y el potencial de reducir la enfermedad cardíaca, el cáncer de mama y colon-rectal, y las fracturas en mujeres postmenopáusicas. Se reclutaron 161.809 mujeres postmenopáusicas entre 1993 y 1998. Un grupo control se manejó con dieta baja en grasa, calcio y Vitamina D. Otro grupo con estrógenos conjugados (0.625 mg) y otro con E. conjugados 0.625 mg /AMP. 2.5 mg. Al evaluar el riesgo de fractura después de 5.2 años se encuentra que el riesgo relativo fue de 0.83 (0.45- 0.98). Ello evidencia que estas dosis previenen lesiones del hueso en este grupo etario.
Otros estudios Descriptivos
En un meta-ánalisis18 sobre el efecto de la TRH sobre la DMO y la fractura en mujeres postmenopáusicas, se analizaron artículos reportados en Medline y Embase de 1966 a 1999. Se incluyeron 57 estudios controlados aleatorizados contra placebo o calcio y vitamina D, mínimo 1 año de duración, sólo 6 de estos estudios reportaron aumento de la DMO y disminución del riesgo de fractura. En síntesis, la THR reduce la incidencia de fracturas vertebrales RR. 0.66 con 95% de Intervalo de confianza (CI) 0.41-1.07, en 6 estudios para fracturas no vertebrales el que RR 0.87 95% CI (0.71-1.08). La diferencia entre la THR y los controles en DMO a los 2 años fue de 6.76 (5.83-,7.89; 212 estudios) a nivel lumbar 4.53 (3.68,5.36; 14 estudios) y a nivel de antebrazo y cuello de fémur 4.12 (3.45, 4.80, 9 ensayos).
En resumen, se puede afirmar que la THR tiene un efecto positivo a nivel de todas sus estructuras, sin diferencias significativas en reducir la incidencia de fracturas vertebrales y no vertebrales.
El Dr. B. Moreno ha realizado un amplio análisis de los estudios clínicos, el cual aparece en otro número de esta revista19.
Auspiciado: Asociación Colombiana de Osteología y Metabolismo Mineral. Asociación Colombiana de Menopausia.
Referencias
1. Onatra W. Endocrinología Ginecológica: Fisiología. Universidad Nacional de Colombia. Gráficas Carman. Bogotá. 1990; 105-111.
2. O’Dowd M,Philipp E. Historia de la Ginecología y Obstetricia. Parthenon Publi. Group. London. England. 1995; 211-239.
3. Briggs M. Contraceptive steroid binding uterine progesteron receptor. Curr Med Res Opin 1975; 3: 95-98.
4. Role of progestogen in hormone therapy for postmenopausal women: position statement of The North American Menopause Society. Menopause 2003; 10: 113-132.
5. Stanczyuk FZ. Structure: Function, relationships, potency and pharmacokinetics of progestogens. In Lobo RA Treatment of the postmenopausal woman Raaven Press New York 1994; 69-90.
6. Monterrosa A. Actualización de conceptos en anticonceptivos orales combinados. Impresos Calidad. Bogotá. 2001.
7. Lindsay R, Hart DM, Clark DM. The minimum effective dose of estrogen for prevention of postmenopausal bone loss. Obstet Gynecol 1984; 63: 759-763.
8. Horsman A, Jones M, Francis R, Nordin C. The effect of estrogen dose on postmenopausal bone loss. N Engl J Med 1983; 309(23): 1405-1407.
9. Insua A,Negri A, Zanchetta JR. Effects of estrogen therapy on bone mass in postmenopausal women with osteopenia. Medicina (B Aires) 1995; 55: 408-414.
10. Prestwood KM, Kenny AM, Unson C, et al. Effect of low dose micronized 17-bestradiol on bone turnover, sex hormone levels, and side effects in older women: a randomized, double blind, placebo coltrolled study. J Clin Endocrinol Metab 2000; 85: 4462-4469.
11. CummingsSR, Browner WS, Bauer D et al. Endogenous sex and calciotropic hormones and the risk of hip fracture and vertebral fractures in older women: the Study of Osteoporotic Fractures. N Engl J Med 1998; 339:733-738.
12. Balfour JA,McTavish D. Transdermal estradiol. A review of its pharmacological profile,and therapeutic potential in the prevention of postmenopausal osteoporosis. Drugs Aging 1992; 6: 487-507.
13. Genant HK, Lucas J, Weiss S et al. Low dose esterified estrogen therapy: effects on bone, plasma estradiol concentrations, endometrium, and lipid levels. Arch Intern Med 1997; 157: 2609-2615.
14. Sperof L, Roman J, Symons J et al. CHART Study Group. The comparative effect on bone density, endometrium and lipids of continous hormones as replacement therapy. (CHART Study): a randomized controlled trial. JAMA 1996; 276: 1397-1403.
15. The Writing Group for de PEPI Trial. Effects of hormone therapy on bone mineral density: Results from the postmenopausal estrogen / progestin Intervention Trial. JAMA 1996; 276: 1389-1396.
16. Lindsay R, Gallagher JC, Kleerekoper M et al. (HOPE). Effect of lower doses of conjugated equine estrogens with and without medroxyprogesterone acetate on bone in early postmenopausal women. JAMA 2002; 287: 2668-2676.
17. WHI (Women’s Health Initiative). Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: Principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288: 321-333.
18. Wells G, Tugwell P, Shea B et al. Meta- Analysis of the efficacy of Hormone Replacement Therapy in treating and preventing osteoporosis in postmenopausal women.
19. Moreno, B. Consenso colombiano sobre terapia de reemplazo hormonal (TRH) en la osteoporosis. Rev. Col. Menop. 2004; 10: 25-36.
