Bernardo Moreno Escallón
* Ginecólogo Epidemiólogo. Fundación Santa Fe de Bogotá. E-mail: bernardo.moreno@ama.com.co
I.- Preguntas:
A) ¿Cuándo está indicada la terapia de reemplazo hormonal (TRH) en la menopausia y en la osteoporosis?
B) ¿Por cuánto tiempo está indicada esa terapia?
II.- Búsqueda de información:
A) Fuentes:
• Medline
• Embase
• The Cochrane Collaborative (Cochrane Musculosketal Group)
• National Guideline Clearinghouse.
B) Estrategia: Para la búsqueda en el Medline (la cual fue la mayor fuente de Información) se introdujeron los siguientes términos en combinación y con ayuda del “MeSH Browser” (para utilizar términos “MESH”): “Hormone Replacement Therapy”; “Estrogen Replacement Therapy”; “ Bone Density”; “Postmenopausal”; “Osteoporosis”; “Fractures”; “Timing”.
Se hizo también búsqueda especifica con esos términos con limitaciones a meta-análisis, revisiones y estudios aleatorizados hasta Mayo del 2003. Igualmente, se hizo búsqueda y revisión manual de los artículos más relevantes citados en las revisiones y en los meta-análisis.
C) Análisis: Los seleccionados se analizaron de acuerdo a los criterios de las Guías de Usuario de la Literatura Médica descritos por Sacket1 y Guyatt2 y se clasificaron en el Nivel de Evidencia y Grado de Recomendación de acuerdo al citado por los mismos autores. Como no existe ningún artículo que lleve el título de las preguntas formuladas, se hizo necesario tomar los retazos de la información más relevante disponible y tratar de hacer un acercamiento lo mejor posible para dar soluciones aceptables. A continuación se presenta esa información:
III.- Artículos seleccionados y comentarios
1. Wells G. “V. Meta-Analysis of the Efficacy of Hormone Replacement Therapy in Treating and Preventing Osteoporosis in Postmenopausal Women”. Endocrine Reviews; 2002; 23: 529-5393.
Es un meta-análisis que incluye 57 estudios RCT (Randomized Clinical Trial) publicados entre 1966 y 1999 y que mencionan los efectos de la TRH en la densidad mineral ósea (DMO) y sobre las fracturas en mujeres postmenopáusicas, se incluyeron estudios que tuvieran al menos 1 año de duración.
Cuarenta y siete estudios son de prevención y 10 de tratamiento de la osteoporosis; 31 de esos estudios fueron enmascarados, 22 no enmascarados y 4 no lo mencionan. Sólo 5 estudios mencionan una asignación secreta al grupo de intervención.
Los resultados acerca de la eficacia de la TRH sobre DMO muestran un aumento del 6.7% en la columna (21 estudios); del 4.5% en muñeca (14 estudios) y 4.12% en cuello femoral (9 estudios). Con relación a las fracturas, un “pool” de 5 estudios para fractura vertebral entre 1-4 años de tratamiento, mostró un RR, 0.66 (IC; 95%: 0.71 a 1.08) y otro “pool” de otros 5 estudios para fractura Novertebral entre 1 a 5 años de tratamiento, mostró un RR: 0.87 (IC, 95%: 0.71 a 1.08).
El meta-análisis sugiere que después de 1 año de tratamiento ya existe un efecto significativo de la TRH sobre la DMO cuando se compara con no terapia y se observa un aumento progresivo en el segundo año de tratamiento a todos los niveles (columna, muñeca y cuello femoral). Cuando este meta-análisis (TRH vs. placebo) se compara con otros meta-análisis (alendronato, etidronato, reisedronato, calcitonina, calcio, vit. D) analizados por el mismo autor en publicaciones en serie de la misma revista4, con relación a la DMO, los mayores efectos sobre la columna (medidos como porcentaje de cambio en la DMO) se observaron con el alendronato (7.48%) y TRH (6.76%) y los resultados en otros sitios del esqueleto mostraron resultados similares: cadera (4.24% con alendronato y 4.12% con TRH); muñeca: (TRH: 4.55% y alendronato: 3.08%) y cuerpo total: (TRH: 3.5% y alendronato: 2.73%). Estos resultados fueron superiores al del resto de tratamientos mencionados anteriormente.
Con relación a las fracturas vertebrales y novertebrales, se observa una tendencia no significativa a la reducción de esas fracturas (columna: RR, 0.66; IC: 0.41 – 1.07) y fracturas novertebrales: (RR, 0.87; IC: 0.71- 1.08) en “pools” de 5 estudios entre 1 a 4 años de duración. Es posible que el número de estudios o el tiempo de duración de los mismos no sea suficiente para la observación de los desenlaces.
En conclusión, como este meta-análisis contiene estudios enmascarados y no enmascarados y la mayoría sin asignación secreta al grupo de intervención por una parte, y por otra, el pool de los resultados sobre las fracturas no procede de todos los estudios sino de una minoría, aunque se observó una tendencia protectora de la TRH sobre las fracturas, no fue significativa al tener en cuenta los Intervalos de Confianza, por eso este estudio sería de Evidencia II con un grado de recomendación B.
Togerson DJ. “Hormone Replacement Therapy and Prevention of Nonvertebral Fractures”. A Meta-analysis of Randomized Trials. JAMA, 2001; 285: 2891-28975.
Es una revisión sistemática de 22 estudios aleatorizados y controlados hasta Diciembre / 2000 sobre TRH y fracturas no-vertebrales con un seguimiento mínimo de 1 año. El autor menciona que 20 de los 22 estudios fueron sometidos a análisis de calidad y en 2 no fue posible. 11 estudios reportan métodos de aleatorización; 15 fueron doblemente enmascarados ( 9 con descripciones del método). No esta claro en los estudios si la asignación aleatoria fue secreta. De los 22 estudios seleccionados, 6 están mencionados en el meta-análisis anterior. Solo 2 estudios mencionan en sus objetivos como desenlace principal las fracturas no vertebrales (Mosekilde y Komulainen); 15 mencionan la DMO como principal desenlace, y otros 3 sus objetivos principales fueron la enfermedad coronaria y la enfermedad de Alzheimer, respectivamente. Hay un estudio no aleatorizado (Nachtigall6). Hay 8 estudios con intervalos de confianza muy amplios indicando esto poca precisión, debido probablemente a tamaños de muestra pequeños en esos estudios. Hay 2 estudios con contaminación de co-intervenciones (alendronato y ejercicio)7-8.
El resultado global para TRH en fracturas no vertebrales fue de un RR: 0.73 (IC, 95%: 0.56 – 0.94). Los resultados por estratos de edad mostraron: 60 años: RR, 0.88 (0.71 – 1.08). El análisis de sensibilidad muestra que la magnitud de los resultados cambia cuando se incluyen o excluyen los estudios de Eli Lilly y el HERS; (RR, 0.67 a 0.59) (IC, 0.44-0.8).
El autor concluye que la TRH reduce la incidencia de fracturas no-vertebrales y el efecto se atenúa después de los 60 años. Los efectos de la TRH sobre la DMO en estos estudios continua siendo consistente.
De acuerdo con la calidad de los trabajos analizados en este estudio, sería una evidencia II, recomendación B.
Torgerson DJ. “Hormone replacement therapy and prevention of vertebral fractures: a meta-analysis Disorders 2:7-10, of randomised trials”. BMC Musculoskeletal 20019.
Es una revisión sistemática de 13 estudios, de los cuales 9 están incluidos en el meta-análisis anterior del mismo autor (por lo cual los comentarios del estudio anterior son válidos para éste), sobre TRH en fracturas vertebrales con un seguimiento mínimo de 1 año Hay nueve estudios enmascarados y 4 no enmascarados.
El autor concluye que la TRH reduce el riesgo de fracturas vertebrales: RR, 0.67 (IC, 95%: 0.45 a 0.98).
La calidad de los estudios de este estudio por ser prácticamente los mismos del metaanálisis anterior, amerita una evidencia II, con grado de recomendación B.
Writing Group for the Women’s Health Initiative Investigators “ Risk and Benefits of estrogen plus progestin in healthy postmenopausal women” Principal results from the Women’s Health Initiative (WHI). JAMA, 2002; 288: 321-33310.
Este es un estudio de TRH vs. placebo, aleatorizado, con asignación secreta al grupo de aleatorización, controlado, doblemente enmascarado, con análisis por intención de tratamiento, realizado en 16.609 mujeres menopáusicas sanas, entre 50 y 79 años de edad, el cual fue diseñado a 8.6 años, pero fue interrumpido a los 5.2 años. Como desenlace primario del estudio estaba la enfermedad coronaria y como desenlace secundario se designó la fractura de cadera. Como efecto adverso primario se designó el cáncer invasivo de seno. También se analizaron las fracturas vertebrales y fracturas osteoporóticas en otros sitios del esqueleto.
El estudio mostró, al cabo de los 5 años de seguimiento, un efecto protector de 34% para la fractura de cadera (HR, 0.66; IC, 95%: 0.45–0.98); 34% para la fractura vertebral (HR, 0.66%; IC, 95%: 0.44 – 0.98); 23% para las otras fracturas (HR, 0.77; IC, 95%: 0.69 – 0.86) ; y de 24% para todas las fracturas (HR, 0.76; IC, 95%: 0.69 – 0.85).
Cuando estos resultados se analizan año por año durante los 5 años, muestran la misma consistencia. Aunque en el estudio hubo unas pérdidas de seguimiento de 3.5% y falta de adherencia al tratamiento de 42%, en el grupo de tratamiento y de 38% en el grupo placebo, los resultados siguen manteniendo la misma dirección.
La reducción absoluta del riesgo por 10.000 mujeres-año fue de 5 fracturas menos de cadera y de 44 fracturas menos de todas las clases. El estudio aún continua en la rama de estrógenos conjugados solos. Hasta la fecha, es el estudio más grande disponible para soportar la evidencia sobre la habilidad de la TRH para prevenir fracturas de cadera, columna y otros sitios, al menos durante 5 años de tratamiento. Por el diseño y la conducción sería un estudio con evidencia I y recomendación tipo A.
Mosekilde L “Hormone replacement Therapy reduces the risk of forearm fracture in postmenopausal women. Results of the Danish Osteoporosis Prevention Study.” Maturitas, 2000; 36: 181-19311.
Estudio a 5 años de seguimiento, aleatorizado y controlado (TRH vs. Placebo) en 2016 mujeres sanas entre 45 y 58 años, de las cuales 1006 fueron aleatorizadas a tratamiento con TRH o placebo y las otras 1010 fueron a otra rama No aleatorizada del estudio. El análisis se hizo por intención de tratamiento en las 2016 mujeres.
Se encontró una tendencia no significativa (RR, 0.75; IC, 95%: 0.50-1.05) a la reducción total de todas las fracturas. Hubo una reducción significativa del riesgo de fractura de muñeca (RR, 0.45; IC, 95%: 0.22 – 0.90). La adherencia al tratamiento fue del 65%. Este estudio también hace un análisis de las pacientes que se adhirieron al tratamiento y de esta forma muestra reducción para todas las fracturas (RR, 0.61; IC, 95%: 0.39-0.97) y de la fractura de muñeca (RR, 0.24; IC, 95%: 0.09-0.69).
El análisis de los resultados muestra los datos provenientes de pacientes aleatorizados y no aleatorizados y cuya mezcla puede generar sesgos de asignación y sobreestimación de los mismos. La evidencia de este estudio sería nivel II, grado de recomendación B.
Komulainen MH. “HRT and Vit. D prevention of Non-vertebral fractures in postmenopausal women; a 5 year randomized trial” Maturitas, 1998; 31: 45-5412.
Estudio de 464 pacientes de 47-56 años, aleatorizado por bloques, asignación secreta al grupo de aleatorización, pero no enmascarado.
Hubo 4 grupos de pacientes de 116 pacientes cada uno (TRH solo; Vit. D; TRH + Vit. D y Placebo). Estudio con seguimiento a 5 años.
Hubo una reducción del 60% en las fracturas no-vertebrales cuando se comparó TRH vs. Placebo (RR, 0.40; IC, 95%: 0.16 – 0.99) y del 51% cuando se compararon todos los pacientes con TRH vs. placebo (RR, 0.21; IC, 95%: 0.21 – 0.88) Nivel de evidencia II, recomendación grado B.
Lufkin GL. “Treatment of Postmenopausal Osteoporosis with Transdermal Estrogen” Ann Intern Med, 1992; 117: 1-913.
Estudio en 75 mujeres con osteoporosis entre 47 y 75 años, en tratamiento con 17b estradiol + acetato de medroxiprogestona vs placebo, durante 1 año, aleatorizado, controlado y doble ciego. Desenlaces medidos: DMO en columna, cadera y radio y fracturas vertebrales.
Resultados: Aumento en la DMO en columna (5.3%) ; en radio (1%) y no diferencia en cuello femoral. Se encontraron 23 fracturas/ 100 mujeres año en el grupo de tratamiento y 58 fracturas/100 mujeres-año en el grupo placebo, con un RR de 0.39 y p
Lindsay R. “Prevention of Spinal Osteoporosis in Oophorectomized women ”Lancet. 1980; 2: 1151-4.14
Estudio controlado, no aleatorizado, en 100 mujeres ooforectomizadas, divididas en 2 grupos: grupo de tratamiento, recibió mestranol y el otro grupo recibió placebo, durante un período de 9 años. El grupo de tratamiento logró mantener su DMO y disminuir la incidencia de compresión vertebral en forma significativa cuando se comparó con el control. Evidencia III-1, recomendación grado C.
Lindsay R. “Bone response to termination of estrogen treatment”. Lancet 1978; 1: 1325-715. Estudio controlado, aleatorizado, no enmascarado, en 43 pacientes ooforectomizadas.
Un grupo recibió mestranol y el grupo control recibió placebo. Duración del estudio: 8 años.
En el grupo de tratamiento no se observó pérdida ósea durante los 8 años de tratamiento.
En el grupo placebo la perdida ósea fue de un 2.6% por año en los primeros 4 años y luego de 0.75% /año. Un grupo que recibió tratamiento durante 4 años mantuvo su mineral óseo ese tiempo, pero cuando lo suspendió, hubo perdidas de un 2.5%/año en los 4 años siguientes. Al cabo de los 8 años no había diferencia significativa en la DMO entre el grupo que había suspendido la terapia y el grupo placebo. Nivel de evidencia II, recomendación grado B.
Lindsay R “Long term prevention of postmenopausal osteoporosis by oestrogen. Evidence for an increaset bone mass after delayed onset of oestrogen treatment. Lancet, 1976; 1: 1038-416.
Estudio en 63 mujeres ooforectomizadas a quienes se les demoró el inicio de la TRH (mestranol) entre 3 y 6 años. Cuando se inició la TRH, hubo aumento de la DMO en los primeros 3 años y luego se mantuvo igual durante los 2 años siguientes, mientras que el grupo placebo presentó pérdida ósea de 1%/año. Estudio controlado, no aleatorizado ni enmascarado. evidencia III-1, recomendación grado C.
Resumen de estudios observacionales sobre TRH y osteoporosis
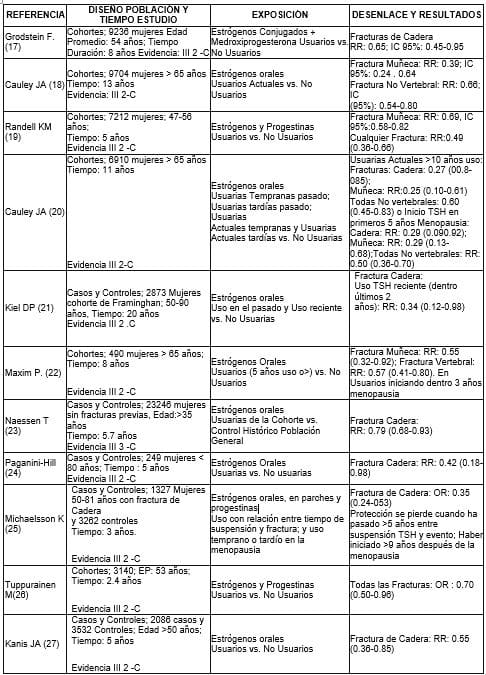
Artículos sobre revisión del tema de TRH y osteoporosis
1. Marcus R. Antiresorptive Treatment of Posmenopausal Osteoporosis: Comparison of Study Designs and Outcomes in Large Clinical Trials with Fracture as an Endpoint. Endocrine Reviews, 2002; 23: 16-3728.
2. Simón JA. “ El abordaje de la Osteoporosis desde la Ginecología” Reunión de Expertos Iberoamericanos, Cancún, México. JCR (Suppl), 2001; Marzo 19-20, Pg: 12-1529.
3. US Preventive Services Task Force “Postmenopausal HRT for Primary Prevention of Chronic Conditions. Ann Intern Med, 2002; 137: 834-930.
4. Santoro N. “ Therapeutic Controversy: Hormone Replacement Therapy – Where are we Going? J Clin Endocrinol Metab, 1999; 84: 1798-180331.
5. Delmas PD. “Treatment of Postmenopausal Osteoporosis” Lancet, 2002; 59: 2018- 2632.
6. Rymer J. “Making decisions about hormone replacement therapy. BMJ 2003; 326: 322-32633.
7. Davison S. “Hormone Replacement Therapy. Current Controversies. Clin Endocrino, 2003; 58: 249-26134.
8. AACE Clinical Practice Guidelines for Prevention and Treatment of Posmenopausal Osteoporosis. Endocrine Practice, 1996; 2: 155-17135.
9. Humphries KH. “ Risks and Benefits of Hormone Replacement therapy. CMAJ, 2003; 168: 1001-1010, (April 15)36.
10. Orwoll ES. “Does Estrogen protect Postmenopausal Women Against Osteoporosis: An Iconoclastic Perspective. J Clin Endocrinol Metab, 1999; 84:1872-187437.
11. Eastell R. “Treatment of Posmenopausal Osteoporosis. N Engl J Med 1998; 338: 736-74638.
12. National Institutes of Health, USA Osteoporosis prevention, diagnosis and therapy. NIH Consensus Statement. 2000; 17: 1-4539.
Resumen y conclusiones de la evidencia
La síntesis de la Evidencia más relevante y disponible está resumida en:
1. 3 Meta-Analysis con Nivel de Evidencia II (Ref. 3,5 y 9).
2. 1 Estudio Multicéntrico (1 “Megatrial”) aleatorizado, controlado y enmascarado con Nivel de Evidencia I (Ref. 10).
3. 3 Estudios y aleatorizados y controlados con nivel de Evidencia II (Ref. 11, 12 y 13).
4. 3 Estudios controlados No aleatorizados con Nivel de Evidencia III-1 (Ref. 14,15 y 16).
5. 11 Estudios observacionales (cohortes y casos y controles) con Nivel de Evidencia III-2 (Ref. 17 – 27).
6. 12 Artículos de revisión del tema, incluidas Guías de Manejo y Consenso (se asimila a un Comité de Expertos) Evidencia IV (Ref.: 28 – 39).
Todos los artículos son consistentes sobre el hecho que la TRH tiene un efecto positivo sobre la DMO en todas las épocas de la vida menopáusica y aunque es un desenlace intermedio con relación a las fracturas osteoporóticas, es un factor que hace parte de la definición de Osteoporosis y por eso la TRH se sigue recomendando como manejo preventivo de la misma.
Los estudios aleatorizados y controlados que soportan a la TRH en la reducción del riesgo de fracturas, son escasos y desafortunadamente no son a muy largo plazo.
Es estudio más grande y significativo el cual mostró un efecto protector sobre las fracturas, fue el estudio WHI10, el cual señala un efecto protector de la TRH durante 5.2 años cuando se compara con no uso de la terapia.
Los estudios que muestra un efecto protector sobre las fracturas y la DMO por más de 5 años de tratamiento, son no aleatorizados como los descritos por Lindsay14-16 en pacientes ooforectomizadas durante 9 años de terapia.
Aunque los estudios no son muy grandes, ayudan a comprender un poco el comportamiento del hueso en la menopausia temprana, en cuanto al porcentaje de pérdida y velocidad de la DMO.
Otros estudios, aunque con un volumen importante de pacientes los cuales tratan de mostrar el comportamiento del hueso y el desarrollo de osteoporosis en pacientes quienes han usado TRH en el pasado o han sido usuarias actuales desde hace muchos años, tratan de responder: ¿en qué momento? ¿A cuál edad? y ¿por cuánto tiempo? sería recomendable la TRH en la menopausia y en la postmenopausia.
Sin embargo estos estudios, los cuales son los observacionales están expuestos a los sesgos de selección y factores de confusión propios del mismo diseño, y por esto los resultados deben analizarse con precaución. A pesar de estas limitaciones, la dirección de los resultados de un estudio observacional se hace más consistente cuando aquellos resultados se reproducen en estudios con mayor fortaleza de la evidencia, como son los estudios aleatorizados, controlados y enmascarados y esto específicamente se vislumbra al analizar los resultados con relación a la disminución del riesgo de fractura con la TRH.
Hasta ahora, la evidencia analizada se ha concentrado sobre el aspecto de TRH y “Hue32 so Puro”, pero a la hora de tomar la decisión de una terapia, se debe contemplar la tríada conformada por el paciente como un todo, el médico con sus conocimientos y experiencia y el escenario dentro del cual hay que tomar tal decisión.
Un aspecto específico que llena de temor a las pacientes candidatas para la TRH, es la del cáncer de seno y aunque no es parte de la pregunta formulada al comienzo, si tiene injerencia en el momento de tomar una decisión.
Por eso vale la pena transmitir este tipo de información a la paciente. El aumento del Riesgo Relativo de un 35% para cáncer de seno (RR, 1.35) y que aparece después de 5 años de tratamiento, parecería alto para un paciente que no entiende el significado de un Riesgo Relativo, pero realmente es de baja magnitud cuando se compara con la incidencia de cáncer de seno en la paciente que no toma TRH.
Puesto en otro contexto, y lo cual será de ayuda en la decisión de continuar con TRH por más de 5 años, sería presentado de la siguiente manera: El riesgo de aparecer cáncer de seno en la población general SIN TRH entre los 50 y 70 años de edad es de 45 casos por cada 1.000 mujeres. Si se administra TRH por más de 5 años esa cifra aumentaría a 47/1.000 (2 casos extras más); por más de 10 años a 51/1.000 (6 casos más ) y por mas de 15 años a 57/1.000 (12 casos más). (Estas son cifras en Estados Unidos, donde la incidencia de cáncer de seno es 2-3 mayor que en Colombia)40.
Por esta y otras razones, como la calidad de vida del paciente, su percepción y actitud con respecto a la menopausia, factores de riesgo para osteoporosis; cubrimiento de los gastos de los medicamentos, entre otras, son ingredientes que se deben tener en cuenta para tomar una decisión. Por eso la evidencia existente hay que tratar de acomodarla individualmente a cada paciente.
Escenarios en los cuales se puede considerar la TRH en la menopausia y en la osteoporosis (¿Cuándo y por cuánto tiempo?)
A) ¿Cuándo?
1. Paciente dentro de los primeros 5 años de la menopausia, con sintomatología vasomotora o genitourinaria propias del climaterio, o después de ese tiempo si aún presenta esa sintomatología y no tenga contraindicaciones para el uso de TRH
2. Paciente dentro de los primeros 5 años de menopausia, sin sintomatología vasomotora o genitourinaria propias del climaterio, con una DMO baja (osteopenia) (T- Score: -1.5 a – 2.5) y sin contraindicaciones para la TRH.
3. Paciente dentro de los primeros 5 años de menopausia, asintomática, DMO normal limite bajo, con factores de riesgo para osteoporosis (raza blanca, delgada, sedentaria, fumadora, baja ingesta de calcio, antecedente materno de fractura femoral etc.) y sin contraindicaciones para el uso de TRH.
B) ¿Cuánto tiempo?
Cinco años de tratamiento con TRH han mostrado efecto positivo sobre la DMO y reducción en la incidencia de fracturas, sin que se aumente el riesgo relativo de cáncer de seno.
La TRH se puede prolongar por más tiempo, pero esto debe ser una decisión compartida entre el médico y la paciente. Este tipo de decisiones garantiza hasta cierto punto la adherencia al tratamiento lo cual es de suma importancia para obtener resultados óptimos en el mismo.
Cuando se cuestiona el tiempo de TRH y en qué momento de la vida puede comenzarse la misma, la respuesta exacta se presentó anteriormente pero con limitaciones de tiempo sin embargo, los estudios observacionales (con su evidencia limitada) que han recogido información a través de muchos años y en muchos pacientes nos pueden dar una idea general de que podría pasar con la TRH en diferentes circunstancias. Ettinger después de una revisión sistemática de esa literatura, pública su artículo en forma gráfica como una paciente que inicia su TRH al comienzo de la menopausia (50 años) y la toma durante toda su vida (85 años).
Su DMO se conserva en forma significativamente mejor que la paciente no usuaria de TRH. Si esa misma paciente suspendiera la TRH a los 65 años, comenzaría una pérdida ósea rápida los primeros 5 años de suspensión y luego una pérdida más lenta hasta el final de la vida cercana al de la no usuaria. Por otra parte si, una paciente decide no tomar TRH desde el comienzo de la menopausia y luego cambia de parecer y lo decide a los 65 años,
también se va a beneficiar de la TRH y esto se verá reflejado en aumento de la densidad ósea, en la cual se mantendrá en incremento en la medida que se mantenga en la terapia41. (Gráficas 1 y 2).
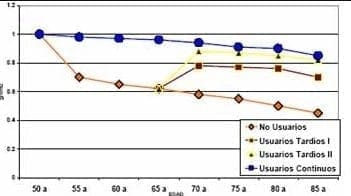
Gráfica 1. Densidad mineral ósea estimada por edad en usuarias, no usuarias e iniciadoras de THS a los 65 años (Ettinger B. Menopause 1:19, 1994)
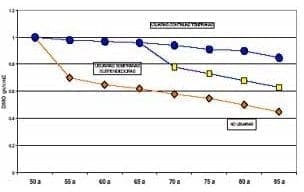
Gráfica 2. Densidad mineral ósea estimada por edad en usuarias, no usuarias y suspendedoras a los 65 años de THS (Ettinger B. Menopause 1:19, 1994)
Referencias
1. Sackett DL., Straus SE., Richardson WS., Rosenberg W., Haynes RB. Evidence-Based Medicine: How to Practice and Teach EBM. 2nd. EdEdinburgh; Churchill Livingstone, 2000.
2. Guyatt G., Rennie D., Users’s Guides to the Medical Literature: A manual for Evidence-Based Clinical Practice. JAMA & Archives Journals, USA, AMA press, Third ed., 2001.
3. Wells G, Tugwell P, Shea B, Guyatt G, Peterson N, Robinsob V, Henry D., O’Conell D. Meta-analysis of the efficiacy of hormone replacement therapy in treating and preventing osteoporosis in postmenopausal women. Endo Reviews 2002; 23(4): 529-39 (II-B).
4. Cranney A, Guyatt G, Griffith L, Wells G, Tugwell P, Rosen C. The Osteoporosis. Methodology Group and The Osteoporosis Research Advisory Group. IX: Summary of Meta-Analyses for Postmenopausal Osteoporosis. Endocrine Reviews 2002; 23: 570-578.
5. Torgerson D, Bell-Syer S. Hormone replacement therapy and prevention of nonvertebral fractures: A Meta-analysis of Randomized Trials. JAMA 2001; 285(22): 2891-7. (II-B).
6. Nachtigall LE, Nachtigall RH, Nachtigall RD, Beckman M. Estrogen Replacement Therapy I: a 10 year prospective study in the relationship to osteoporosis. Obstet Gynecol 1979; 53: 277-281.
7. Ravn P, Bidstrup M, Wasnich RD. Alendronate and estrogen-progestin in the longterm preventi of bone loss: four-year results from the Early Postmenopausal Intervention Cohort Study. Ann Intern Med 1999; 131: 935-942.
8. Cheng S, Sipila S, Puolakka H, Suonimen H. Effects of hormone replacement therapy ang high impact physical exercise on bone/ muscle ratio in postmenopausal women. Osteoporosis Int. 2000; 11(suppl 2):175.
9. Torgerson DJ, Bell-Syer SE. Hormone replacement therapy and prevention of vertebral fractures: a meta-analysis of randomised trials. BMC Musculoskelet Disord. 2001; 2(1): 7. (II-B).
10. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. JAMA 2002; 288: 321-33. (I-A).
11. Mosekilde L, Beck-Nielsen H, Sorensen OH. Hormonal replacement therapy reduces forearm fracture incidence in recent postmenopausal women: results of the Danish Osteoporosis Prevention Study. Maturitas 2000; 36: 181-93 (II-B).
12. Komulainen MH, Kroger H, Tuppurainen MT, Heikkinen AM, Alhava E, Honkanen R, Saarikoski S. HRT and Vit D in prevention of non-vertebral fractures in postmenopausal women; a 5 year randomized trial. Maturitas 1998; 31(1): 45-54 (II-B).
13. Lufkin EG, Wahner HW, O’Fallon WM, Hodgson FS, Kotowicz MA, Lane AW, Judd HL. Treatment of postmenopausal osteoporosis with transdermal estrogen. Ann Intern Med 1992; 117: 1-9. (II-B).
14. Lindsay R, Hart DM, Forrest C, Baird C. Prevention of spinal osteoporosis in oophorectomised women Lancet. 1980 Nov 29; 2(8205):1151-4. (III-C).
15. Lindsay R, Hart DM, MacLean A, Clark AC, Kraszewski A, Garwood J. Bone response totermination of oestrogen treatment. Lancet. 1978 Jun 24;1(8078): 1325-7. (III-C)
16. Lindsay R, Hart DM, Aitken JM, MacDonald EB, Anderson JB, Clarke AC. Long-term prevention of postmenopausal osteoporosis by oestrogen. Evidence for an increased bone mass after delayed onset of oestrogen treatment. Lancet. 1976 May 15;1(7968):1038-41. (III-C)
17. Grodstein F, Stampfer MJ, Falkeborn M, et al. Postmenopausal hormone therapy and risk of cardiovascular disease and hip fracture in a cohort of Swedish women. Epidemiology 1999; 5(10): 476-80 (III 2-C).
18. Cauley JA, Seeley DG, Ensrud K, Ettinger B, Black D, Cummings SR. Estogen Replacement anf fractures in Older Women. Ann Inter Med. 122:9-16, 1995 (III 2-C).
19. Randell KM, Honkanen RJ, Kroger H, Saarikoski S. Does hormone-replacement therapy prevent fractures in early postmenopausal women?J Bone Miner Res. 2002; Mar 17(3): 528-33. (III 2-C)
20. Cauley JA, Zmuda JM, Ensrud KE, Bauer DC, Ettinger B. Study of Osteoporotic Fractures Research Group. Timing of estrogen replacement therapy for optimal osteoporosis prevention. J Clin Endocrinol Metab 2001 Dec; 86(12): 5700-5 (III 2 – C).
21. Kiel DP, Felson DT, Anderson JJ, et al. Hip fracture and the use of estrogens in postmenopausal women. The Framingham Study. N Engl J Med 1987; 317(19): 1169-74 (III 2- C).
22. Maxim P, Ettinger B, Spitalny GM. Fracture protection provided by long-term estrogen treatment. Osteoporos Int 1995; 5(1): 23-9. ( III 2 –C)
23. Naessen T, Persson I, Adami HO, et al. Hormone replacement therapy and the risk for first hip fracture: a prospective, population-based cohort study. Ann Intern Med 1990; 113(2): 95-103 (III 3 –C).
24. Paganini-Hill A, Ross RK, Gerkins VR, Henderson BE, Arthur M, Mack TM. Menopausal estrogen therapy and hip fractures. Ann Intern Med 1981; 95: 28-31. (III 2 –C).
25. Michaelsson K, Baron JA, Farahhmand BY, Johnell O, Magnusson C, Persson PG, Persson I, Ljunghall S. Hormone replacement therapy and risk of hip fracture: population based case-control study. The Swedish Hip fracture Study Group. BMJ. 1998; 316: 1858-1863. (III 2 –C).
26. Tuppurainen MT, Kroger H, Honkanen R, Puntila E, Huopio J, Saarikoski S, Alhava E. Risks of perimenopausal fractures – a prospective population-based study. Acta Obstet Gynecol Scand. 1995; 74: 624- 628, (III 2 –C).
27. Kanis JA, Johnell O, Gullberg B, Allnder E, Dilsen G, Gennari C, Lopez Vaz AA, Lyritis GP, Mazzuoli G, Miravert L, Passeri M, Peres Cano R, Rapado A. Ribot C. Evidence for efficacy of drugs affecting bone metabolism in preventing hip fracture. BMJ. 1992; 305: 1124-1128. (III 2-C).
28. Marcus R. “ Antiresorptive Treatment of Posmenopausal Osteoporosis: Comparison of Study Designs and Outcomes in Large Clinical Trials with Fracture as an Endpoint. Endocrine Reviews, 2002; 23: 16-37, ( IV-C).
29. Simón JA. “ El abordaje de la Osteoporosis desde la Ginecología” Reunión de Expertos Iberoamericanos, Cancún, México. JCR (Suppl), Marzo 19-20, 2001; 12-15, (IV-C).
30. US Preventive Services Task Force “Postmenopausal HRT for Primary Prevention of Chronics Conditions. Ann Intern Med 2002; 137: 834-9 (IV-C).
31. Santoro N. Therapeutic Controversy: Hormone Replacement Therapy – Where are we Going? J Clin Endocrinol Metab, 1999; 84: 1798-1803 (IV-C).
32. Delmas PD. Treatment of Postmenopausal Osteoporosis” Lancet, 2002; 359: 2018 -26, (IV-C).
33. Rymer J. Making decisions about hormone replacement therapy. BMJ 2003; 326: 322-326. (IV-C).
34. Davison S. Hormone Replacement Therapy. Current Controversies. Clin Endocrinol, 2003; 58: 249-261. (IV-C).
35. AACE Clinical Practice Guidelines for Prevention and Treatment of Posmenopausal Osteoporosis. Endocrine Practice, 2:155-171,1996 (IV-C).
36. Humphries KH. Risks and Benefits of Hormone Replacement therapy. CMAJ, 2003; 168: 1001-1010, (April 15) (IV-C).
37. Orwoll ES. Does Estrogen protect Postmenopausal Women Against Osteoporosis: An Iconoclastic Perspective. J Clin Endocrinol Metab, 1999; 84: 1872-1874, (IV-C).
38. Eastell R. “Treatment of Posmenopausal Osteoporosis. N Engl J Med 1998; 338: 736-746, (IV-C).
39. National Institutes of Health, USA Osteoporosis prevention, diagnosis and therapy. NIH Consensus Statement. 2000; 17: 1-45, (IV-C).
40. Collaborative Group on Hormonal Factors in Breast Cancer . Breast cáncer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52.705 women with breast cancer and 108.411 women without breast cancer. The Lancet 1997; 350:1047- 1059.
41. Ettinger B, Grady D. Maximizing the Benefit of Estrogen Therapy for Prevention of Osteoporosis Menopause. 1994; 1:19-24
