Martinez Carlos E., Sanchez William, Escobar Jaime, Hormaza Jose A., Marquez Juan R., Ibañez Heinz, Molina Raul, Ospina John, ZorillIa Jose O.
Introducción en cáncer colorrectal
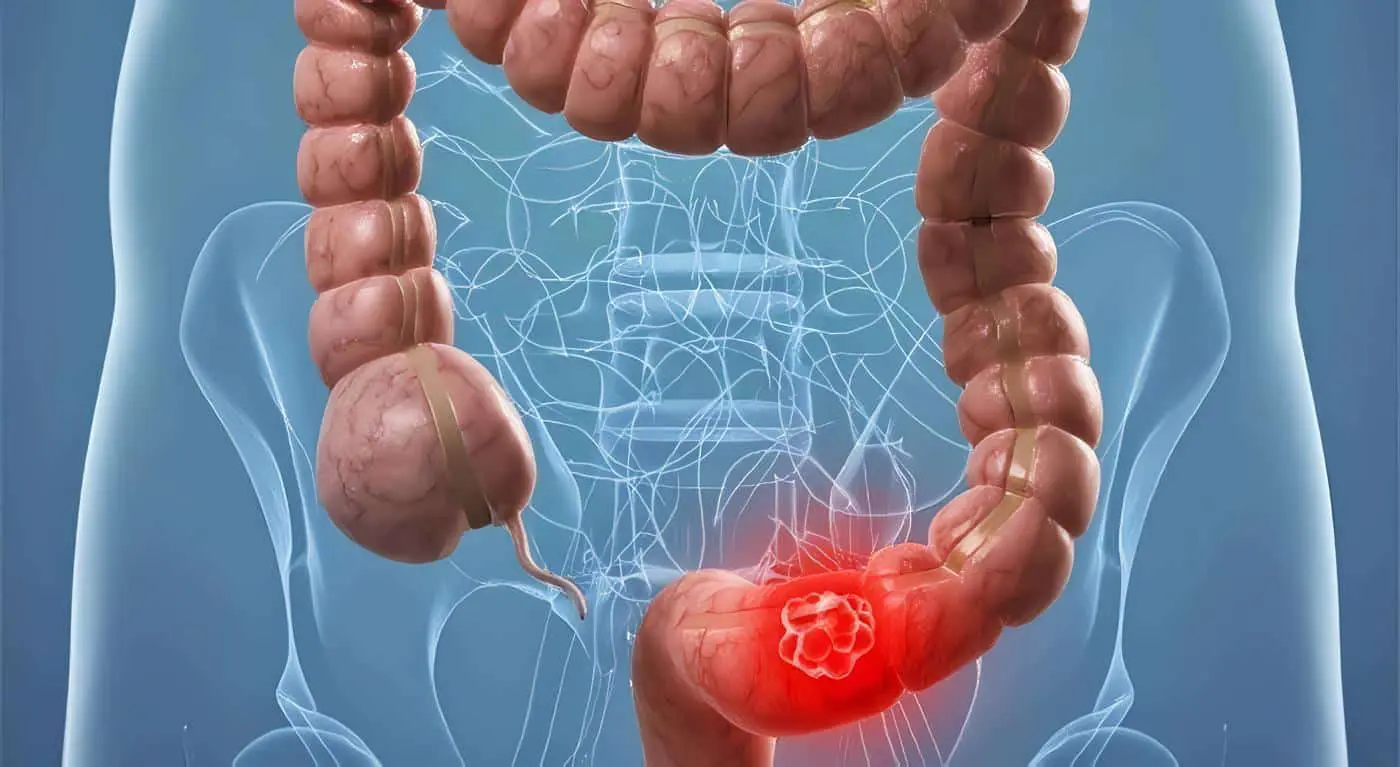
El cáncer colorrectal es una de las entidades malignas más frecuentes en nuestro medio y ocupa el cuarto lugar después del cáncer de cérvix, seno y estómago; esta entidad continúa siendo diagnosticada en la mayoría de los casos en estadios avanzados.
Teniendo en cuenta que el arsenal terapéutico disponible hasta el momento (cirugía, radioterapia, quimioterapia e inmunoterapia) sólo han mostrado una eficacia buena en la enfermedad local, regular en la enfermedad locorregional y poco efectiva en la enfermedad sistémica, se tendrán que mejorar estas técnicas de tratamiento con el fin de lograr las dosis terapéuticas adecuadas sin sus efectos indeseables que limitan su eficacia; es así como la inmunización (vacunas), la inmunoquimioterapia y la inmunoradioterapia (anticuerpos monoclonales que transportan quimioterapia o radioisótopos) tendrán que perfeccionarse para que sean las terapias de elección (61).
Profilaxis-tratamiento del cáncer colorrectal
En el análisis de las series relacionadas para el control de tumores sólidos, se ha determinado que los mejores efectos en su manejo se obtienen con la detección y tratamiento de sus lesiones precursoras o de sus formas no invasoras (in situ), razón por la cual la polipectomía guiada por estudios de factores de riesgos, pedigree o pruebas inmunogenéticas (K-ras en materia fecal) continúa siendo un elemento de éxito en la profilaxis-tratamiento del cáncer colorrectal (87).
Se percibe un futuro cercano en el área de la quimioprofilaxis y manipulación genética como alternativas para la prevención y tratamiento del cáncer colorrectal (88).
1. Como Determinar el Estadio del Cáncer Colorrectal
Cuando se escoge una clasificación para determinar el estadio de una enfermedad, siempre se ha de tener en cuenta que establezca un pronóstico y permita definir pautas de manejo.
Para establecer estrategias de manejo de los tumores, debemos conocer el comportamiento biológico de la enfermedad, su estadio y definir cuáles esquemas terapéuticos son los más efectivos (cirugía, radioterapia, quimioterapia, inmunoterapia, etc.).
Para clasificar el estadio de la enfermedad, conociendo su diseminación local, regional y sistémica, se han desarrollado y utilizado técnicas de diagnóstico que aún no nos permiten conocer en forma exacta las formas microscópicas y algunas macroscópicas de extensión de la misma.
Vías de diseminación del cáncer colorrectal
El conocer las vías de diseminación del cáncer colorrectal, nos sirve para planear el estudio y manejo de la enfermedad, es decir:
a) infiltración local, transmural
b) vía linfática
c) vía sanguínea
d) vía peritoneal
e) vía intraluminal
Después de que un tumor haya alcanzado una de estas vías de diseminación (alta velocidad), es un reto lograr predecir cuándo las células tumorales utilizarán estas vías para transportarse y cuándo serán capaces de sembrarse y crecer (producir metástasis) en otros tejidos.
Lograr predecir con certeza cuando estamos enfrentados a una enfermedad local, locorregional o sistémica es otro de los retos.
1.1. Clasificación
Duck, Astler Coller y TNM
Estas son clasificaciones histopatológicas hechas en piezas de resección quirúrgica; su correlación con estadios clínicos o por imágenes (tomográficas, ultrasonográficas, resonancia nuclear magnética, etc) no son 100% comparables, lo cual cuestiona la sensibilidad y la especificidad de estas técnicas para establecer el estadio correctamente de la enfermedad micro y/o macroscópica.
CLASIFICACIÓN DE DUKES (2): Publicada en 1932
Estadio A: Carcinoma limitado a la pared del recto.
B: Carcinoma que traspasa la pared rectal y se continúa en tejido extrarrectal sin afección ganglionar.
C: Metástasis a ganglios regionales.
ASTLER Y COLLER (3): en 1954, modificó la de DUKES, así:
– Tiene en cuenta el peritoneo visceral como barrera anatómica contra la diseminación del cáncer.
– Además del recto, abarcó el colon intraabdominal.
A: tumor limitado a la mucosa.
B1: tumor dentro de la muscularis propia, pero no la rebasa.
B2: tumor que rebasa la muscularis propia y pasa a la grasa pericólica.
C1: igual que B1, con compromiso a los ganglios linfáticos.
C2: igual que B2, con compromiso a los ganglios linfáticos.
Detectaron como grupo de buen pronóstico, con un buen control local y excelente supervivencia, a los tumores confinados a la mucosa.
TURNBULL: (1967)
– Introdujo el estadio D: metástasis a distancia.
– Agregó el concepto de que la invasión a los órganos vecinos altera el pronóstico en forma adversa.
GUNDERSON Y SOSIN: (1974).
B3: adherencia o invasión a órganos o estructuras adyacentes, sin afección de ganglios linfáticos.
C3: igual que B3, con afección de ganglios linfáticos.
NÓDULOS LINFÁTICOS
- Primero, N 1: nódulos pericólicos a menos de 5 cm del tumor.
- Segundo, N 2: nódulos a lo largo de un vaso mayor que irriga el tumor (5 a 10 cm del T)
- Tercero, N 3: nódulos en el origen de un vaso principal.
NÚMERO DE NÓDULOS LINFÁTICOS POSITIVOS
– De 1 a 3 nódulos positivos
– De 4 o más nódulos positivos.
Con el objeto de poder unificar e integrar los diversos factores pronósticos, histopatológicos de significancia detectados a lo largo de décadas de estudio y con la finalidad de tener una única clasificación que permita evaluar, comparar y verificar las experiencias de diversos centros dedicados al tema, se adoptó la clasificación TNM (1), por el American Joint Committe of Cancer, el National Cancer Institute y los National Institutes of Health.
CLASIFICACIÓN TNM
TX tumor primario no puede ser evaluado.
T0 no hay evidencia de tumor primario.
Tis carcinoma in situ
T1 tumor que invade la submucosa
T2 tumor que invade la muscularis propia
T3 tumor que sobrepasa la muscularis propia comprometiendo la subserosa o los tejidos no peritonizados pericólicos o perirrectales.
T4 tumor que perfora el peritoneo visceral o que directamente invade otros órganos o tejidos.
Cuando es recto: útero
anexos
vagina (post)
vejiga
próstata
NX nódulos linfáticos regionales no pueden ser valorados.
N0 nódulos linfáticos regionales sin metástasis.
N1 Metástasis de 1 a 3 nódulos linfáticos pericólicos o perirrectales.
N2 Metástasis a 4 o más nódulos linfáticos pericólicos o perirrectales.
N3 Metástasis en algún nódulo linfático a lo largo del curso de un tronco vascular
MX las metástasis a distancia no pueden ser valoradas.
M0 no hay metástasis a distancia
M1 metástasis a distancia.
Estadio 0 |
Tis |
N0 |
M0 |
Estadio I |
T1T2 |
N0N0 |
M0M0 |
Estadio II |
T3T4 |
N0N0 |
M0M0 |
Estadio III |
Cualquier TCualquier T |
N1N2 N3 |
M0M0 |
Estadio IV |
Cualquier T |
Cualquier N |
M1 |
El grado histopatológico se clasifica en:
GX grado no puede ser clasificado
G1 bien diferenciado
G2 moderadamente diferenciado
G3 pobremente diferenciado
G4 indiferenciado
Con el advenimiento de la radioterapia y la quimioterapia neoadyuvantes (preoperatorias) que han mostrado efectividad bajando los estadios locales y regionales, (downstagin) tanto del cáncer rectal temprano T1 y T2, como del cáncer avanzado T3, T4, N1, N2, N3, han cobrado gran importancia las técnicas de estadio preoperatorias con el fin de predecir un pronóstico y establecer un esquema terapéutico.
1.2 Correlación del TNM con el examen clínico
La palpación digital del tumor para tratar de determinar su estadio es muy subjetiva y varía con la experiencia del examinador. En un trabajo prospectivo, con 70 pacientes en el St. Mark’s Hospital (4), se trató de definir el estadio del tumor y de los nódulos linfáticos comparando el tacto rectal con la tomografía axial computarizada y los hallazgos histopatológicos.
Los aspectos mínimos recomendados que se deben describir en el tacto rectal son:
- Distancia entre el orificio anal y el tumor en centímetros;
- Morfología del tumor (ulcerado o no ulcerado);
- Número de cuadrantes comprometidos;
- Profundidad de invasión (confinado a la submucosa, a la pared rectal o a los tejidos adyacentes)
- Invasión extrarrectal (negativa, leve, moderada, extensa);
- Movilidad del tumor para determinar el grado de fijación, y
- Nódulos linfáticos perirrectales.
La concordancia para determinar la profundidad de invasión del tumor con el examen digital y los hallazgos histopatológicos está alrededor de 80% y para los ganglios linfáticos, de 65% (4)
La concordancia de la tomografía con los hallazgos histopatológicos para los tumores con invasión mínima o leve fue de 10% y para los tumores con moderada o extensa invasión fue de 72%. En 14 pacientes con nódulos linfáticos positivos para tumor, sólo 4 (28%) fueron vistos por la tomografía (4).
(Lea También: Detección de Cáncer Colorrectal)
1.3 Correlación del TNM con la tomografía axial computadorizada
La tomografía computadorizada es otra de las herramientas que se ha desarrollado con un creciente interés como ayuda para la determinación del estadio pretratamiento de las lesiones colorrectales; la literatura muestra muchas experiencias en las cuales se ha correlacionado la TAC con la histopatología. Los estudios han sido realizados evaluando el espesor del compromiso de la pared, la invasión de los tejidos vecinos y la extensión a estructuras ganglionares y a la pared de la pelvis (49).
La tomografía helicoidal es la de elección, pues realiza cortes de 3 a 5 mm y con la ayuda de bolos de medio de contraste que resaltan positiva o negativamente las zonas sospechosas o perilesionales, lo cual mejora el grado de resolución de las imágenes. Puede optimizarse la resolución en equipos no helicoidales, con la administración seriada del medio de contraste a intervalos de tiempo cortos durante la realización del examen (42).
La imagen tomográfica determina directamente el compromiso de la lesión y muestra las características propias de las estructuras; es así como el espesor de la pared del colon distendido, se observa normalmente como igual o menor a 3 mm, considerándose como indeterminado cuando la misma está entre 3 y 6 mm, y anormal cuando es mayor de 6 mm.
Las lesiones tumorales contenidas en la pared muestran el exterior bien delimitado y la grasa pericólica o perirrectal se aprecia en forma uniforme con atenuación baja. No es posible por TAC valorar la invasión microscópica ni determinar las capas normales del tejido (42).
La extensión tumoral:
Más allá de la pared puede manifestarse como una masa de bordes irregulares, extendiéndose hacia el exterior del margen colorrectal dentro de la grasa pericólica o perirrectal; la diseminación extracolónica también se sugiere por la pérdida de los planos grasos entre el colon y los músculos alrededor y es clara cuando la masa tumoral se extiende directamente a los músculos adyacentes, obliterando los planos grasos y aumentando en forma individual el volumen muscular (42).
La diseminación a un órgano vecino puede ser simulada por la ausencia de un plano de clivaje y puede ser causada por congestión vascular o linfática, inflamación o ausencia de grasa por desnutrición severa (falsos positivos).
La invasión puede ser diagnosticada cautelosamente y es considerada definitiva, solamente si una gran proporción del tumor involucra la víscera vecina o si existe evidencia de una masa obvia que involucra el tejido adyacente. La baja atenuación intratumoral sugiere la presencia de áreas de necrosis tumoral (42).
La observación de ganglios en la TAC ha sido considerada como criterio de anormalidad y sugiere la presencia de metástasis, pues se considera que los ganglios perirrectales y pericolónicos no se detectan normalmente por tomografía. Otros autores consideran que la invasión a ganglios linfáticos se evidencia tomográficamente sólo cuando el tamaño del ganglio detectado es mayor de 1 cm, con o sin bordes deformados o irregulares (42).
Los estadios basados en la TAC y correlacionados con Dukes (Thoeni et al.) es la siguiente (50):
- Primero, ESTADIO I: masa polipoidea intraluminal sin compromiso de la pared intestinal.
- Segundo, ESTADIO II: compromiso de la pared intestinal sin invasión a los tejidos vecinos.
- Tercero, ESTADIO III A: invasión a los tejidos vecinos, sin invasión de las paredes laterales de la pelvis.
- Cuarto, ESTADIO III B: extensión a las paredes laterales de la pelvis.
- Quinto, ESTADIO lV: tumor pélvico, o con metástasis a distancia.
La TAC no puede diferenciar las lesiones T2-T3; determina un estadio inferior en 9% de los pacientes y superior en 44% con 47% de determinación correcta de estadios por lo cual no se recomienda la determinación rutinaria con este medio (49).