Diagnóstico de Sobrecrecimiento Bacteriano
El sobrecrecimiento bacteriano es un síndrome caracterizado por malabsorción de nutrientes asociado con excesivo número de bacterias en el intestino delgado.
Las condiciones que favorecen el sobrecrecimiento bacteriano son: la estasis intestinal por alteraciones anatómicas (estenosis, asa aferente de la gastrectomía parcial de Billroth II, diverticulosis del intestino delgado) o por trastornos de motilidad (escleroderma, neuropatía diabética); conexión anormal entre el intestino proximal y el distal (fístulas); hipocloridia (terapia quirúrgica para enfermedad úlcero-péptica), y estados de inmunodeficiencia (26).
El diagnóstico de sobrecrecimiento bacteriano debe ser considerado en aquellos pacientes con diarrea crónica, pérdida de peso, esteatorrea, anemia macrocítica y factores predisponentes. El diagnóstico diferencial incluye las enfermedades de la mucosa intestinal (esprue celíaco) las infecciones (enfermedades parasitarias) y la insuficiencia pancreática.
El cultivo microbiológico del aspirado duodenal, es sine quanon para el diagnóstico de sobrecrecimiento bacteriano, considerándose confirmado con recuentos mayores de 106 colonias por ml. Es una técnica con excelente sensibilidad y especificidad, pero compleja. Requiere un catéter estéril de succión dentro de un sobretubo estéril que se pasa a través del canal de biopsia del endoscopio. El material debe mantenerse en condiciones anaerobias, diluirse en forma seriada y cultivarse en diversos medios selectivos (27).
Otro enfoque menos invasor para el diagnóstico de sobrecrecimiento bacteriano son las pruebas de aliento. Debido a que el diagnóstico de sobrecrecimiento bacteriano tiene varias dificultades y limitaciones, el tratamiento empírico del sobrecrecimiento bacteriano se usa a menudo en la práctica clínica (27).
Técnica para Diagnóstico de Giardiasis
- Endoscopia de vías digestivas altas
- Intubación del duodeno (tercera porción)
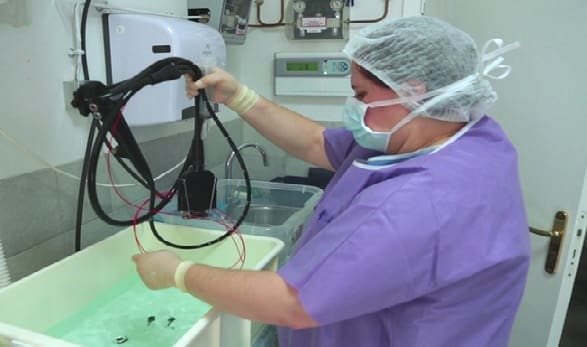
- Colocación del reservorio intercalado en el sistema de aspiración (ver figura)
- Aspiración del líquido duodenal
- La cantidad de líquido aspirado es menor de 10 cc , instilar 10 cc de solución salina al 0,9% a través del canal de biopsia y repetir la aspiración. Si se usa agua destilada o cualquier solución hipotónica, se lisan los trofozoitos (28).
- Si se requieren biopsias, se deben tomar mínimo dos fragmentos, de la segunda o la tercera porción.
- El material aspirado se centrifuga por 5 min a 2.500 rpm
- Se coloca una gota del sedimento en 3 a 5 láminas y se añade una gota de solución yodada de lugol.
- Revisión de las láminas al microscopio
NOTA: en el caso de aspirado duodenal para búsqueda de larvas de strongiloides, la técnica es similar incluyendo la evaluación microscópica directa y la tinción indicada del material centrifugado y, rutinariamente, biopsia de la mucosa duodenal.
Técnica para Diagnostico de Cristales en Pacientes con Sospecha de Barro Biliar por Aspirado Duodenal
Protocolo de Cynthia W. Ko, Jon Sekijima, Sum Lee (modificado) (22)
- Infusión IV de colecistoquinina 0,05 – 0,1 mg/ kg, en 10 minutos o el método de Meltzer – Lyon: instilación a través del endoscopio de 30 ml de sulfato de magnesio, con una segunda dosis si se observa escasa bilis (29).
- Colocación del reservorio intercalado en el sistema de aspiración.
- Aspiración duodenal de 5-15 ml. de líquido biliar. Se recomienda realizarla 10 a 20 minutos después de la infusión de colecistoquinina.
- Centrifugación de la muestra por 15 min a 3.000 rpm.
- El sedimento se coloca en una lámina con una gota de agua destilada y se examina bajo luz polarizada. Los cristales de monohidrato de colesterol se identifican por su forma romboidea y los gránulos de bilirrubinato de calcio por su color marrón rojizo.
- Se revisan 3 muestras y se considera positivo cuando se encuentran 4 cristales por lámina.
Nota: no se recomienda tomar la muestra del colédoco porque el tránsito rápido de la bilis no permite la formación de cristales sólidos. El medio de contraste no altera la formación de cristales.
Bibliografía
- 1. Oberhuber G, Stolte M. Symptoms in patients with giardiasis undergoing upper gastrointestinal endoscopy. Endoscopy 1997; 29: 716-720.
- 2. Farthing M. Giardiasis. Parasitic diseases of the liver and intestines. Gastroenterol Clin North Am 1996; 25(3): 493-515.
- 3. Ramirez F, Clarridge J., Heiser M, et al. A study of frecuency of recovery of unexpected Giardia lamblia and Cryptosporidium from duodenal aspirates taken during routine upper endoscopy Am J Gastroenterol 1993; 88(4): 552-4.
- 4. McHenry R, Bartlett MS, Lehman GA, et al. The yield of routine duodenal aspiration for Giardia lamblia during esophagogastroduodenoscopy. Gastrointest Endosc 1987; 33: 425-426.
- 5. Kerlin P, Ratnaike RN, Butler R, et al. Prevalence of giardiasis: a study at upper gastrointestinal endoscopy. Dig Dis Sci 1978; 23: 940-42.
- 6. Carr M, Ma J, Green P. Giardia lamblia in patients undergoing endoscopy: lack of evidence for a role in nonulcer dyspepsia. Gastroenterology 1988; 95: 972-4.
- 7. Goka AKJ, Rolston DDK, Mathan VI, et al. The relative merits of faecal and duodenal juice microscopy in the diagnosis of giardiasis. Trans R. Soc Trp Med Hyg 1990; 84: 66-67.
- 8. Amen ME, Rubin CE. Relation of giardiasis to anormal intestinal structure and function in gastrointestinal inmunodeficiency syndromes. Gastroenterology 1972; 62: 216.
- 9. Suzuky HU, de Morais MB, Medeiros EH, et al. Diagnostic limitations of the isolation of trophozoites of Giardia lamblia in duodenal aspirates. Arq Gastroenterolog 1994; 31(2): 69-74.
- 10. Oberhuber G, Stoltle M, Kastner N. Giardiasis: a histologic analysis of 567 cases. Scand J Gastroenterol 1997; 32: 48-51.
- 11. Martínez JD, Beltrán O. Parasitismo intestinal. En: Alvarado J, Otero W, Archila P, Rojas E. Gastroenterología y hepatología. 1ª edición. Bogotá: ACED 1996; 123-126.
Referencias
- 12. Choudhry U, Choudhry R, Romeo D, et al. Strongyloidiasis: new endoscopic findings. Gastrointest Endosc 1995; 42(2).
- 13. Dworkin B, Wormser GP, Rosenthal WS, et al. Gastrointestinal manifestations of the acquired inmunodeficiency syndrome: a review of 22 cases. Am J Gastroenterol 1985; 80: 774-8.
- 14. Bown J, Savides T, Mathews C. Diagnostic yield of duodenal biopsy and aspirate in AID associated diarrhea. Am J Gastroenterol 1996; 91(11): 2289-2292.
- 15. Smith PD, Lane HC, Gil VJ, et al. lntestinal infections in patients with acquired inmunodeficiency syndrome: etiology and response to therapy. Ann Intern Med 1988; 108: 328-33.
- 16. Simon D, Brand LJ. Diarrhea in patients with the acquired immunodeficiency syndrome. Gastroenterology 1993; 105: 1238-42.
- 17. Bini E, Weinshel E, Gamagaris Z. Comparison of duodenal with jejunal biopsy and aspirate in chronic human immunodeficiency virus related diarrhea. Am J Gastroenterol 1998; 93: 1837-1840.
- 18. Blanshard C, Francis N, Gazzard BG. lnvestigation of chronic diarrhoea in acquired immunodeficiency syndrome. A prospective study of 155 patientes. Gut 1996; 39: 824-32.
- 19. Lyon BBV. Diagnosis and treatment of diseases of the gallbladder and biliary ducts. Preliminary report on a new method. JAMA 1919; 73: 980-2 .
- 20. Lee SP, Maher K, Nichols JF. Origin and fate of biliary sludge. Gastroenterology 1988; 94: 170-6.
- 21. Janowitz P, Kratzer W, Zemmler T, Tudyka J. Hallblader sludge: spontaneous course and incidence of complications in patients with stones. Hepatology 1994; 20: 291-4.
- 22. Cynthia W. Ko, Sekijima J, Lee S. Biliary sludge. Ann Intern Med 1999; 130: 301-311.
- 23. Steinberg W. Acute pancreatitis- Never leave a stone unturned. Editorial. N Engl J Med 1992; 326: 635-37.
Fuentes
- 24. Lee SP, Nicholls J, Park H. Biliary sludge as a cause of acute pancreatitis. N Engl J Med 1992; 326: 589-93.
- 25. Ross E, Navarro S, Bru C, et al. Occult microlithiasis in “idiopatic” acute pancreatitis: prevention of relapses by cholecystectomy or urso deoxycholic acid therapy. Gastroenterology 1991; 101: 1701-9.
- 26. Toskes P, Kumar A. Enteric bacterial flora and bacterial overgrowth syndrome. In: Feldman M, Scharschmidt, Seisenger M. Gastrointestinal and liver disease. 6th Edition. Philadelphia: WB Saunders 1998; 89: 1523-1535.
- 27. Li Ellen. Bacterial overgrowth. In: Yamada T, Alper D, Owyang C . Textbook of gastroenterology. Second edition. J.B. Lippincott Co. 1995; 74: 1673-1679.
- 28. Korman SH. Endoscopy duodenal aspiration for diagnosis of giardiasis. Gastrointest Endosc 1989; 35: 354-5 (letter).
- 29. Dill JE, Hill S, Callis J, et al. Combined endoscopy ultrasound and stimulated biliary drainage in cholecistitis and microlithiasis. Diagnoses and outcomes. Endoscopy 1995; 27: 424-427.