Principios Probados y Prácticas Factibles
Carolina Valderrama*, Andrés Calderón*, Diego L. Malpica*, Fidias E. Leon Sarmiento**
Resumen
Las pruebas autonómicas cardiovasculares combinan diversas disciplinas científicas como la fisiología y la semiología convencionales, la biotecnología y diversos modelos matemáticos, entre otros; un buen número de ellas son poco o nada invasivas, sencillas de ejecutar y con niveles de evidencia científicamente probados como para ser utilizadas en la evaluación neurocardiológica de rutina.
Dentro de estas pruebas destacamos aquí las que evalúan el sistema simpático: la respuesta opresora al frío, la mesa basculante y el ejercicio isométrico. Para evaluar el sistema parasimpático sobresalen el masaje carotídeo, el cociente inspiración/expiración y la prueba de inspiración profunda.
La maniobra de Valsalva, los cambios ortostáticos, el reflejo orbicular de los ojos y la variabilidad de la frecuencia cardiaca analizada bien sea por medio del dominio del tiempo, de la frecuencia o por métodos no lineales, permiten conocer, de manera simultánea, el funcionamiento de los sistemas simpático y parasimpático.
A pesar de las limitaciones existentes para acceder a tecnologías de alta complejidad, debido a las nuevas políticas gubernamentales que regulan la salud en algunos países latinoamericanos, como la ley 100 de Colombia y sucedáneas, estas pruebas neurocardiológicas se constituyen en herramientas útiles y económicamente viables para evaluar la función y disfunción del sistema nervioso autónomo de los seres humanos en la práctica clínica.
Palabras claves: sistema nervioso autónomo, frecuencia cardiaca, presión arterial, neurocardiología, disautonomía.
Abstract
Cardiovascular autonomic tests combine, among others, diverse scientific disciplines such as conventional physiology and semiology, biotechnology and diverse mathematical models. Most of these tests are ease to perform as well as minimally or not invasive at all; likewise, there is good scientific evidence based on the usefulness of the majority of these tests in clinical practice.
We underline the cold pressor response, tilt table test, and isometric exercise as part of sympathetic nervous system evaluation; parasym pathetic nervous system tests include carotid sinus massage, expiratory inspiratory ratio and deep inspiration test. Valsalva maneuver, postural change responses, orbicular oculi reflexes and heart rate variability measured by time domain, frequency domain or non linear analysis involve both sympathetic and parasympathetic function.
Despite current governmental policies that limit access to high quality technology in the health services in some Latin American countries, such as occurs in Colombia with Congressional Bill No. 100, 1993, and the like, these neurocardiologic tests allow the simultaneous assessment of autonomic function and dysfunction in clinical practice.
Key words: Autonomic nervous system, heart rate, blood pressure, neurocardiology, dysautonomia
La actividad cardiaca la controla el sistema nervioso autónomo con sus componentes simpático y parasimpático.(1,2) El sistema simpático se origina en las astas intermedió laterales de los seis segmentos torácicos superiores de la médula espinal; sus fibras preganglionares se unen a la cadena simpática torácica donde hacen sinapsis con fibras posganglionares que van hacia el corazón; las fibras derechas son las que, principalmente, regulan la frecuencia cardiaca (FC) y el neurotransmisor más importante es la noradrenalina.
El sistema parasimpático controla la FC:
En condiciones de reposo, a través del nervio vago; sus fibras preganglionares se originan en el tallo cerebral y las células ganglionares se encuentran cerca de los nodos cardiacos sinusal y aurículoventricular; la acetilcolina es su principal neurotransmisor.(3-5)
El sistema simpático aumenta la automaticidad estimulando, mediante la liberación de catecolaminas, los receptores βadrenérgicos que fosforilan proteínas de membrana mediadas por el AMPc; incrementa las corrientes de marcapaso tiempo dependientes no selectivas de catión, llamadas también corrientes If ,(6,7) con posterior aumento de la conductancia de las corrientes que favorecen la despolarización, el cronotropismo, inotropismo y lucitropismo, o corrientes ICaL.(6,8) El sistema parasimpático, por su parte, hiperpolariza las corrientes asociadas a K+ y dependientes de acetilcolina (IKACh), (6,7) disminuye la actividad If y la conductancia de las corrientes ICaL y, por lo tanto, la FC de origen sinusal. (6,9-11)
La modulación de las respuestas cardiovasculares está mediada por quimiorreceptores, que censan cambios en la presión parcial de O2, CO2 y pH en el cuerpo carotídeo, aorta y bulbo raquídeo y por barorreceptores o receptores de estiramiento ubicados en el cayado aórtico, el seno carotídeo, las aurículas, el ventrículo izquierdo y las venas cavas y pulmonares.
El centro vasomotor, el cual no es una estructura anatómica definida, tiene neuronas vasoconstrictoras y vasodilatadoras, y recibe señales excitatorias del puente cerebral e inhibitorio del tracto solitario.
Está estrechamente relacionado con el núcleo motor dorsal del nervio vago y recibe, además, aferencias mediadas por GABA de los nervios craneales glosofaríngeo y vago,(4) así como propioceptores musculares, pulmonares y del hipotálamo. Este último actúa en conexión con la hipófisis, la corteza sensorimotora, el sistema límbico y núcleos de la columna intermedió lateral de la médula espinal.(3,4, 9,10,12,13)
Importancia del sistema nervioso autónomo
A pesar de la importancia del sistema nervioso autónomo y sus componentes en el funcionamiento corporal humano, éste es aún poco explorado en la práctica tal vez por la poca difusión de las pruebas de laboratorio que se pueden realizar o por dificultades en la estandarización de las mismas, entre otros aspectos.
Dado que a la fecha se ha desarrollado una notable cantidad de pruebas autonómicas, no invasivas, sencillas de ejecutar y la gran mayoría de ellas con niveles de evidencia científicamente probados como para ser utilizadas en la evaluación neurocardiológica de rutina, es nuestro objetivo ayudar a difundir de la manera más didáctica posible la forma como se realizan estas pruebas, así como sus potenciales beneficios y sus limitaciones, clasificándolas para efectos prácticos en pruebas simpáticas, parasimpáticos y mixtas.(9,11)
1. Evaluación de las vías simpáticas
1.1. Respuesta presora al frío
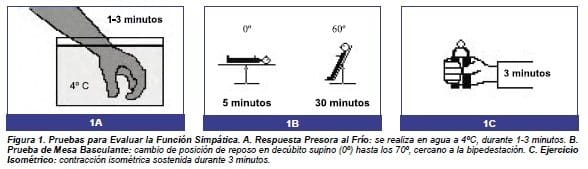
Metodología: tras un periodo de reposo en decúbito supino durante 5 minutos, se sumerge la mano dominante del sujeto por estudiar, hasta la región de la muñeca, en agua que esté a una temperatura de, usualmente, < 4º C, durante 1 a 3 minutos (Figura 1A). Esto estimula la respuesta simpática suprarrenal generando al final de la prueba, descenso en la FC y aumento de la presión arterial (PA) sistólica; la diferencia de esta última con la PA sistólica basal es lo que determina el resultado de la prueba.(4,14-19)
Beneficios: permite evaluar tanto las vías aferente y eferente de manera simultánea.(19)
Limitaciones: esta prueba se modifica con la edad. Tiene una baja sensibilidad y especificidad para detectar disfunción simpática por la alta variabilidad de los resultados entre sujetos; además, la liberación local de adrenalina y óxido nítrico, mediada por la estimulación de receptores β2 adrenérgicos, induce la vaso dilatación en algunos lechos vasculares modificando los resultados.(4,14-19)
1.2. Prueba de la mesa basculante
Metodología: esta evaluación se realiza acostando al sujeto en decúbito su pino durante 5 minutos y, simultáneamente, se toma la PA y la FC basal; luego, la mesa se inclina entre 60o y 70o manteniendo el sujeto con la cabeza hacia arriba, durante 30 minutos registrándose la PA y la FC, cada 3 minutos (Figura 1B). Este cambio de posición genera una respuesta mediada por los baro receptores, aumentando la resistencia vascular periférica, la FC y la PA diastólica.(4,14-16,18-20)
Beneficios: es considerada la prueba “de oro” para evaluar la hipotensión ortostática.(16)
Limitaciones: la magnitud de la respuesta autonómica evaluada depende de la edad.(16)
1.3. Ejercicio isométrico
Metodología: el sujeto por evaluar realiza una contracción muscular isométrica con la mano dominante, durante 3 minutos, al 30% de su máximo esfuerzo (Figura 1C). Con esta maniobra se obtiene un incremento en la PA y la FC comparado con los datos obtenidos mientras el individuo está en reposo.(4,14-16,19,20-22)
Beneficios: se puede realizar de forma ambulatoria y en cualquier posición del paciente.
Limitaciones: debido al estímulo de la descarga adrenérgica que produce el ejercicio, esta prueba ha sido difícil de estandarizar; además, tiene una baja sensibilidad y especificidad.(16)
2. Evaluación de las Vías Parasimpáticas
2.1. Masaje del seno carotídeo
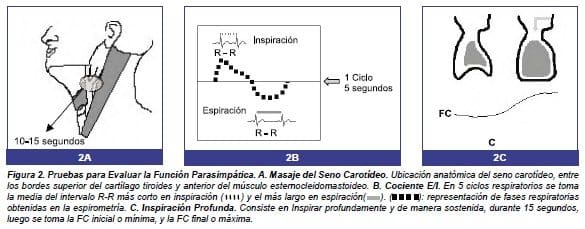
Metodología: con el sujeto en decúbito supino se realiza un masaje unilateral sobre el seno carotídeo, durante 10-15 segundos (Figura 2A). Si no hay respuesta, se debe masajear el seno contra lateral 1-2 minutos después. Se considera como respuesta normal la disminución de la FC y la PA sistólica, en relación con los valores básales obtenidos previos a la realización del masaje carotídeo. (4,14-16, 19,21)
Beneficios: esta prueba permite detectar la hipersensibilidad del seno carotídeo. (16, 19,21)
Limitaciones: la respuesta vagal incrementa con la edad; además, se recomienda descartar patología vascular en las arterias carótidas antes de realizar la prueba.(16,19,21)
2.2. Cociente espiración/inspiración (E/I)
Metodología: consiste en inspirar profundamente y espirar en 5 segundos. Se divide el intervalo R-R más largo que aparezca en el registro electrocardiográfico durante la espiración, dividido por el intervalo R-R más corto que se registre en inspiración (Figura 2B) medidos en 3 a 10 ciclos respiratorios, de los cuales se obtiene la media.(16,22)
Beneficios: algunos autores afirman que la aplicación única de esta prueba puede ser suficiente para evaluar la función vagal, dado que se correlaciona adecuadamente con la variabilidad de la FC, al tomarse esta última, como prueba de oro en la evaluación autonómica.(22)
Limitaciones: los valores de este cociente cambian con la edad y, a su vez, posee diferentes variables no estandarizadas como la profundidad, la frecuencia, el volumen corriente respiratorio o la hipocapnia generada por la hiperventilación.(16,22)
2.3. Prueba de inspiración profunda
Metodología: la maniobra consiste en realizar una inspiración lenta y profunda en reposo durante 15 segundos. Para su interpretación se divide la FC final o máxima sobre la FC basal o mínima (Figura 2C).(4,14,15,17,18,20,21)
Beneficios: durante la inspiración se estimulan los receptores de estiramiento pulmonar, los cuales disminuyen la actividad vagal provocando un incremento en la FC conocida como arritmia sinusal.(4,14,15,17,18,20,21) Esta prueba evalúa la vía parasimpático aferente y eferente.
Limitaciones: esta respuesta disminuye con la edad. Se deben controlar variables como la edad, la frecuencia y la profundidad de la respiración. (4,14-18, 20,21)
2.4. Respiración profunda controlada
Metodología: teniendo el sujeto en reposo, se le pide que realice respiraciones profundas, a una frecuencia de 6 ciclos por minuto, lo cual genera una disminución de la PA y la FC en cada ciclo respiratorio. La FC, así medida, es máxima en inspiración y mínima en espiración, por lo que se promedian las diferencias en cada ciclo, obteniendo el índice inspiraciónespiración. (19,21)
Beneficios: evalúa la vía parasimpático, periférica y central que es la que controla los diferentes estímulos mecánicos de la caja torácica.
Limitaciones: las respuestas que se obtengan dependen de la edad, el género, el volumen respiratorio e índice de masa corporal.(19)
3. Evaluación de Función Mixta
3.1. Maniobra de Valsalva
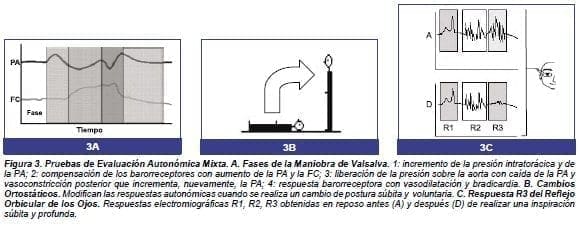
Metodología: es la espiración sostenida que se hace contra la glotis cerrada, en un sistema cerrado a una presión de 40 mm Hg durante 15 segundos (rango: 10 a 20 segundos). Monitorizar el EKG y la PA de manera continua (Figura 3A). Con esta maniobra se observan cuatro fases:
a. Fase 1:
Incremento en la presión intratorácica que comprime la aorta y eleva la PA.
b. Fase 2:
Por la disminución del retorno venoso, del gasto cardiaco y de la PA por el incremento de la presión intratorácica, los baro receptores generan una respuesta compensadora de estimulación simpática con aumento de la PA y la FC.
c. Fase 3:
Tres segundos después de terminar el esfuerzo espiratorio se libera la presión sobre la aorta y cae la PA, mejora el retorno venoso y se conserva la vasoconstricción, por lo que se incrementa nuevamente la PA.
d. Fase 4:
A los 10 segundos de terminar la maniobra de Valsalva, por el incremento de la PA, los barorreceptores producen una respuesta vagal que genera vaso dilatación y bradicardia.
Para el análisis se obtiene el índice de Valsalva. Éste resulta de dividir la FC máxima en la fase 2 (equivalente a la FC que se obtiene 3 segundos después de suspendida la maniobra) entre la FC mínima obtenida en la fase 4 (la que ocurre a los 10 segundos de haber suspendido la prueba). Algunos autores miden la PA, latido a latido, pero sus valores normales no se han establecido claramente.(4,14-23)
Beneficios:
Permite evaluar la función de los barorreceptores de manera directa. (21)
Limitaciones:
Sus resultados dependen de la edad y género. Así mismo, esta maniobra puede desencadenar arritmias en sujetos con síndrome QT prolongado.(16,4)
3.2. Cambios ortostáticos
Metodología: el individuo pasa de la posición decúbito supino a bipedestación de manera súbita. Esta maniobra genera taquicardia como respuesta compensadora a la hipotensión que ocurre por el cambio de posición (Figura 3B) y origina una respuesta abrupta en los primeros 3 segundos.
Esto ocurre, al parecer, por inhibición del tono vagal y activación del reflejo vaso presor que se origina por la estimulación metabólica muscular. De manera gradual la FC alcanza un nuevo tono basal a los 30 segundos que, en este caso, ocurre por acción del sistema parasimpático, aunque estos valores no son iguales a los obtenidos inicialmente cuando el sujeto se hallaba en decúbito supino, debido a la persistencia del tono simpático aumentado.
Para su interpretación se resta la media de la PA sistólica de los registros hechos cada minuto en los primeros 6 minutos en bipedestación y la PA sistólica basal en decúbito supino. La sensibilidad de la prueba incrementa si se toma la FC máxima y la mínima tras realizar la bipedestación. (16,20-22)
Beneficios: se basa en cambios fisiológicos dados por los cambios de posición, rutinarios, adoptados por el ser humano.
Limitaciones: los valores normales cambian con la edad. (16)
3.3. Respuesta R3 del reflejo orbicular de los ojos
Metodología: estando el individuo acostado y en reposo, se aplica un estímulo eléctrico en el nervio trigémino, 4 a 6 veces el umbral doloroso, cada 45 a 90 segundos, por cinco minutos, registrándose la actividad electromiográfica refleja en el músculo orbicular de los ojos. Se obtienen 3 respuestas reflejas llamadas R1, R2, R3 que aparecen antes de la reacción neuromuscular facial voluntaria (Figura 3C).
Algunas de estas respuestas disminuyen la amplitud, principalmente la R3, tras la estimulación vagal originada en la maniobra de Valsalva, llegando a la abolición total en inspiración profunda.(23,24) Se mide el porcentaje en que se modifica la respuesta R3, después de realizar las maniobras mencionadas.
Beneficios: permite evaluar respuestas autonómicas supraespinales mediadas por fibras C, cuyas conexiones a nivel de tallo cerebral generan inhibición de las moto neuronas gama, por sobre estimulación de las interneuronas de Renshaw, bloqueando el estímulo doloroso conducido por las fibras autonómicas del nervio trigémino.(23)
Limitaciones: se encuentra en investigación.
3.4. Variabilidad de la frecuencia cardíaca
Metodología:
La variabilidad de la frecuencia cardiaca (VFC) definida como la variación de la duración de los intervalos R-R, es decir entre latidos cardiacos, medida en un EKG de origen sinusal, se mide en trazados electrocardiográficos continuos cortos (5 minutos) o largos (Holter de 24 horas).(25) Los resultados se depuran de manera manual para detectar latidos anormales, artefactos y alteraciones en las velocidades de grabación que interfieren con la medición real de los cambios en intervalos de tiempo, más notorio en los registros largos.(9-11,25)
Los registros cortos son, relativamente, libres de ruidos y artefactos,(11) principalmente si se realizan en condiciones de reposo, con una frecuencia respiratoria controlada; su confiabilidad disminuye al medir resultados de intervención (Ej., mesa basculante, medicamentos). Los siguientes métodos miden la VFC:(9)
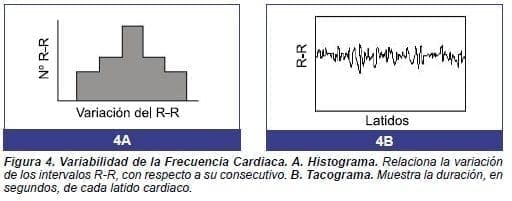
a. Análisis del dominio del tiempo.
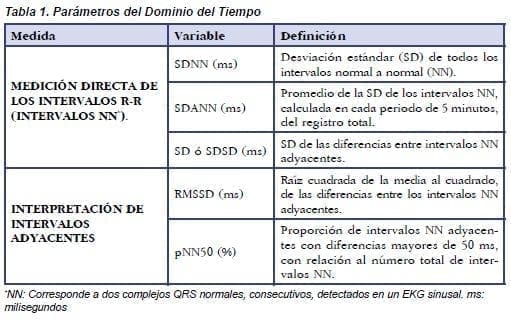
Describe comportamientos de la VFC en el tiempo, usualmente en registros electrocardiográficos de, por lo menos, 18 horas(26) y de allí se obtienen histogramas (Figura 4A).(3) Su interpretación se basa en métodos estadísticos que evalúan la variabilidad de los promedios y desviaciones estándar de los intervalos R-R (tabla 1).(7,9-11)
b. Análisis del dominio de la frecuencia.
Se basa en el análisis de fenómenos ondulatorios periódicos, utilizando estrategias matemáticas similares a las usadas para estudiar ondas físicas.(10) El registro de la variación de la FC en el tiempo se conoce como tacograma (Figura 4B).
Este muestra el valor en segundos de cada intervalo R-R y genera una gráfica sinusoidal, mostrando a la FC como una onda compleja, compuesta por varias ondas más simples. Esta gráfica se puede analizar mediante modelos matemáticos, obteniendo el poder espectral de la misma; es decir, la cantidad de energía acumulada de cada latido denominada densidad de poder espectral (eje y), discriminada por frecuencias entre 0 y 0,5 Hz (eje x).
Este método permite apreciar cuales son las frecuencias de las ondas que predominan y, a su vez, componen la onda compleja (Figura 5).
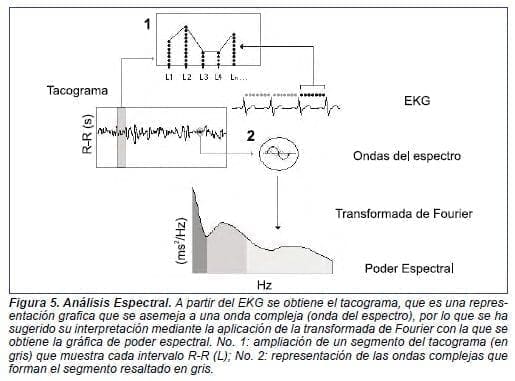
El análisis de dichas ondas se puede realizar por métodos no parametritos como la transformada rápida de Fourier, utilizado por su sencillez y confiabilidad.
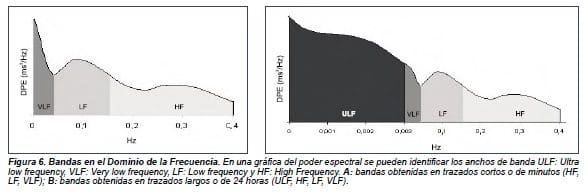
Las bandas de frecuencias espectrales, expresados en milisegundos elevados al cuadrado, se trasforman en Hertz al dividirlos por la media de la longitud de los intervalos R-R.(9) Dichas bandas de frecuencia son diferentes de acuerdo con la duración del registro (1,2,7,9-11,26,30) (Figura 6), y se denominan: a) Ultra bajas (Ultra Low Frecuency; ULF), b) Muy bajas (Very Low Frecuency; VLF), c) Bajas (Low Frecuency; LF), d) Altas (High Frecuency; HF) (tabla 2).
Dentro de los métodos paramétricos está el modelo de estimación autoregresiva que es más complejo y se encuentra aún en investigación.(3,7,9)
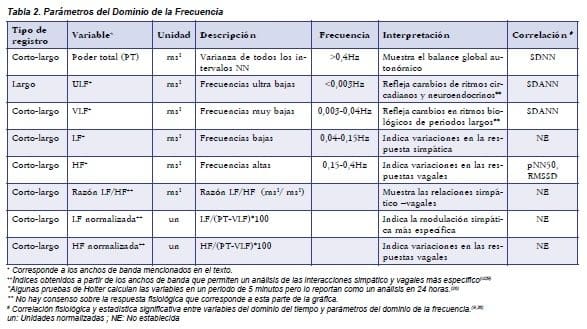
Los valores una vez normalizados:
Diminuyen el efecto del ruido y los artefactos y, a su vez, permiten determinar si los cambios observados en el poder espectral total son un reflejo de los cambios en los registros de LF y/o HF y, a su vez, comparar el efecto de diferentes intervenciones sobre el mismo sujeto, o individuos con grandes diferencias en el poder espectral total. Estos valores se deben correlacionar con el valor absoluto de LF y HF.(9,10)
c. Métodos no lineales. Basados en la teoría del caos, la cual estudia variables multivariadas no periódicas,
los patrones de fluctuación de los intervalos R-R se han podido medir de manera más precisa. Para lo cual se utilizan varios métodos: (9,11, 29,31)
c.1. Métodos geométricos:
Se basan en el análisis matemático de las Figuras geométricas que se obtienen al graficar los datos obtenidos tras convertir la variable de los intervalos NN a una escala discreta.
Dentro de estos se encuentra el histograma obtenido del registro de 24 horas, donde se determina la relación entre el número total de intervalos R-R y su variación, que se asemeja a un triángulo aplicándosele las correspondientes teorías geométricas para su análisis.
Así, la variabilidad de los intervalos R-R es la base del triángulo propuesto, y el valor más alto del histograma, es decir, la duración más frecuente observada en los intervalos R-R, es la altura del mismo.
Estos parámetros tienen buena correlación con el SDNN pero no sirven para evaluar la VFC en trazados cortos (5 minutos).(7,9,26)c.2.
Método de Poincaré:
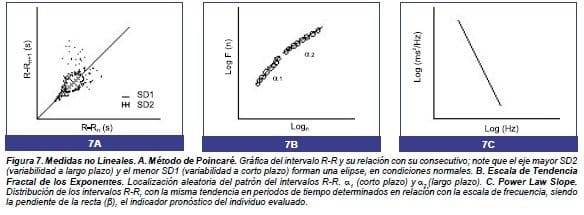
A partir de un registro electrocardiográfico de 24 horas, se toman los intervalos R-R como una función del intervalo siguiente. El parámetro visual de normalidad es una Figura alargada que semeja un bate de béisbol.
Al graficar la función matemática se obtiene una elipse en donde la desviación estándar 1 (SD1) es el eje corto de dicha elipse, que es la variabilidad R-R a corto plazo y refleja la modulación vagal de la FC; la desviación estándar 2 (SD2) es el eje largo de la elipse, que es la variabilidad del R-R a largo plazo y refleja la activación simpática (Figura 7A).(26,29,31) Los patrones anormales de los intervalos R-R se denominan patrones complejos que forman diferentes clases de Figuras que, cuando se tornan semiesféricas, indican una VFC disminuida.
c.3. Escala de tendencia fractal de los exponentes:
Determina el grado de aleatorización de intervalos R-R en una escala de 3 a 11 latidos consecutivos y genera una pendiente, llamada α1.
Ésta indica la aleatorización de la distribución de intervalos R-R cercanos a 1. Si α1 es igual a 0,5 el intervalo es aleatorio, mientras que si es 1,5 el intervalo se considera periódico. Valores disminuidos de α1 son predictores de muerte súbita, fibrilación auricular o vulnerabilidad a arritmias ventriculares; patrones más organizados o más periódicos se han observado en pacientes con enfermedad coronaria estable, sin infarto agudo de miocardio previo.
Otro valor llamado α2, no tiene una correlación clínica clara. α1 refleja actividad simpática mientras que α2 refleja factores humorales y metabólicos (Figura 7B).(26,31)
c.4. Poder de la ley de pendiente (Power law slope): se basa en la relación de las fluctuaciones del poder espectral y la frecuencia de un registro de 24 horas (entre 10-2 y 10-4Hz). Se obtiene del logaritmo de la ecuación P=Cfβ, donde P, es el poder espectral; f, es la frecuente ultra bajas.
Valores más negativos del parámetro β, es decir una pendiente más empinada, se han posibilidad en ancianos, pacientes post-infarto de miocardio o con aumencular, correlacionándose este último con una disminución de la VFC cia; C, es la constante de proporcionalidad y β, es el exponente negativo. Esto transforma la curva exponencial en una línea recta, donde se puede calcular su inclinación, siendo el exponente (β) la pendiente, que en sujetos normales es 1.
Este método refleja la distribución, o el grado,
En que la estructura de los intervalos R-R se comporta en periodos de minutos a horas, en la escala de frecuencia descrita, correspondiente a las bandas bajas y tu lado como predictores de mortato del riesgo de fibrilación venticular, correlacionándose este último con una disminución de la VFC (Figura 7C).(4,31)
c.5. Turbulencia de la frecuencia cardiaca:
Evalúa la perturbación, es decir, el acortamiento y/o alargamiento de los intervalos R-R, tras una extrasístole ventricular anormal. Calcula el inicio de la turbulencia, que es la comparación de los dos intervalos R-R siguientes a la extrasístole y los dos intervalos previos a ésta, tomando como valor normal el obtenido en los intervalos posteriores a la extrasístole.
El otro parámetro que se considera es la pendiente de la turbulencia obtenida en grupos de 5 intervalos R-R normales de 15 a 20 latidos posteriores a la extrasístole, dentro de un registro de 24 horas que contenga, por lo menos, 5 extrasístoles ventriculares.
Éste refleja el grado de alargamiento de los intervalos R-R que prosiguen al acortamiento de los intervalos posteriores a la extrasístole. Al parecer, estas res-puestas se deben a la acción de los barorreceptores, tras la caída del volumen sistólico por la presencia de la extrasístole y, se ha observado, que una reducción en la turbulencia es un indicador de la mortalidad postinfarto de miocardio. (26)
El registro electrocardiográfico debe ser de, por lo menos, 20 minutos; registros de menor duración no pueden ser analizados con estos métodos.(9,11,30) Para un mejor análisis se recomienda el uso de dominios dependientes del tiempo junto con modelos geométricos; las variables que se recomiendan son SDNN, SDANN, RMSSD y el índice triangular HRV. (9)
Beneficios: estandarizados por las sociedades americana y europea de cardiología, permiten identificar pacientes a riesgo de muerte así como de arritmias ventriculares o auriculares en sujetos previamente hipertensos o que evidencien apnea obstructiva del sueño, falla renal, neuropatía diabética, falla cardiaca, enfermedad coronaria, remodelación eléctrica local posterior a isquemia o necrosis miocárdica.
En sujetos sanos:
Además, permite predecir la aparición de enfermedades asociadas con una inadecuada adaptación autonómica como la enfermedad aguda de la montaña, entre otras. (2,9-11,19)
Limitaciones: se encuentra en experimentación. Hay gran variabilidad de los parámetros de acuerdo con la edad, el género, las enfermedades concomitantes, el ciclo sueño vigilia, el estrés físico o mental, las bajas temperaturas y la altitud sobre el nivel del mar.
Controlar, también, el mayor componente vagal que poseen las mujeres durante el día y tras el ejercicio rutinario.(1-3,9,10, 25,26,30,32-34) Igualmente, no hay consenso sobre el parámetro clínico más útil.(9,26) Y aunque tiene un buen valor predicativo negativo (77%-98%),(9,26) la sensibilidad, la especificidad y el valor predictivo positivo son limitados.(7,11,26)
Comentario Final
Teniendo en cuenta que en Colombia existe una alta prevalencia de trastornos neurocardiológicos, destacándose los producidos por infección con Tripanosoma cruzi,(35,36) así como de eventos sincopales “idiopáticos” en la población general,(37,38) los estudios descritos es este artículo pueden ser una herramienta muy útil para evaluar pacientes con disautonomías y su implementación permitiría una mayor y mejor aproximación al conocimiento del funcionamiento integral del sistema nervioso autónomo de los humanos.(39)
Referencias Bibliográficas
- 1. Akselrod S, Gordon D, Ubel A, Shannon D, Barger C, Cohen RJ. Power spectrum analysis of heart rate fluctuation: a quan-titative probe of beat-to-beat cardiovascular control. Science 1981; 213:220-222.
- 2. Lanfranchi P, Colombo R, Cremona G, Ba-derna P, Spagnolatti L, Mazzuero G, et al. Autonomic cardiovascular regulation in subjects with acute mountain sickness. Am J Physiol Heart Circ Physiol 2005; 289: H2364–H2372.
- 3. Vesga B, Sanabria C, Leon-S FE. Regula-ción autonómica de la frecuencia cardiaca y la presión arterial. Acta Neurol Col 2000; 16:112-120.
- 4. Chaves AM, Vesga BE, Rueda OL, Silva FA, Padilla LM, Amado LM, et al. Pruebas para la evaluación del sistema nervioso autónomo. Salud UIS 1998; 28:62-70.
- 5. Blanco CA, Torres MA, Leon-S FE. Neuro cardiología: Pasado, presente y futuro de la interrelación cerebro-corazón. Neuro-ciencias Col 2001; 9: 61-66.
- 6. Schram G, Pourrier M, Melnyk P, Nattel S. Differential distribution of cardiacion chan-nel expression as a basis for regional spe-cialization in electrical function. Circ Res 2002; 90: 939-950.
- 7. Task Force of the European Society of Cardiology and the North American Socie-ty of Pacing and Electrophysiology. Heart rate variability: Standards of measurement, physiological interpretation and clinical use. Circulation 1996; 93: 1043-1065.
- 8. Bers D. Cardiac excitation–contraction cou-pling. Nature 2002; 415:198-205.
- 9. Sztajzel J. Heart rate variability: a noninva-sive electrocardiographic method to mea-sure the autonomic nervous system. Swiss Med Wkly 2004; 134:514–522.
- 10. Gallo J, Farbiarz J, Alvarez D. Análisis es-pectral de la variabilidad de la frecuencia cardiaca. Iatreia 1999; 12:61-71.
Fuentes Bibliográficas
- 11. Pumprla J, Howorka K, Groves D, Chester M, Nolan J. Functional assessment of heart rate variability: Physiological basis and prac-tical applications. Int J Cardiol 2002; 84:1-14.
- 12. Cruz A, León FJ, Hernández H. Regulación normal de la presión arterial sistémica. Rev Mex Cardiol 2004;15:30-41.
- 13. Universidad Pablo de Olavide. Maestría en Neurociencias y Biología del comporta-miento. Barcelona: Viguera; 2006.
- 14. Chaves A, Vesga BE, Orozco LC, Rueda OL, Silva FA, Padilla LM, et al. Evaluación autonómica en sujetos normales. Acta Med Colomb 1998; 23: S197.
- 15. Chavez AM, Vesga BE, Orozco LC, Rueda OL, Silva FA, Padilla LM, et al. Valoración de la función autonómica en sujetos sanos de la ciudad de Bucaramanga. Acta Med Colomb 1999. 30: 28-33.
- 16. Freeman R. Assessment of cardiovascular autonomic function. Clin Neurophysiol 2006; 112:716-730.
- 17. Gelber D, Pfeifer M, Dawson B, Schumer M. Cardiovascular autonomic system test: Determination of normative values and effect of confounding variables. J Auton Nerv Syst 1997; 62: 40-44.
- 18. Ducla JL, Santos M, Laranjo S, Andrade A, Ducla E, Boto JP, et al. Wavelet analysis of autonomic outflow of normal subjects on head-up tilt, cold pressor test, valsalva maneuver and deep breathing. Exp Phy-siol 2007; 92: 677-686.
- 19. Morillo CA, Guzman JC. Evaluación del sistema nervioso autónomo. En: Uribe MG, ed. Guía Neurológica. Bogota: Asociación Colombiana de Neurología 2006; 7: 221-35.
- 20. American Academy of Neurology. Thera-peutic and technology assesment subcom-mittee assesment: Clinical autonomic tes-ting. Neurology 1996; 46: 873-880.
- 21. Echeverri D, Morillo C, Bohórquez R, Ja-ramillo M, Moreno P, Díaz A, et al. Evalua-ción del sistema nervioso autónomo en personas asintomáticas. Acta Med Colomb 1992. 17: 81-85.
Otras Referencias Bibliográficas
- 22. May O, Arildsen H. Assessing cardiovas-cular autonomic neuropathy in diabetes mellitus. How many tests to use?. J Diabe-tes Complicat 2000; 14:7-12.
- 23. Leon-S FE, Torres M. El reflejo orbicular de los ojos (R3) y la maniobra de Valsalva. Rev Neurol 2001;32:1020-1022.
- 24. Leon-S FE, Bayona J, Bayona E. Un nuevo test autonómico. Parte I. Salud UIS 1999; 31: 71-73.
- 25. Sandercock GR, Bromely PD, Brodie DA. The reliability of short-term measurements of heart rate variability. Int J Cardiol 2005; 103: 238-247.
- 26. Kleiger RE, Stein PK, Bigger TJ. Heart rate variability: mesurement and clinical utility. Ann Noninvasive Electrocardiol 2005;10: 87-99.
- 27. Saito S. Tanobe K, Yamada M, Nishihara F. Relationship between arterial oxygen saturation and heart rate variability at high altitudes. Am J Emerg Med 2005; 23: 8-12.
- 28. Malliani A, Montano N, Pagani M. Physio-logical background of heart rate variability. Card Electrophysiol Rev 1997; 1: 343-346.
- 29. Huikuri HV, Mäkikallio TM, Perkiömäki J. Measurement of heart rate variability by methods based on nonlinear dynamics. J Electrocardiol 2003; 36: 95-99.
- 30. Malliani A, Pagani M, Lombardi F, Cerutti S. Cardiovascular neural regulation explored in the frequency domain. Circulation 1991; 84: 482-492.
- 31. Perkiömäki J, Mäkikallio TM, Huikuri HV. Nonlinear analysis of hearth rate variabili-ty: fractal and complexity measures of hearth rate variability. Ann Noninvasive Electro-cardiol 2000; 5: 179-187.
- 32. Fukusaki C, Kawakubo K, Yamamoto Y. Assessment of the primary effect of aging on heart rate variability in humans. Clin Auton Res 2000; 10: 123-130.
Otras Fuentes Bibliográficas
- 33. Agelink M, Malessa R, Baumann B, Majew-ski T, Akila F, Zeit T, et al. Standardized tests of heart rate variability: normal ran-ges obtained from 309 healthy humans, and effects of age, gender, and heart rate. Clin Auton Res 2001; 11: 99-108.
- 34. Bernardi L, Passino C, Wilmerding V, Da-llam G, Parker D, Robergs R, et al. Brea-thing patterns and cardiovascular autono-mic modulation during hypoxia induced by simulated altitude. J Hypertens 2001; 19:947-958.
- 35. Pinto NX, Torres MA, Mendoza E, Leon-Sarmiento FE. Immune response, nitric oxi-de, autonomic dysfunction and stroke: a puzzling linkage on Trypanosoma cruzi infection. Med Hypoth 2002, 58: 374-377.
- 36. Leon-Sarmiento FE, Mendoza E, Torres-Hillera M, Pinto N, Prada J, Silva CA, et al. Trypanosoma cruzi-associated cerebrovas- cular disease: a case-control study in eastern Colombia. J Neurol Sci 2004; 217: 61-64
- 37. Leon-S FE, Pradilla G, Pardo CA, Puentes F. The first neuroepidemiological study performed in Colombia using the world health organization protocol. Neuroscien-ces (Tokyo) 1993; 19: 127-130.
- 38. Pradilla G, Vesga BE, Leon-Sarmiento FE, Bautista L, Vesga E, Gamboa N. Neuro-epidemiología en el oriente colombiano. Rev Neurol 2002; 34: 1035-1043.
- 39. Chaves AM, Vesga BE, Gonzalez Z, Sana-bria CL, Leon-S FE. La Prueba de esfuerzo como instrumento para la evaluación de la función cardiovascular. Salud UIS 1999; 30: 60-64.
* Residentes I, Medicina Aeroespacial, Universidad Nacional, Bogotá, Colombia.
** Neurólogo, PhD, Unidad de Movimientos Anormales y Neuromagnetismo, Fundación Santa Fe de Bogotá/Uni. Ciencia Research Group, Universidad Nacional, Bogotá, Colombia.
Correspondencia: feleones@gmail. com
Recibido: junio de 2007
Aceptado para publicación: junio de 2007
Actual. Enferm. 2007;10(3):14-22