PELAYO CORREA1
Palabras clave: estómago; neoplasmas gástricos; Helicobacter pylori; pronóstico
Resumen
El cáncer gástrico representa la primera causa de mortalidad por cáncer en Colombia. La mayor parte de los casos se diagnostican cuando las células malignas han invadido la capa muscular, lo cual conlleva una tasa de sobrevida a los cinco años inferior a 20%.
El cáncer invasivo gástrico esta precedido por un prolongado proceso precanceroso que empieza en la niñez como resultado de la infección con Helicobacter pylori. Las etapas siguientes incluyen atrofia multifocal de las glandulas, metaplasia intestinal y displasia. En pacientes con diagnostico de metaplasia intestinal se debe evaluar la extensión de la lesión y el grado de diferenciación para determinar la conducta a seguir. Aunque las tasas de incidencia de cáncer gástrico han estado disminuyendo en las últimas décadas, recientemente se ha detectado un aumento en personas jóvenes, de causa desconocida.
Introducción al cáncer invasivo gástrico
El cáncer gástrico representa una gran carga social. Aproximadamente, un millón de casos se esperan a nivel mundial para 2010 y es la segunda causa de muerte por cáncer en el mundo. En el Registro Poblacional (sic.) de Cáncer de Cali ocupaba el primer puesto en incidencia hasta ~1991, cuando fue sobrepasado por el cáncer de próstata. Sin embargo, sigue siendo la primera causa de mortalidad por cáncer (Luis Eduardo Bravo,comunicación personal). En las décadas recientes se observa una tendencia decreciente en incidencia y mortalidad en muchos países.
Pronóstico
El cáncer gástrico es generalmente letal cuando se descubre clínicamente. La mayoría de los casos se diagnostica cuando el tumor ha invadido la capa muscular del estómago, y en tales casos la tasa de supervivencia a los 5 años es inferior al 20%.
En Japón, un país con una de las tasas de incidencia más altas del mundo, hay un esfuerzo generalizado para su diagnóstico temprano, lo que ha logrado incrementar significativamente la proporción de casos diagnosticados como “cáncer temprano”, es decir, cuando el tumor está limitado a la capa mucosa y a la submucosa del estómago. La resección quirúrgica o endoscópica en dichos casos conlleva una tasa de supervivencia a los 5 años superior al 90%. Puesto que en las etapas tempranas el tumor es clínicamente silencioso, en ausencia de un programa como el de Japón, la mejor estrategia para el control de la enfermedad es la prevención.
La Cascada Precancerosa

El cáncer gástrico invasivo está precedido por un prolongado proceso precanceroso que dura varias décadas y ofrece amplias oportunidades para descubrir y tratar lesiones precancerosas. Cuando éstas están en un estadio avanzado merecen un seguimiento endoscópico periódico para identificar las lesiones antes de que lleguen a la etapa de cáncer invasivo.
Las etapas clásicas de la cascada precancerosa, ilustradas en la figura 1, han sido bien caracterizadas desde el punto de vista histopatológico. Se postula que el avance de una etapa a la siguiente está determinado por factores etiológicos ligados al proceso inflamatorio. La secuencia propuesta es la siguiente: gastritis crónica activa • gastritis atrófica multifocal (pérdida de glándulas gástricas) • metaplasia intestinal completa • metaplasia intestinal incompleta • displasia (neoplasia intraepitelial) de bajo grado o de alto grado • cáncer invasivo.
En la práctica clínica, la cascada precancerosa generalmente se identifica como un diagnóstico de metaplasia intestinal en la biopsia gástrica. El manejo clínico de un paciente con dicho diagnóstico no está claramente definido. En la figura 2 se propone un algoritmo para el manejo clínico de dichos pacientes (1). Los elementos diagnósticos que justifican un seguimiento endoscópico periódico tienen que ver con la extensión de la metaplasia y el grado de diferenciación. Si la metaplasia es muy extensa o es clasificada por el patólogo como “incompleta” o “tipo colon”, indica un mayor riesgo de transformación neoplásica y el paciente debe seguirse en el tiempo con endoscopias repetidas. Así se puede diagnosticar un carcinoma “temprano” o una displasia de alto grado que debe manejarse con resección quirúrgica o endoscópica.

El Modelo Etiológico
Se considera que la fuerza que promueve el proceso precanceroso es la infección por Helicobacter pylori. La conexión entre dicha infección y la patología gástrica avanzada fue hecha en Australia por el patólogo Robin Warren y el gastroenterólogo Barry Marshall, que les hizo merecer el Premio Nobel de Medicina en 2005. Demostraron una asociación causal con la úlcera péptica y mencionaron la posibilidad de un papel en el cáncer gástrico.
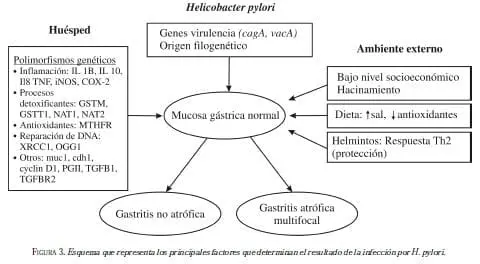
El resultado clínico de la infección sigue el modelo epidemiológico de causalidad y está modulado por la interacción de tres grupos de fuerzas etiológicas: las asociadas a la bacteria, al huésped y al ambiente externo. El modelo está esquemáticamente ilustrado en la figura 3. La relación de los factores etiológicos hace que la mucosa gástrica normal se convierta en una gastritis crónica, que puede evolucionar de dos maneras: 1) hacia la gastritis no atrófica, que no está asociada a riesgo alto de cáncer, o 2) hacia la gastritis multifocal atrófica, que puede acompañarse de metaplasia intestinal, con sus implicaciones de alto riesgo de cáncer.
Los factores asociados al agente bacteriano dependen de la virulencia de la cepa infecciosa, la cual está determinada principalmente por dos genes que definen la secreción de dos toxinas principales. La toxina citotóxica la define el gen llamado cagA (cytotoxin associated gene). La toxina vacuolizadora está definida por el gen vacA (vaculating cytotoxin). Ambos genes son polimorfos. El gen cagA hace parte de un conjunto de ~40 genes denominados la “isla de capacidad patógena (pathogenicity)”, que no está presente en todas las cepas.
Otros genes de esta isla codifican un aparato secretor de tipo IV, una especie de jeringa cuya aguja penetra la membrana epitelial e inyecta la toxina CagA en el citoplasma de la célula epitelial de la mucosa gástrica. Este sistema de inyección de la toxina es importante porque la gran mayoría de las bacterias permanecen en la luz, por fuera del tejido gástrico. Algunas bacterias están muy cerca de la célula epitelial, la cual forma una prominencia o “pedestal” que facilita la acción del sistema secretor. Una vez inyectada, la toxina es fosforilada e inicia una cadena de reacciones que modifican el citoesqueleto y dan comienzo al proceso precanceroso.
El gen de la toxina vacuolizadora está en todas las bacterias pero su expresión depende de los polimorfismos de la bacteria. El gen tiene una zona de “señal” o “s” que puede ser de tipos 1 ó s2. Las formas s1 pueden ser a, b o c, que estimulan la secreción de la toxina. La forma s2 no estimula la secreción de la toxina. La región media del gen, “m”, puede ser m1, asociada con secreción de la toxina, o m2, que no se asocia a la secreción de la toxina. La toxina vacuolizadora actúa sobre la membrana de la célula epitelial y disuelve las uniones intercelulares, lo cual le permite a H. pylori localizarse entre dos células epiteliales.
La bacteria necesita capturar la urea que se filtra entre las células epiteliales. Con su potente ureasa, la bacteria hidroliza la urea. Este proceso resulta en la producción de CO2, que se expira en el aire exhalado y sirve para diagnosticar la infección, y el gas NH4 que forma una nube de pH neutro que le permite a la bacteria sobrevivir en el medio hostil, con pH muy ácido, de la luz gástrica. La toxina abre brechas en la membrana de la célula epitelial y forma vacuolas intracitoplásmicas.
1 Anne Potter Wilson Professor, Department of Medicine and Department of Pathology, Vanderbilt University Medical Center, Nashville, TN, United States.
