Colombian Consensus on Chronic Intestinal Failure in Short Bowel Syndrome
Resumen
Introducción. Los términos falla intestinal crónica, síndrome de intestino corto (SIC) y nutrición parenteral total son muy frecuentes en la práctica clínica cotidiana. El objetivo de esta guía fue establecer un marco de referencia de práctica clínica basado en el mejor de nivel de evidencia en pacientes con falla intestinal crónica secundaria a síndrome de intestino corto.
Métodos. Se estableció un grupo de expertos interdisciplinarios en el manejo de la falla intestinal crónica quienes, previa revisión de la literatura escogida, se reunieron de manera virtual acogiendo el método Delphi para discutir una serie de preguntas seleccionadas, enfocadas en el contexto terapéutico de la falla intestinal crónica asociada al síndrome de intestino corto.
Resultados. La recomendación del grupo de expertos colombianos es que se aconseje a los pacientes con SIC consumir dietas regulares de alimentos integrales que genere hiperfagia para compensar la malabsorción.
Las necesidades proteicas y energéticas dependen de las características individuales de cada paciente; la adecuación del régimen debe ser evaluada a través de pruebas clínicas, antropométricas y parámetros bioquímicos.
Se sugiere, especialmente a corto plazo después de la resección intestinal, el uso de análogos de somatostatina para pacientes con yeyunostomía de alto gasto en quienes el manejo de líquidos y electrolitos es problemático. En pacientes con SIC, que son candidatos a tratamiento con enterohormonas, Teduglutida es la primera opción.
Conclusión. Existen recomendaciones en el manejo integral de la rehabilitación intestinal respaldadas ampliamente por este consenso y es importante el reconocimiento de alternativas terapéuticos enmarcadas en el principio de buenas prácticas clínicas.
Palabras claves: síndrome del intestino corto; intestino delgado; enfermedades inflamatorias del intestino; programas y políticas de nutrición y alimentación; nutrición parenteral total; hormonas gastrointestinales.
Abstract
Introduction. The terms chronic intestinal failure, short bowel syndrome (SBS), and total parenteral nutrition are very common in daily clinical practice. The objective of this guideline was to establish a reference framework for clinical practice based on the best level of evidence in patients with chronic intestinal failure secondary to short bowel syndrome.
Methods. A group of interdisciplinary experts in the management of chronic intestinal failure was established who, after reviewing the selected literature, met virtually using the Delphi method to discuss a series of selected questions, focused on the therapeutic context of chronic intestinal failure associated with short bowel syndrome.
Results. The recommendation of the Colombian expert group is that patients with SBS be advised to consume regular diets of whole foods that generate hyperphagia to compensate malabsorption. Protein and energy needs depend on the individual characteristics of each patient; the adequacy of the regimen must be evaluated through clinical, anthropometric tests and biochemical parameters. The use of somatostatin analogue is suggested, especially in the short term after bowel resection, for patients with high-output jejunostomy in whom fluid and electrolyte management is problematic. In SBS, who are candidates for enterohormonal therapy, Teduglutide is the first choice.
Conclusion. There are recommendations on the comprehensive management of intestinal rehabilitation that are widely supported by this consensus and it is important to recognize therapeutic alternatives framed in the principle of good clinical practice.
Keywords: short bowel syndrome; small intestine; inflammatory bowel diseases; nutrition programs and policies; total parenteral nutrition; gastrointestinal hormones.
Introducción – Falla Intestinal Crónica en Síndrome de Intestino Corto
La falla intestinal crónica (FIC), el síndrome de intestino corto (SIC) y la nutrición parenteral total (NPT) son términos muy frecuentes en la práctica clínica cotidiana, por lo que se deben precisar.
La insuficiencia intestinal fue definida por primera vez en 1981 por Fleming y Remington como “una reducción en la masa intestinal funcional debajo de la cantidad mínima necesaria para una digestión y absorción adecuadas de alimentos”.
Puede deberse a enfermedades adquiridas o congénitas, gastrointestinales o sistémicas, benignas o malignas, y se presenta a cualquier edad.
Puede tener un inicio abrupto o ser la evolución lenta y progresiva de una enfermedad crónica, o ser una afección autolimitada, de corta o larga duración, que es la enfermedad denominada falla intestinal crónica.
El tratamiento de FIC se basa en la rehabilitación intestinal con programas que tienen como objetivo restaurar la función intestinal a través de la nutrición, la terapia farmacológica o quirúrgica.
Sin embargo, los pacientes con FIC irreversible están destinados a necesitar nutrición parenteral domiciliaria (NPD) de por vida o someterse a un trasplante intestinal.
La definición de falla intestinal (FI) de Fleming y Remington ha sido revisada por otros expertos, pero ninguna sociedad científica ha ideado todavía una definición formal y una clasificación de la FI.
Más aún, la FI no está incluida en la lista de términos de PubMed MeSH, ya que falla es el término que describe un estado de no funcionamiento de órganos.
Una búsqueda en PubMed el 15 de marzo 2014, utilizando “insuficiencia intestinal” como término general, no obstante, generó un total de 981 ítems, y mostró que el número de publicaciones ha crecido rápidamente en las últimas décadas, lo que indica una mayor conciencia de esta condición.
El objetivo general de este consenso fue establecer un marco de referencia de práctica clínica basado en el mejor nivel de evidencia para el tratamiento de pacientes de la población colombiana con falla intestinal crónica secundaria a síndrome de intestino corto.
Estado del Arte – Falla Intestinal Crónica en Síndrome de Intestino Corto
Definiciones
Se define falla intestinal (FI) como la reducción de la función intestinal que impide el mínimo necesario para la absorción de macronutrientes, agua o electrolitos, de modo que la suplementación intravenosa es necesaria para mantener la salud y la vida.
La insuficiencia intestinal consiste en la reducción de la absorción intestinal que no requiere suplementación intravenosa para mantener la salud o el crecimiento.
El panel reconoció FI como un “estado no funcional”, donde la función intestinal hace referencia a la capacidad de absorción de proteínas, lípidos, carbohidratos, agua y electrolitos. El umbral para la pérdida de esta función fue la necesidad de administración de nutrición intravenosa para mantener la salud o el crecimiento.
La FIC en sí, como enfermedad benigna, se incluyó en la lista de enfermedades huérfanas en Colombia, actualizada en la Resolución 005265 de 2018, donde se somete a estos pacientes a un reporte obligatorio al Ministerio de Salud a través del sistema de vigilancia en salud pública – SIVIGILA.
Factores pronósticos – Falla Intestinal Crónica en Síndrome de Intestino Corto
Las principales variables que pueden afectar los resultados de supervivencia, morbilidad y mortalidad son la edad, la presencia de enfermedades asociadas de base, la longitud del intestino delgado remanente, la pérdida de la válvula ileocecal, la presencia de sepsis abdominal y la falla hepática.
Se ha descrito que la longitud crítica del intestino remanente para evitar el uso de NPD es de más de 35 cm en pacientes con anastomosis yeyuno-íleal, más de 60 cm en pacientes con anastomosis de yeyuno-cólica, y más de 115 cm en pacientes con yeyunostomía.
Del mismo modo, se ha descrito como un fuerte predictor de mortalidad, el porcentaje de intestino remanente sobre la longitud del intestino normal, en donde un intestino remanente menor del 10 % se asocia con mayor mortalidad (RR 5,7; IC95% 1,82 – 18,16; p=0,003).
La pérdida de la válvula ileocecal es otro factor pronóstico importante en pacientes con resección ileal, debido a que es la principal barrera al reflujo del material colónico y retrasa el tránsito intestinal dando más tiempo para la absorción de nutrientes.
La pérdida de la válvula ileocecal se asocia con SIC y es un predictor independiente de la autonomía nutricional posterior a resección intestinal, evitando la dependencia de NPD.
Así mismo, la presencia de la continuidad del colon en el sitio de la anastomosis mejora la absorción de líquidos y mantiene un apropiado tránsito intestinal, asociándose con una mejor autonomía nutricional posterior a resección.
Clasificación funcional – Falla Intestinal Crónica en Síndrome de Intestino Corto
Sobre la base de los criterios de inicio, metabolismo y resultados esperados, la FI es clasificada desde el punto de vista funcional como se presenta a continuación.
Falla intestinal tipo I
Es una afección común, aguda, de corta duración y generalmente auto limitada, que ocurre aproximadamente en el 15 % de los pacientes después de una cirugía abdominal o en asociación con enfermedades críticas, como lesiones en la cabeza y neumonía, o enfermedades agudas, como la pancreatitis.
Mientras se recupera la función intestinal, es posible que se requiera apoyo nutricional y de líquidos parenterales a corto plazo.
El íleo postoperatorio generalmente se resuelve de manera espontánea en unos pocos días; su duración puede acortarse mediante técnicas de recuperación multimodal con el objetivo de promover la movilización y la introducción temprana de la nutrición oral. Estos pacientes suelen ser tratados en salas de recuperación postanestésica, aunque algunos pacientes en entornos de cuidados críticos también encajan en esta categoría.
Falla intestinal tipo II
Es una afección poco común, que se observa con mayor frecuencia en el escenario de una catástrofe intraabdominal (como peritonitis debido a lesión visceral) y casi siempre se asocia con complicaciones sépticas, metabólicas y nutricionales complejas. La insuficiencia renal también puede estar presente.
A menudo ocurre en un sujeto previamente sano que presenta isquemia mesentérica, vólvulo o traumatismo abdominal, como complicación de una cirugía intestinal con fuga anastomótica, con una lesión intestinal inadvertida y no reconocida que requiere una enterectomia masiva, o que desencadene la formación de una o más fístulas enterocutáneas.
Con menos frecuencia, puede ser la complicación de una FI crónica de tipo III, que representa una condición de FI “aguda sobre crónica”.
Es una condición aguda pero más prolongada, en pacientes que requieren cuidados multidisciplinarios complejos y suplementación intravenosa y que pueden requerir nutrición parenteral durante períodos de semanas o meses.
El resultado es más prometedor, frecuentemente alcanzan una rehabilitación intestinal completa (alrededor del 40 %), pero pueden requerir nutrición enteral, incluida la alimentación distal (10 %), o desarrollar una FI tipo III con necesidad de NPT prolongada (50 %).
Falla intestinal tipo III
Es una enfermedad crónica, en pacientes metabólicamente estables, que requieren NPT a largo plazo.
La FIC puede ser la evolución de una FI aguda de tipo II y el resultado de enfermedades benignas sistémicas o gastrointestinales progresivas y devastadoras, que a menudo requieren resecciones intestinales múltiples (enfermedad de Crohn, radioenteritis, poliposis familiar, pseudoobstrucción intestinal crónica, linfangectasia intestinal o esclerosis sistémica).
Es la principal característica clínica de las enfermedades digestivas congénitas como gastrosquisis, atresia intestinal, enfermedad de inclusión de microvellosidades y displasia epitelial, o la etapa avanzada y terminal de un cáncer abdominal o pélvico. La FIC debido a una enfermedad benigna puede ser una condición reversible.
El destete de NPT en casa después de 1 a 2 años ocurre en el 20 % al 50 % de los pacientes, dependiendo de las características del FIC.
Los pacientes con FIC debido a una enfermedad benigna tienen una alta probabilidad de supervivencia a largo plazo con NPD (alrededor del 80 % en adultos y 90 % en niños a los 5 años). En general, cerca de dos tercios de los pacientes pueden tener rehabilitación social y laboral total, así como una buena calidad de vida.
Clasificación fisiopatológica
La falla intestinal se clasifica en cinco condiciones fisiopatológicas principales, que pueden tener su origen en diversos trastornos gastrointestinales o sistémicos:
- Intestino corto
- Fístula intestinal
- Dismotilidad intestinal
- Obstrucción mecánica
- Enfermedad extensa de la mucosa del intestino delgado.
Síndrome de intestino corto
En adultos, la longitud normal del intestino delgado, medida en autopsias o cirugías, desde el ángulo de Treitz hasta la válvula ileocecal varía de 275 a 850 cm.
La característica clínica asociada con una continuidad del intestino delgado de menos de 200 cm es definida como síndrome de intestino corto (SIC). El intestino corto constituye la principal causa de FIC tipo III y representa alrededor del 75 % de adultos y 50 % de niños con NPD.
El mecanismo fisiopatológico primario de la FI en el paciente con SIC es la superficie de absorción intestinal reducida. La probabilidad de desarrollar una FI asociado a SIC depende de la longitud residual del intestino delgado en continuidad y de varios mecanismos fisiopatológicos concomitantes relacionados con la anatomía, la integridad, la función y el potencial adaptativo del pequeño remanente intestinal, así como la condición clínica subyacente del paciente.
El intestino corto puede ser el resultado de resecciones quirúrgicas extensas o de enfermedades congénitas del intestino delgado. Es promovido por la presencia de nutrientes en el lumen intestinal, por las secreciones pancreáticas y biliares y por las hormonas intestinales producidas principalmente por el íleon y el colon. Generalmente dura de 1 o 2 años.
En adultos con alto riesgo para desarrollar FI debido a una longitud inadecuada de intestino delgado en continuidad, el SIC se presenta cuando hay:
- Menos de 35 cm de intestino delgado con anastomosis yeyuno-ileal con colon intacto
- Menos de 60 cm con anastomosis yeyunocólica.
- Intestino delgado de menos de 115 cm de longitud con yeyunostomía terminal.
Al parecer la adaptación intestinal postoperatoria puede estar ausente o alterada en presencia de una yeyunostomía terminal.
Otros mecanismos que contribuyen a la FI pueden ser el exceso de líquido, las pérdidas intestinales de electrolitos en presencia de una yeyunostomía terminal, restricción de la ingesta oral de nutrientes en un intento de disminuir las pérdidas intestinales, reducción de la ingesta oral debido a la hipofagia subyacente relacionada con la enfermedad y la incapacidad para desarrollar la hiperfagia adaptativa posterior a la resección.
La FI asociada a SIC puede ser reversible debido al proceso de adaptación o programas de rehabilitación intestinal basados en tratamientos médicos y quirúrgicos.
La probabilidad de lograr liberación de la NPT es del 50 % en adultos y hasta un 73 % en niños. Sin embargo, la liberación completa de la NPT en pacientes con SIC es poco probable que ocurra (< 10 %) después de que hayan transcurrido 2-3 años desde la resección intestinal más reciente.
El grado de disfunción intestinal en el SIC es difícil de cuantificar objetivamente. Se ha propuesto a la concentración plasmática de citrulina como una medida de la función de los enterocitos, que también puede predecir la dependencia de la NP, aunque su uso en la práctica clínica requiere una mayor validación.
Por el momento, el grado y la naturaleza del desequilibrio de nutrientes, líquidos o electrolitos secundarios al SIC pueden predecirse por la longitud y también por el sitio anatómico del segmento intestinal afectado o resecado. En los 100 cm proximales del yeyuno tiene lugar muy poca absorción de agua o sodio y es característica la pérdida secretora hacia la luz.
Clasificación clínica de falla intestinal crónica
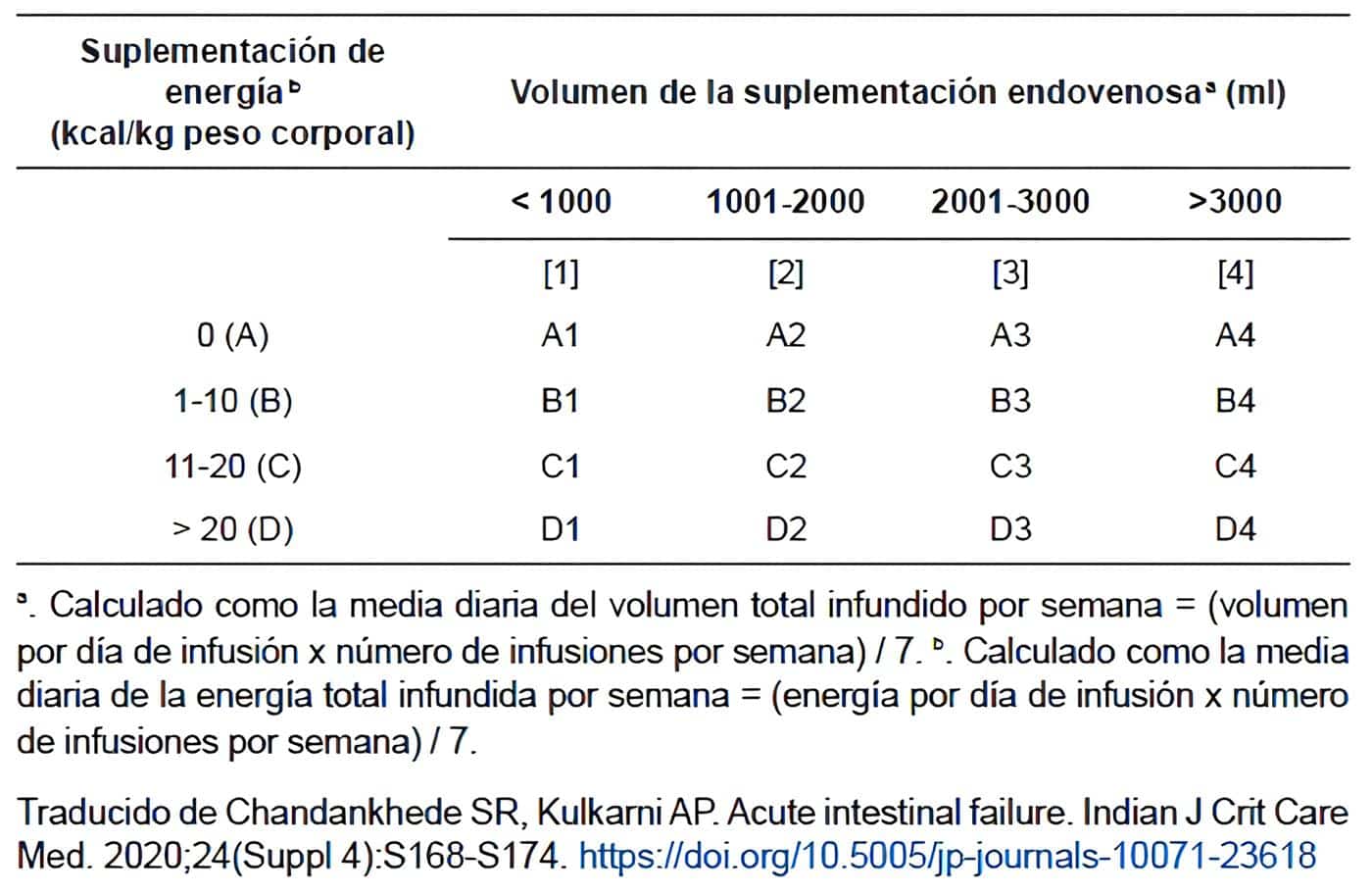
Sobre la base de los requisitos de energía y el volumen de la suplementación intravenosa, la FI se puede clasificar en 16 subtipos (Tabla 1).
Tabla 1. Clasificación clínica de falla intestinal crónica
Adaptación intestinal
La adaptación intestinal es un proceso compensatorio natural que ocurre después de una resección intestinal extensa. Los cambios estructurales y funcionales en el intestino mejoran la absorción de nutrientes y líquidos en el intestino remanente.
El grado de adaptación intestinal que se puede lograr está relacionado con la extensión de la resección y la anatomía del intestino remanente.
Por ejemplo, la adaptación es más pronunciada en el íleon que en el yeyuno, lo que puede explicar en parte, los mejores resultados observados en los pacientes que retienen algo de tejido ileal en comparación con los pacientes con yeyunostomía terminal.
Para los pacientes adultos con SIC, el grado de adaptación intestinal del intestino remanente es uno de los factores que determina si se desarrolla insuficiencia intestinal permanente y es necesaria la nutrición parenteral de por vida.
Características fisiológicas de la adaptación intestinal
Cambios estructurales asociados con la adaptación intestinal
La mucosa epitelial del intestino delgado intacto experimenta una autorrenovación continua a través de la proliferación de células de las criptas, migración y diferenciación en células mucosas especializadas (enterocitos, células enteroendocrinas, células caliciformes o células de Paneth), y al final de sus ciclos de vida, las células epiteliales diferenciadas sufren apoptosis.
En estudios con animales se observó que la resección del intestino delgado es seguida por una rápida aceleración de la proliferación de células de las criptas; como resultado, la profundidad de las criptas y la altura de las vellosidades aumentan.
Por el contrario, la atenuación de la apoptosis no parece ser un mecanismo de adaptación intestinal; la tasa puede aumentar moderadamente como consecuencia de una mayor proliferación de células de las criptas y un mayor número total de enterocitos.
La resección intestinal también se asocia con angiogénesis local y los aumentos resultantes en la oxigenación tisular y el flujo sanguíneo. Estos cambios apoyan el crecimiento de la mucosa y también pueden mejorar la función de absorción (Figura 1).
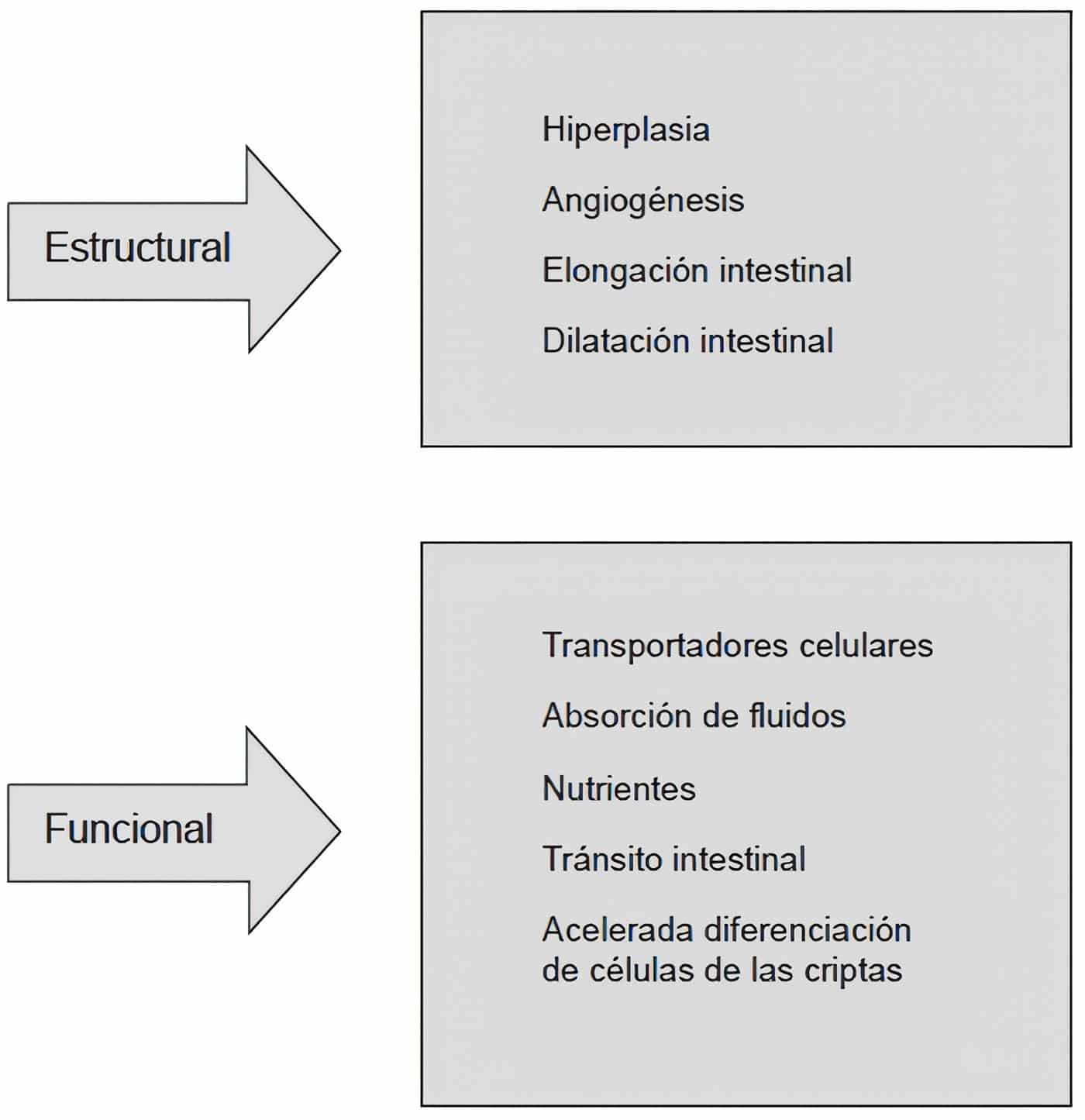
Figura 1. Cambios asociados con la adaptación intestinal.
Cambios funcionales asociados con la adaptación intestinal
Paralelo a los cambios estructurales, también se producen adaptaciones funcionales que aumentan la capacidad de absorción después de la resección.
En estudios con animales se ha visto que la resección intestinal se asocia con una mayor expresión de proteínas transportadoras e intercambiadores involucrados en la absorción de nutrientes, electrolitos y agua, incluidos el cotransportador de glucosa y sodio, intercambiadores de Na + / H + y adenosina trifosfatasas de Na + / K +.
Los estudios han documentado una elevación de la expresión del transportador o intercambiador que no es totalmente el resultado de una mayor masa de enterocitos.
Además, los enterocitos en desarrollo expresan enzimas digestivas y transportadoras de aminoácidos más rápidamente después de la resección del intestino delgado que en un intestino intacto, lo que sugiere un proceso de maduración acelerado.
El resultado neto de estos cambios en la expresión y actividad de las proteínas es aumentar la actividad digestiva y capacidad de absorción del intestino remanente.
Unos estudios más antiguos en humanos adultos documentaron una mayor absorción de glucosa por unidad de longitud de intestino después de la resección. Sin embargo, el aumento de la capacidad de absorción observado en estos estudios podría ser el resultado de la hiperplasia localizada, de la adaptación funcional o de ambos.
Factores claves en la adaptación intestinal
Múltiples factores pueden influir en el grado de adaptación intestinal que ocurre después de la resección, incluidas las características anatómicas, la vía de administración de la nutrición y las hormonas y factores de crecimiento.
Características anatómicas
El sitio de la resección intestinal influye en el grado de adaptación posterior y el íleon muestra un mayor potencial adaptativo que el yeyuno. En los seres humanos, las resecciones proximales se asocian con una disminución de la diarrea y la esteatorrea en comparación con las resecciones distales del íleon.
Esto puede atribuirse al hecho de que, en condiciones normales, el intestino distal está expuesto a menos nutrientes luminales, que actúan como potentes estímulos para el crecimiento intestinal. De hecho, en el intestino no resecado, la altura de las vellosidades disminuye gradualmente a lo largo del eje proximal-distal.
Además, en los estudios de transposición, un segmento ileal que se mueve proximalmente experimenta una adaptación, como es evidente por el aumento significativo en el crecimiento de la mucosa y la absorción de glucosa, incluso en la ausencia de pérdida de tejido.
Por el contrario, el tamaño de las vellosidades disminuye en los segmentos yeyunales que se han transpuesto distalmente.
La extensión de la resección también afecta el resultado adaptativo. Tanto en humanos como en animales, una mayor pérdida de tejido se correlaciona positivamente con la adaptación después de la cirugía.
Sin embargo, la capacidad del intestino para compensar completamente la pérdida de tejido es limitada.
En un estudio retrospectivo de 268 pacientes adultos con SIC, la longitud del intestino remanente de menos de 75 cm se asoció significativamente con una mayor probabilidad de dependencia permanente de la NPT en un análisis multivariado.
Papel de los nutrientes enterales
Se requiere estimulación del intestino para mantener la estructura de la mucosa. La ausencia de nutrición por esta vía induce atrofia de la mucosa y disminuye la actividad de las enzimas digestivas y los transportadores de nutrientes, en animales y humanos, incluso cuando se proporcionan las calorías adecuadas a través de la NP.
La atrofia de la mucosa inducida por NP se revierte con la reintroducción de la nutrición enteral. Por el contrario, los nutrientes luminales mejoran la adaptación posterior a la resección.
Además, el aumento de la complejidad de los nutrientes se asocia con una mayor adaptación, probablemente debido a la mayor actividad digestiva requerida para la absorción de nutrientes.
Por ejemplo, ratas y cerdos alimentados con una dieta mezcla de vegetales, proteína animal y minerales, después de la resección intestinal mostraron una mayor adaptación estructural y actividad enzimática digestiva que animales similares que recibieron una dieta elemental.
Los nutrientes individuales se han asociado con efectos intestino-tróficos después de la resección.
Las grasas, en particular, parecen promover la adaptación. En comparación con la comida estándar, una dieta alta en grasas se asoció con un aumento significativo del peso intestinal y la altura de las vellosidades 14 días después de la resección en ratas.
En contraste, una dieta baja en grasas redujo los marcadores de adaptación intestinal en comparación con una dieta alta en grasas con el mismo número de calorías. Las grasas específicas pueden variar en su capacidad para estimular la adaptación.
Los triglicéridos de cadena larga son superiores a los triglicéridos de cadena media para inducir hiperplasia del epitelio intestinal en el contexto posterior a la resección. Sin embargo, entre los triglicéridos de cadena larga, no se ha resuelto el beneficio relativo de los ácidos grasos saturados frente a los poliinsaturados.
De manera similar, las dietas ricas en ácido docosahexaenoico y ácido araquidónico, los ácidos grasos poliinsaturados, estimularon mayores aumentos en la masa mucosa que las dietas ricas en aceite de cártamo o aceite de coco. Pero los pacientes con SIC y colon en continuidad generalmente no pueden tolerar dietas altas en grasas debido a la esteatorrea y la reducción de la absorción de nutrientes.
Tiempo de la adaptación intestinal en humanos adultos
Los datos relacionados con el momento y la duración de la adaptación intestinal en humanos adultos son escasos. Según el consenso general, la mayor parte de la adaptación intestinal en adultos ocurre dentro de los primeros 2 años después de la resección.
En un estudio, Messing publicó que el 95 % de 64 pacientes con insuficiencia intestinal transitoria obtuvieron autonomía enteral en los primeros 2 años posteriores a la resección, pero otros estudios sugieren que puede ocurrir una adaptación significativa más allá de los 2 años en los adultos.
Muchos de los pacientes con SIC, pero no todos, logran autonomía enteral en el período posterior a la resección. Maximizar la adaptación en el remanente intestinal mediante la aplicación de terapias intestinotróficas más nuevas puede mejorar los resultados para estos pacientes.
Estudios recientes sugieren que algunos pacientes pueden lograr la independencia de la NP incluso muchos años después de la resección inicial. Estos datos argumentan en contra de la afirmación dogmática de larga data de que la adaptación ocurre solo en los primeros 12 a 24 meses después de la resección y brindan una esperanza adicional para los pacientes con SIC.
Evaluación de la adaptación intestinal
En comparación con la gran cantidad de estudios en animales que investigan la adaptación intestinal posterior a la resección, el número de estudios en los humanos es relativamente pequeño.
La citrulina plasmática, un aminoácido no esencial producido por los enterocitos, se considera como un biomarcador sustituto de la masa de enterocitos.
En varios estudios, los niveles plasmáticos de citrulina se correlacionaron fuertemente con la longitud remanente del intestino delgado.
El nivel de citrulina menor a 20 μmol/L (es decir, la mitad del nivel normal en controles adultos) se asoció significativamente con la dependencia permanente de NP cuando se midió más de 2 años después de la última cirugía abdominal.
Sin embargo, permanece sin resolver la pregunta de si los niveles de citrulina reflejan con precisión la capacidad de absorción funcional del intestino delgado. Algunos estudios han informado una correlación entre los niveles plasmáticos de citrulina y la absorción de nutrientes, mientras que otros no.
En estudios en humanos, se han utilizado otros parámetros como sustitutos para la adaptación posterior a la resección, incluido el destete de la NP, el efecto compuesto de líquidos (es decir, aumento de la producción de orina, disminución de NP o líquidos intravenosos, reducción de la ingesta oral de líquidos), la relación entre la ingesta y el peso de las heces y la relación entre la ingesta oral y la absorción de azúcares inertes.
Importancia de la válvula ileocecal Desde finales de la década de los 70, algunos autores como J. Cosner describieron el impacto de malabsorción que generaba la ausencia de la válvula ileocecal producto de resecciones ileales asociada a hemicolectomía derecha y se establecía como hipótesis de la importancia de este esfínter al impedir la colonización extensa del intestino delgado por bacterias colónicas y disminuir el tiempo del tránsito intestinal facilitando el proceso de absorción.
La ausencia del colon derecho puede causar un exceso de productos que deberían ser absorbidos allí, como son las sales biliares, ácidos grasos y carbohidratos modificados por las fibras colónicas, generando un cambio de la flora intestinal y favoreciendo los mecanismos de malabsorción.
Fisiopatología e implicaciones de la resección intestinal
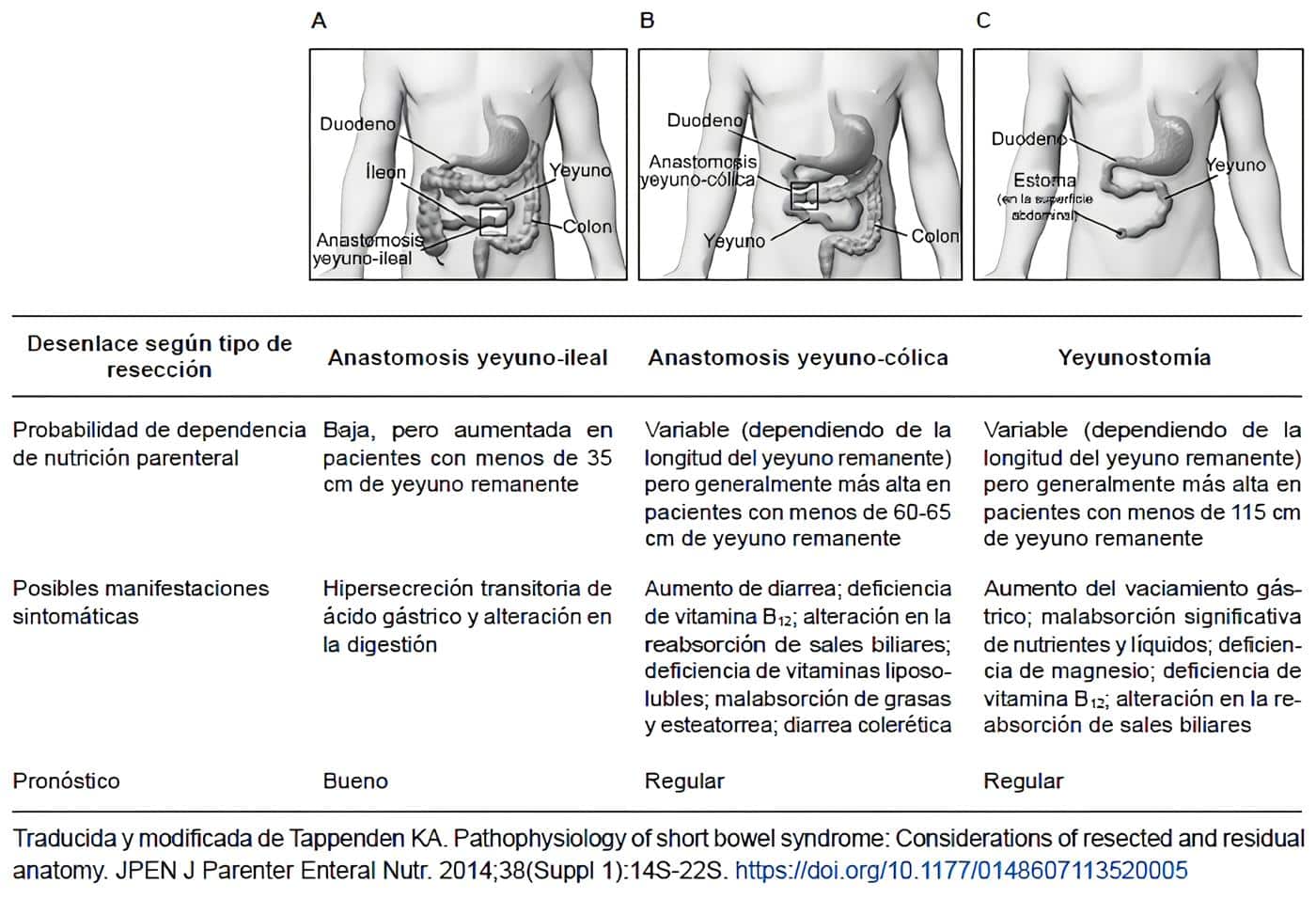
En pacientes con SIC, la alteración del gradiente proximal-distal de digestión y absorción depende de la anatomía de la resección y del intestino remanente. Los 3 tipos más comunes de resecciones intestinales en pacientes con SIC son la anastomosis yeyuno-ileal, la anastomosis yeyuno-cólica y la yeyunostomía.
En una anastomosis yeyuno-ileal, se reseca una porción del yeyuno y, a veces, parte del íleon, y las secciones restantes se unen; estos pacientes retienen el íleon terminal y el colon permanece en continuidad con el intestino delgado.
En una anastomosis yeyuno-cólica, el yeyuno se une al colon después de la resección del íleon. Los pacientes con una yeyunostomía terminal tienen un estoma que está conectado al remanente del yeyuno; se extirpan el íleon, el colon y parte del yeyuno.
Debido a la anatomía alterada y a la fisiopatología asociada, cada una de estas resecciones se asocia con un rango y una gravedad diferentes de los síntomas del SIC, como se resume en la Tabla 2.
Tabla 2. Tipos de resección intestinal y resultados asociados.
Anastomosis yeyuno-ileal (tipo III)
En general, las resecciones del intestino proximal son más manejables que las resecciones distales debido a la extensión y la adaptación funcional exhibida por el íleon, la cual es mayor que la del duodeno o el yeyuno.
Por lo tanto, los pacientes con anastomosis yeyuno-ileal rara vez presentan desequilibrios importantes de nutrientes o electrolitos porque el íleon remanente y el colon intacto pueden compensar la ausencia de los tejidos resecados.
Además, después de la resección, el colon es capaz de convertirse en un órgano digestivo vital que puede aportar hasta 4,2 mJ/d de energía adicional a través de la producción de ácidos grasos de cadena corta (AGCC) a partir de los carbohidratos mal absorbidos que llegan a la microbiota residente.
Los pacientes con anastomosis yeyuno-ileal suelen mantener una hidratación adecuada por 2 razones principales.
En primer lugar, las uniones estrechas del íleon son menos permeables que las del yeyuno, por lo cual entra menos agua en la luz ileal que en la luz yeyunal tras la ingestión de una comida hiperosmótica.
En segundo lugar, el colon tiene una gran capacidad de reserva para la absorción de líquidos. Aunque en condiciones normales, el colon absorbe alrededor de 1,9 L de líquido por día, tiene el potencial de absorber hasta 5 L de líquido por día.
Debido a que la mayoría de los pacientes con anastomosis yeyuno-ileal mantienen el duodeno y parte del yeyuno, el desarrollo de una deficiencia de nutrientes debido a la disminución de la digestión y absorción específicas del sitio es relativamente poco frecuente.
Sin embargo, las resecciones yeyunales pueden resultar en una disminución de las hormonas reguladoras producidas por las células yeyunales.
Por ejemplo, la hipersecreción gástrica a menudo ocurre en la fase aguda posterior a la resección debido a la pérdida de colecistocinina y los mecanismos de inhibición por retroalimentación de secretina, que normalmente regulan la secreción de gastrina y ácido gástrico.
Como resultado, el pH del intestino delgado proximal aumenta, lo que puede desnaturalizar las enzimas pancreáticas y perjudicar la digestión.
La fase de hipersecreción de ácido gástrico suele ser transitoria, dura unas pocas semanas o meses, y los pacientes a menudo pueden ser tratados con éxito con inhibidores de la bomba de protones.
Anastomosis yeyuno-cólica (tipo II)
Las resecciones ileales típicamente dan como resultado una enfermedad más grave que la resección yeyunal debido a la capacidad de adaptación disminuida del yeyuno en relación con el íleon. Las resecciones ileales más extensas se asocian con peores resultados.
Entre los pacientes con anastomosis yeyuno-cólica, aquellos con un intestino remanente de menos de 60 cm tienen el mayor riesgo de dependencia de NP.
Los pacientes con resecciones ileales también tienen más probabilidades de experimentar diarrea que los pacientes con resecciones yeyunales porque al disminuir la reabsorción de agua por el intestino delgado distal se ejerce una presión adicional sobre la capacidad de absorción de agua del colon. Si además del íleon se reseca parcialmente el colon, la diarrea se agrava aún más.
La resección ileal da como resultado la pérdida de proteínas absorbentes especializadas, como la vitamina B12 y los receptores y transportadores de sales biliares.
La suplementación con vitamina B12 es necesaria en estos pacientes debido al déficit de receptores específicos de B12, normalmente localizados en el íleon distal. La reducción de la absorción de sales biliares después de la resección del íleon puede resultar en malabsorción de grasas, deficiencia de vitaminas liposolubles, esteatorrea y diarrea colerética.
La concentración plasmática de mediadores hormonales de la digestión también se ve afectada por la resección ileal, en particular, los niveles de péptido YY (PYY) y los péptidos similar al glucagón (GLP-1 y GLP-2), los cuales son sintetizados en el íleon distal y el colon por las células L enteroendocrinas, y se regulan positivamente después de la ilectomía, siempre que el colon permanezca en continuidad.
El GLP-1 y PYY inhiben el vaciamiento gástrico, la secreción de ácido gástrico y la motilidad del intestino delgado, dando como resultado que los pacientes con resecciones de íleon y colon en continuidad exhiben tiempos normales de vaciamiento gástrico.
El tránsito intestinal de sólidos y la hipersecreción de ácido gástrico es menos grave después de una resección ileal que después de una resección yeyunal.
El otro mediador cuya expresión está regulada al alza es el GLP-2, una hormona peptídica intestinotrófica, que aumenta la altura de las vellosidades y la proliferación de células de las criptas, entre otros efectos, y por lo tanto juega un papel importante en la mediación de la adaptación intestinal después de la resección.
Yeyunostomía (tipo III)
Los pacientes con una yeyunostomía terminal tienen problemas de malabsorción más graves que los pacientes con anastomosis yeyuno-ileal o yeyuno-cólica porque carecen de íleon y colon.
Por lo tanto, estos pacientes enfrentan los mismos déficits en la absorción específica del sitio ileal y la recuperación de agua que los pacientes con anastomosis yeyuno-cólica, pero no obtienen los beneficios de absorción de líquido y de recuperación de energía de un colon intacto.
Los pacientes con yeyunostomía terminal con menos de 100 cm de intestino remanente tienden a ser “secretores netos”, lo que significa que su producción de líquido y sal por el estoma excede su ingesta, porque las secreciones gástrica e intestinal no se reabsorben. Estos pacientes típicamente requieren NP a largo plazo.
El magnesio normalmente se absorbe en el intestino delgado distal y el colon; como resultado, las deficiencias de magnesio son comunes en pacientes con una yeyunostomía terminal.
Al igual que los pacientes con una resección ileal, los pacientes con una yeyunostomía terminal también pierden la absorción específica del sitio de vitamina B12 y sales biliares.
A diferencia de los pacientes con anastomosis yeyuno-cólica, los pacientes con una yeyunostomía terminal presentan un vaciado gástrico y un tránsito intestinal acelerados.
Los cambios en las hormonas intestinales después de la yeyunostomía probablemente contribuyan a este fenómeno. Debido a que los pacientes con una yeyunostomía terminal carecen de las células L ileales distales y colónicas que producen PYY, los niveles de esa hormona disminuyen después de la resección.
Ningún estudio ha examinado específicamente las concentraciones de GLP-1 en pacientes con una yeyunostomía terminal.
Se ha informado que los sujetos sanos que se sometieron a una infusión de glucosa que se restringió al intestino delgado proximal no mostraron cambios en el GLP-1, mientras que los niveles plasmáticos de GLP-1 aumentaron cuando se infundió glucosa en todo el intestino delgado.
Los pacientes con una yeyunostomía terminal también presentan menores aumentos posprandiales en GLP-2 que los sujetos sanos. Se ha demostrado en algunos estudios en humanos que GLP-2 inhibe el vaciamiento gástrico, por lo que los niveles reducidos de GLP-2 pueden conducir a un aumento de las tasas de vaciamiento gástrico en pacientes con una yeyunostomía terminal.
Entre los sujetos sanos, además de estas alteraciones hormonales, la amplitud, velocidad y distancia de propagación de las contracciones posprandiales en el yeyuno son significativamente mayores que en el íleon.
Así, el tránsito intrínseco de los nutrientes a través del yeyuno puede ser más rápido que a través del íleon, lo que resulta en un menor tiempo de contacto entre el nutriente y la mucosa para la digestión y absorción.
Las complicaciones de la malabsorción de líquidos y nutrientes en pacientes con SIC pueden extenderse a tejidos y órganos más allá del tracto gastrointestinal. Los cálculos renales de oxalato cálcico sintomáticos se desarrollan en casi una cuarta parte de los pacientes con anastomosis yeyuno-cólica y con menos de 200 cm de intestino remanente.
La deficiencia de sales biliares en estos pacientes impide la solubilización completa y la absorción de los ácidos grasos, que luego se unen preferentemente al calcio intraluminal.
En condiciones normales, el calcio se une al oxalato en el intestino distal, formando un precipitado que se expulsa en las heces.
Pero cuando el calcio se une a los ácidos grasos mal absorbidos, el exceso de oxalato libre es absorbido por la mucosa colónica y excretado por el riñón, lo que aumenta la probabilidad de formación de cálculos renales de oxalato.
Para compensar el riesgo de nefrolitiasis en los pacientes con SIC y colon preservado, se debe limitar la ingesta de oxalato en la dieta y aumentar el consumo de calcio.
Debido a que los pacientes con resecciones ileales tienen reservas de ácidos biliares disminuidas, el colesterol insuficientemente solubilizado puede sobresaturar la bilis y promover la formación de cálculos biliares.
Otros factores que contribuyen al desarrollo de cálculos biliares en el SIC incluyen la reducción de la contractilidad de la vesícula biliar, el metabolismo alterado de la bilirrubina y la hipersecreción de mucina, una proteína promotora de la nucleación.
Es más probable que se desarrollen cálculos biliares en pacientes con restos intestinales más cortos, etiología de la enfermedad de Crohn, ausencia de válvula ileocecal y dependencia total de NP a largo plazo.
Sin embargo, la prevalencia de cálculos biliares es lo mismo entre pacientes con y sin colon-en-continuidad. Los cálculos biliares ocurren en hasta el 25 % a 45 % de los pacientes con SIC; aunque muchos cálculos biliares detectados en pacientes con SIC son asintomáticos, la colecistitis puede desarrollarse en hasta el 10 % de los pacientes.
Hay otras complicaciones crónicas asociadas al SIC, incluyendo enfermedad hepática y biliar, enfermedad ósea metabólica, sobrecrecimiento bacteriano del intestino delgado, hiperoxaluria entérica y acidosis D-láctica.
Métodos Se estableció un grupo de expertos multi e interdisciplinarios en el manejo de la falla intestinal crónica quienes se reunieron de manera virtual, acogiendo el método Delphi, para discutir una serie de preguntas seleccionadas por su relevancia en la práctica clínica en Colombia, enfocadas en el contexto terapéutico de la falla intestinal crónica asociada al síndrome de intestino corto.
Se revisaron los artículos seleccionados de la literatura mediante la estrategia de búsqueda que utilizó las siguientes palabras clave: ((short bowel syndrome) OR (intestinal failure)) AND (((loperamide) OR (teduglutide therapy)) OR (teduglutide)) (Figura 2).
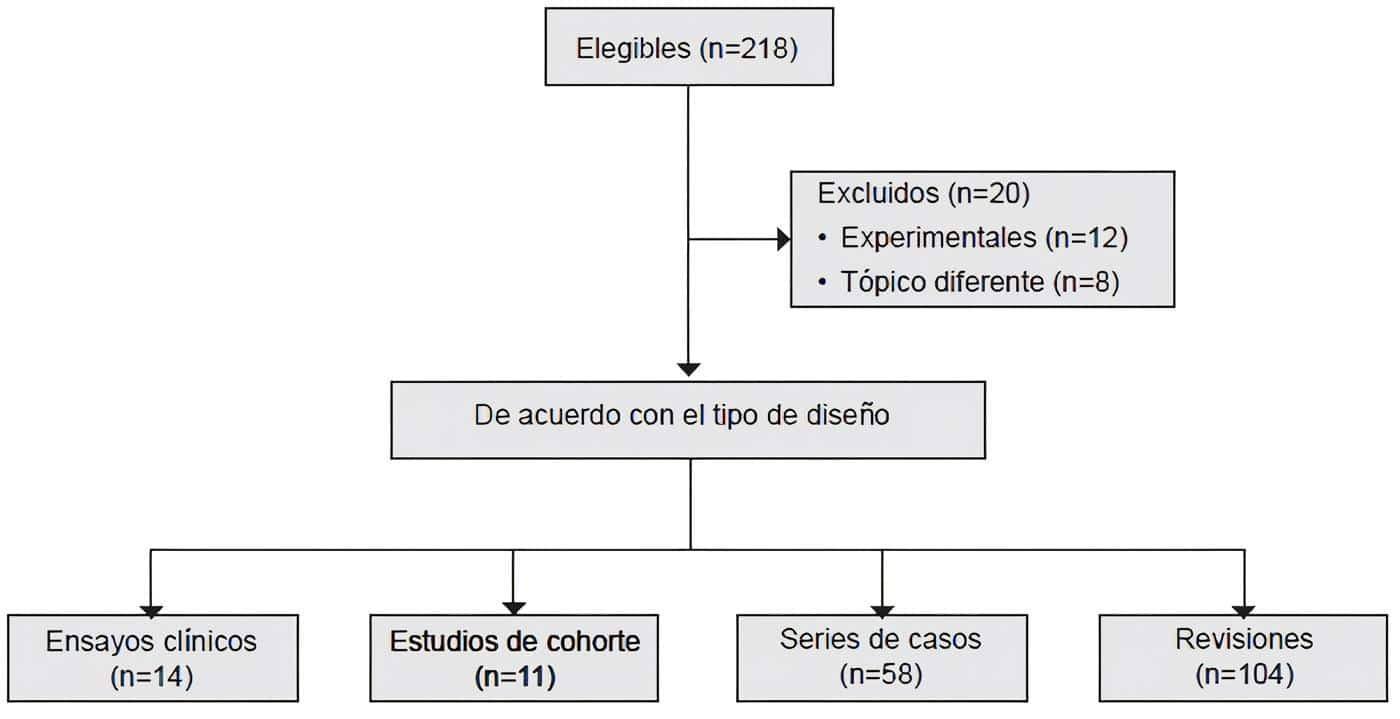
Figura 2. Falla Intestinal Crónica – Artículos seleccionados de la literatura mediante la estrategia de búsqueda.
Preguntas Analizadas
A continuación, se presentan los resultado de la reunión de expertos colombianos de acuerdo con la discusión de las preguntas más relevantes en la práctica clínica seleccionadas.
Intervención nutricional – Falla Intestinal Crónica en Síndrome de Intestino Corto
1. ¿Cuál es la dieta sugerida en los pacientes con falla intestinal crónica y SIC?
El consenso de expertos recomienda que se aconseje a los pacientes con SIC que consuman dietas regulares de alimentos integrales, estableciendo una estrategia que genere hiperfagia para compensar la malabsorción.
Una dieta alta en carbohidratos (60 %) y baja en grasas (20 %) es preferible en pacientes con SIC con colon en continuidad para aumentar gradualmente la absorción de energía, mientras que la relación grasa/carbohidratos parece de menor importancia en pacientes sin colon.
El manejo de dieta por boca debe ser guiado por metas objetivas, basado en requerimientos calóricos y proteicos establecidos por un grupo multidisciplinario de soporte nutricional, realizando monitoria semanal.
Se recomienda una dieta con alto contenido de triglicéridos de cadena media (TCM), que confiere un beneficio marginal en absorción. Una dieta rica en grasas por TCM mejoró la absorción de energía en aproximadamente 1,5 MJ/día en pacientes con SIC con colon preservado.
Se sugiere que la lactosa no se excluya de la dieta de pacientes con SIC, a menos que se haya documentado intolerancia a la lactosa.
Así mismo, se recomienda la adición de suplementos nutricionales isotónicos orales en pacientes limítrofes (es decir, categoría B1 de clasificación clínica) con FIC en riesgo de desnutrición.
El objetivo es proporcionar una mejor distribución y exposición máxima de la superficie intestinal disponible a los nutrientes mientras se estimulan las secreciones gastrointestinales y las secreciones hormonales endógenas que son importantes para avanzar al proceso de adaptación intestinal.
Se sugiere el uso de NE en combinación con alimentación oral en pacientes con FIC con bajo nivel de dependencia a la NPT. (Grado de evidencia: bajo).
2. ¿Cuál es la recomendación de macronutrientes y micronutrientes de la NPT para paciente con SIC y falla intestinal crónica?
Macronutrientes
Se recomienda que las necesidades proteicas y energéticas de los pacientes con FIC se basen en las características individuales del paciente (por ejemplo, la capacidad de absorción del intestino estimada por la anatomía gastrointestinal o enfermedad subyacente) y las necesidades específicas (por ejemplo, enfermedad aguda, desnutrición proteica), y que la adecuación del régimen sea regularmente evaluada a través de pruebas clínicas, antropométricas y parámetros bioquímicos.
(Grado de evidencia: muy bajo).
Las pautas internacionales han recomendado que los requerimientos de proteínas sean de 0,8 a 1 g/kg/día, administrando aminoácidos esenciales y no esenciales en las prescripciones de NPT.
Muchos pacientes estables en NPD se mantienen satisfactoriamente en prescripciones que aportan 0,8-1,4 g de proteína.
Los pacientes con NPT a menudo tienen una ingesta oral significativa que puede absorberse, al menos parcialmente, y contribuir a la ingesta de energía. Se ha demostrado que el colon es un órgano que ahorra energía. Muchos pacientes estables con NPT se mantienen satisfactoriamente con un total de 20-35 kcal/kg/día.
Se recomienda que la mayoría de los pacientes con NPT a largo plazo para FIC, sin complicaciones metabólicas en curso, se traten de forma segura con suministro de emulsión lipídica de no más de 1 g/kg/día vía intravenosa. (Grado de evidencia: muy bajo).
Micronutrientes
El consenso de expertos sugiere que los síntomas, signos clínicos e índices bioquímicos de la deficiencia de vitaminas, o la toxicidad, se deben evaluar regularmente en la revisión clínica. (Grado de evidencia: muy bajo).
Un informe inicial de análisis de laboratorio de 63 personas con NPD identificó que el 24 % tenía vitamina A por debajo de los niveles normales, 30 % niveles bajos de vitamina D y 45 % niveles bajos de vitamina C, mientras que las vitaminas B12 y el folato estaban por debajo de lo normal sólo en 7 % y 0 % de las personas, respectivamente.
Así mismo, se sugiere que los síntomas, signos clínicos e índices bioquímicos de oligoelementos o elementos trazas, y la deficiencia o la toxicidad, se evalúen regularmente en la revisión clínica. (Grado de evidencia: muy bajo).
Los requerimientos de oligoelementos durante la enfermedad y en los pacientes con NP a largo plazo aún están mal definidos. No es suficiente el conocimiento de los mecanismos sobre cómo la enfermedad afecta el metabolismo de los micronutrientes o los efectos de las diferencias en el modo de entrega.
Intervención farmacológica – Falla Intestinal Crónica en Síndrome de Intestino Corto
3. ¿Cuáles son las recomendaciones sobre análogos de somatostatina en FIC-SIC?
El grupo de expertos sugiere, especialmente a corto plazo después de la resección intestinal, el uso de análogos de la somatostatina para pacientes con yeyunostomía de alto gasto en quienes el manejo de líquidos y electrolitos es problemático, a pesar de los procedimientos convencionales.
La somatostatina disminuye las secreciones gástricas, biliares y pancreáticas y puede inhibir la perdida de agua y electrolitos inducida por secretagogos. También estimula la absorción de cloruro y sodio en el íleon, disminuye la motilidad intestinal e inhibe la liberación de hormonas que pueden contribuir a la diarrea, como el péptido intestinal vasoactivo (VIP, por sus siglas en inglés), la hormona peptídica gastrointestinal (GIP, por sus siglas en inglés) y la gastrina.
(Grado de evidencia: bajo).
4. Recomendaciones del uso de antidiarreicos y otras estrategias farmacológicas en FIC-SIC:
El panel de expertos recomienda el uso de inhibidores de la bomba de protones, reconociendo su capacidad para reducir el peso húmedo fecal y la excreción de sodio, en especial durante los primeros seis meses después de la cirugía, principalmente en aquellos pacientes con SIC con una producción fecal superior a 2 L/día.
También recomiendan el uso de loperamida vía oral para reducir el peso húmedo y la excreción fecal de sodio en pacientes con SIC y una ostomía. En pacientes con SIC con ostomía alta, el uso de loperamida se guía por mediciones objetivas de su efecto. Se prefiere la loperamida porque no es adictivo o sedante.
(Grado de evidencia: moderado).
El uso de medicamentos antidiarreicos tiene como objetivo reducir las pérdidas de agua y electrolitos para minimizar los síntomas y consecuencias de la diarrea. Los opiáceos aumentan el tono muscular a nivel duodenal e inhiben la actividad motora propulsora, retardan el vaciamiento gástrico acelerado y prolongan el tiempo de tránsito intestinal, que puede beneficiar a algunos pacientes con SIC.
Algunos antidiarreicos (principalmente codeína, difenoxilato y opio) pueden tener efectos secundarios en el sistema nervioso central, como sedación, y pueden tener capacidad para generar adicción. Por el contrario, la loperamida carece de efectos a nivel del sistema nervioso central, siendo más específico del intestino, con una duración más prolongada. Se deben tener en cuenta las interacciones con medicamentos que actúen a nivel de citocromo p450 y los signos de toxicidad.
(Grado de evidencia: moderado).
5. ¿Cuáles son los fundamentos biológicos y fisiológicos para el uso de enterohormonas en pacientes con SIC?
El GLP-2 es sintetizado por las células L enteroendocrinas del intestino delgado distal y el colon, en respuesta a la estimulación de nutrientes. En modelos preclínicos, las concentraciones plasmáticas de GLP-2 aumentan después de la resección y los niveles de GLP-2 posprandial se correlacionan con el grado de adaptación intestinal.
Además, la NP complementada con GLP-2 mejora los parámetros de adaptación posterior a la resección, en comparación con la NP sola, incluido el peso del intestino delgado, el área de superficie del intestino delgado, la altura de las vellosidades, la altura de las microvellosidades, la proliferación de células de las criptas, la expresión de transportadores de nutrientes y la absorción de nutrientes.
Incluso en ausencia de resección, el GLP-2 exógeno aumenta el peso y la longitud del intestino delgado, la altura de las vellosidades, la proliferación de células de las criptas y el contenido de proteína yeyunal.
La expresión de GLP-2 también aumenta en los seres humanos después de la resección intestinal, especialmente si el colon está en continuidad.
Además, en dos estudios de fase 3 y un estudio de extensión a largo plazo, los pacientes adultos con SIC que fueron tratados con GLP-2 anal o Teduglutida mostraron aumento en la altura de las vellosidades y disminución en los requerimientos de líquidos NP / IV.
En este momento, solo dos moléculas han sido aprobadas para pacientes con SIC, la hormona de crecimiento somatotropina (solo en EE. UU.) y el análogo del GLP-2, Teduglutida (en Estados Unidos, Europa y algunos países de Latinoamérica, como Colombia).
El GLP-2 y su análogo resistente a la degradación, Teduglutida, aumenta la absorción intestinal de peso húmedo y disminuye la necesidad de soporte de fluidos parenterales en pacientes con SIC y FIC. Con ambos factores de crecimiento, los efectos sobre las funciones intestinales disminuyen rápidamente y desaparecen después de suspender el tratamiento, por lo tanto, se requiere un tratamiento de por vida.
6. ¿Cuáles son las indicaciones y contraindicaciones del uso de análogos de GLP2 en FIC-SIC?
Los expertos colombianos recomiendan que los pacientes con FIC sean cuidadosamente informados de los beneficios y riesgos potenciales asociados con el tratamiento con factores de crecimiento.
La información debe tratar sobre la probabilidad de reducir la necesidad de NPT o el destete, la probabilidad de mejorar la calidad de vida, la duración esperada de tratamiento, los efectos esperados después de la interrupción del tratamiento, los posibles efectos adversos y riesgos del tratamiento.
(Grado de evidencia: bajo).
Entre aquellos pacientes con SIC, cuidadosamente seleccionados, que son candidatos para el tratamiento con enterohormonas que promuevan la adaptación intestinal, Teduglutida (análogo GPL2) será la primera opción, siempre y cuando cumplan los criterios establecidos por el INVIMA, como máxima autoridad regulatoria en la farmacoterapia en Colombia, y esto incluye adultos sin patología oncológica presente y una fase de estabilización con nutrición parenteral total mínimo 3 veces a la semana, para lo cual la unidad de terapia nutricional clínica generará la formulación respectiva, que incluye el formato de comité técnico científico, y sustentará en dicho comité la indicación y la costo-eficiencia del producto.
El panel de expertos también recomienda que los factores de crecimiento intestinal sean solo prescritos por expertos en el diagnóstico y manejo de pacientes con SIC y que tengan la capacidad instalada para evaluar objetivamente las intervenciones y determinar los efectos adversos y los riesgos potenciales.
(Grado de evidencia: moderada).
Las contraindicaciones para el uso del análogo GLP-2 reconocidas son:
- Hipersensibilidad al principio activo o a cualquiera de los excipientes
- Neoplasias malignas gastrointestinales activas (tracto gastrointestinal, hepatobiliares o pancreáticas)
- Pacientes con antecedente de malignidades en el tracto gastrointestinal, incluyendo el sistema hepatobiliar, dentro de los últimos 5 años.
7. ¿Cuáles son las recomendaciones del uso de enterohormonas en situaciones especiales como insuficiencia renal, insuficiencia cardiaca, colestasis hepática, enfermedad inflamatoria intestinal?
Poblaciones especiales como:
- Pacientes de edad avanzada: No se requiere ajuste de dosis en pacientes mayores de 65 años.
- Insuficiencia renal: No se requiere ajuste de dosis en pacientes con insuficiencia renal leve. En pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina inferior a 50 ml/min) y nefropatía terminal, la dosis diaria se debe reducir un 50 %.
- Insuficiencia Hepática: No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve o moderada (clasificación Child-Pugh grado B). No se ha estudiado en pacientes con insuficiencia hepática grave.
8. ¿Cuáles son los criterios de monitoria y seguimiento de las estrategias farmacológicas en SIC-FIC?
Deben monitorizarse regularmente los signos y síntomas de deshidratación, balance de líquidos, pruebas de laboratorio y producción de orina de 24 horas, así como ajustar de manera oportuna la suplementación de líquidos para prevenir la insuficiencia renal crónica en pacientes en NPD. (Grado de evidencia: muy bajo).
9. Barreras para la implementación de un manejo multi e interdisciplinario y de estrategias farmacológicas innovadoras en Colombia
El consenso de expertos reconoció la dificultad que tienen los pacientes con SIC, a pesar de las políticas institucionales que incluyeron el SIC dentro de las enfermedades huérfanas en Colombia, con la protección que esto implica dentro del sistema de salud; siguen existiendo barreras administrativas para acceder a nuevas tecnologías farmacológicas que puedan mejorar de su calidad de vida o fármacos con las debidas aprobaciones por el INVIMA.
Se considera que debería existir mayor interrelación dentro del sistema de salud, que permita a los pacientes acceder a los grupos especializados en el manejo de la falla intestinal crónica en Colombia. Generalidades del manejo quirúrgico
10. ¿Cuáles son las indicaciones de trasplante intestinal en FIC-SIC?
El pilar de la indicación de trasplante intestinal está fundamentado en:
- Eminencia de falla de la nutrición parenteral domiciliaria, como puede ser por bilirrubina total superior a 3 – 6 mg/dl (54 – 108 mmol/L), trombocitopenia progresiva y esplenomegalia progresiva • Insuficiencia hepática manifiesta por hipertensión portal, hepatoesplenomegalia, fibrosis hepática o cirrosis
- Trombosis relacionada con catéter venoso central de dos o más venas centrales (yugular interna, subclavia o femoral).
- Sepsis frecuente de vía central: dos o más episodios por año de sepsis sistémica secundaria a infecciones de línea que requieren hospitalización; un solo episodio de fungemia relacionada con la línea.
- Shock séptico o síndrome de dificultad respiratoria aguda.
- Episodios frecuentes de deshidratación severa a pesar de líquidos intravenosos además de NPD.
Cumplimiento de normas éticas – Falla Intestinal Crónica en Síndrome de Intestino Corto
Consentimiento informado: Este estudio es una revisión de la literatura, y como tal no hay necesidad de un consentimiento informado ni de aprobación del Comité de Ética Institucional.
Declaración de conflictos de intereses: El doctor Katime es conferencista de Laboratorio Takeda. Los demás autores declararon que no tienen conflictos de intereses.
Fuentes de financiación: Recursos propios de los autores, con el apoyo de la Asociación Colombiana de Cirugía.
Contribución de los autores:
Todos los autores participaron en la concepción y diseño del estudio, adquisición de datos, análisis e interpretación de datos, redacción del manuscrito, revisión crítica y aprobación final.
Lecturas recomendadas – Falla Intestinal Crónica en Síndrome de Intestino Corto
- Abushufa R, Reed P, Weinkove C, Wales S, Shaffer J. Essential fatty acid status in patients on long-term home parenteral nutrition. JPEN J Parenter Enteral Nutr. 1995;19:286- 90. https://doi.org/10.1177/0148607195019004286
- American Diabetes Association. Standards of medical care in diabetes – 2012. Diabetes Care. 2012;35(Suppl 1):11- 63. https://doi.org/10.2337/dc12-s011
- American Gastroenterological Association. American Gastroenterological Association medical position statement: short bowel syndrome and intestinal transplantation. Gastroenterology 2003;124:1105e10. https://doi.org/10.1053/gast.2003.50139
- Baker ML, Williams RN, Nightingale JMD. Causes and management of a high-output stoma. Colorectal Dis. 2010;13:191-7. https://doi.org/10.1111/j.1463-1318.2009.02107.x
- Berg JK, Kim EH, Li B, Joelsson B, Youssef NN. A randomized, double-blind, placebo-controlled, multiple-dose, parallel- group clinical trial to assess the effects of teduglutide on gastric emptying of liquids in healthy subjects. BMC Gastroenterol. 2014;14:25. https://doi.org/10.1186/1471-230X-14-25
- Bethune K, Allwood M, Grainger C, Wormleighton C; British Pharmaceutical Nutrition Group Working Party. Use of filters during the preparation and administration of parenteral nutrition: position paper and guidelines prepared by a British pharmaceutical nutrition group working party. Nutrition. 2001;17:403-8. https://doi.org/10.1016/S0899-9007(01)00536-6
- Boullata JI, Gilbert K, Sacks G, Labossiere RJ, Crill C, Goday P, et al. A.S.P.E.N. clinical guidelines: Parenteral nutrition ordering, order review, compounding, labeling, and dispensing. JPEN J Parenter Enteral Nutr. 2014;38:334-77. https://doi.org/10.1177/0148607114521833
- Chandankhede SR, Kulkarni AP. Acute intestinal failure. Indian J Crit Care Med. 2020;24(Suppl 4):S168-S174. https://doi.org/10.5005/jp-journals-10071-23618
Otras Lecturas recomendadas – Falla Intestinal Crónica en Síndrome de Intestino Corto
- Chen K, Mu F, Xie J, Kelkar SS, Olivier C, Signorovitch J, et al. Impact of Teduglutide on quality of life among patients with short bowel syndrome and intestinal failure. JPEN J Parenter Enteral Nutr. 2020;44:119-28. https://doi.org/10.1002/jpen.1588
- Chen KS, Xie J, Tang W, Zhao J, Jeppesen PB, Signorovitch JE. Identifying a subpopulation with higher likelihoods of early response to treatment in a heterogeneous rare disease: a post hoc study of response to teduglutide for short bowel syndrome. Ther Clin Risk Manag. 2018;14:1267-77. https://doi.org/10.2147/TCRM.S166081
- Creutzfeldt W, Lembcke B, Folsch UR, Schleser S, Koop I. Effect of somatostatin analogue (SMS 201-995, Sandostatin) on pancreatic secretion in humans. Am J Med. 1987;82(Suppl 2):49-54. https://doi.org/10.1016/0002-9343(87)90426-8
- Dharmsathaphorn K, Gorelick FS, Sherwin RS, Cataland S, Dobbins JW. Somatostatin decreases diarrhea in patients with the short-bowel syndrome. J Clin Gastroenterol. 1982;4:521-4. https://doi.org/10.1097/00004836-198212000-00008
- DuPont AW, Sellin JH. Ileostomy diarrhea. Curr Treat Options Gastroenterol. 2006;9:39-48. https://doi.org/10.1007/s11938-006-0022-7
- Fleming CR, Remington M. Intestinal failure. In: Hill GL, editor. Nutrition and the surgical patient. Edinburgh: Churchill Livingstone; 1981. p. 219e35.
- Fujioka K, Jeejeebhoy K, Pape UF, Li B, Youssef NN, Schneider SM. Patients with short bowel on narcotics during 2 randomized trials have abdominal complaints independent of Teduglutide. JPEN J Parenter Enteral Nutr. 2017;41:1419-22. https://doi.org/10.1177/0148607116663481
- Hoffer LJ, Bistrian BR. Appropriate protein provision in critical illness: a systematic and narrative review. Am J Clin Nutr. 2012;96:591-600. https://doi.org/10.3945/ajcn.111.032078
Bibliografías – Falla Intestinal Crónica en Síndrome de Intestino Corto
- Iyer KR, Kunecki M, Boullata JI, Fujioka K, Joly F, Gabe S, et al. Independence from parenteral nutrition and intravenous fluid support during treatment with Teduglutide among patients with intestinal failure associated with short bowel syndrome. JPEN J Parenter Enteral Nutr. 2017;41:946-51. https://doi.org/10.1177/0148607116680791
- Jeppesen PB, Christensen MS, Høy CE, Mortensen PB. Essential fatty acid deficiency in patients with severe fat malabsorption. Am J Clin Nutr. 1997;65:837-43. https://doi.org/10.1093/ajcn/65.3.837
- Jeppesen PB, Gilroy R, Pertkiewicz M, Allard JP, Messing B, O’Keefe SJ. Randomised placebo-controlled trial of teduglutide in reducing parenteral nutrition and/or intravenous fluid requirements in patients with short bowel syndrome. Gut. 2011;60:902-14. https://doi.org/10.1136/gut.2010.218271
- Jeppesen PB, Hartmann B, Thulesen J, Graff J, Lohmann J, Hansen BS, et al. Glucagon-like peptide 2 improves nutrient absorption and nutritional status in shortbowel patients with no colon. Gastroenterology. 2001;120:806-15. https://doi.org/10.1053/gast.2001.22555
- Jeppesen PB, Mortensen PB. The influence of a preserved colon on the absorption of medium chain fat in patients with small bowel resection. Gut. 1998;43:478-83. https://doi.org/10.1136/gut.43.4.478
- Jeppesen PB, Pertkiewicz M, Forbes A, Pironi L, Gabe SM, Joly F, et al. Quality of life in patients with short bowel syndrome treated with the new glucagon-like peptide-2 analogue teduglutide – Analyses from a randomised, placebo-controlled study. Clin Nutr. 2013;32:713-21. https://doi.org/10.1016/j.clnu.2013.03.016
Otras Bibliografías – Falla Intestinal Crónica en Síndrome de Intestino Corto
- Jeppesen PB, Pertkiewicz M, Messing B, Iyer K, Seidner DL, O’Keefe SJ, et al. Teduglutide reduces need for parenteral support among patients with short bowel syndrome with intestinal failure. Gastroenterology. 2012;143:1473-81. https://doi.org/10.1053/j.gastro.2012.09.007
- Jeppesen PB, Sanguinetti EL, Buchman A, Howard L, Scolapio JS, Ziegler TR, et al. Teduglutide (ALX-0600), a dipeptidyl peptidase IV resistant glucagon-like peptide 2 analogue, improves intestinal function in short bowel syndrome patients. Gut. 2005;54:1224-31. https://doi.org/10.1136/gut.2004.061440
- Kelly DG. Guidelines and available products for parenteral vitamins and trace elements. JPEN J Parenter Enteral Nutr. 2002;26(5 Suppl):S34-6. https://doi.org/10.1177/014860710202600510
- Kocoshis SA, Merritt RJ, Hill S, Protheroe S, Carter BA, Horslen S, et al. Safety and efficacy of Teduglutide in pediatric patients with intestinal failure due to short bowel syndrome: A 24-week, phase III study. JPEN J Parenter Enteral Nutr. 2020;44:621-31. https://doi.org/10.1002/jpen.1690
- Koletzko B, Jauch KW, Verwied-Jorky S, Krohn K, Mittal R. Guidelines on parenteral nutrition from the German society for nutritional medicine (DGEM) -overview. Ger Med Sci. 2009;7:27. https://doi.org/10.3205/000086
- Lai HS, Chen WJ, Chen KM, Lee YN. Effects of monomeric and polymeric diets on small intestine following massive resection. Taiwan Yi Xue Hui Za Zhi. 1989;88:982-8.
- Levy E, Frileux P, Sandrucci S, Ollivier JM, Masini JP, Cosnes J, et al. Continuous enteral nutrition during the early adaptive stage of the short bowel syndrome. Br J Surg. 1988;75:549-53. https://doi.org/10.1002/bjs.1800750615
Referencias – Falla Intestinal Crónica en Síndrome de Intestino Corto
- Madsen KB, Askov-Hansen C, Naimi RM, Brandt CF, Hartmann B, Holst JJ, et al. Acute effects of continuous infusions of glucagon-like peptide (GLP)-1, GLP-2 and the combination (GLP-1 + GLP-2) on intestinal absorption in short bowel syndrome (SBS) patients. A placebo-controlled study. Regul Pept. 2013;184:30-9. https://doi.org/10.1016/j.regpep.2013.03.025
- Matarese LE, O’Keefe SJ, Kandil HM, Bond G, Costa G, Abu-Elmagd K. Short bowel syndrome: clinical guidelines for nutrition management. Nutr Clin Pract. 2005;20:493- 502. https://doi.org/10.1177/0115426505020005493
- McIntyre PB, Fitchew M, Lennard-Jones JE. Patients with a high jejunostomy do not need a special diet. Gastroenterology. 1986;91:25-33. https://doi.org/10.1016/0016-5085(86)90434-8
- Messing B, Landais P, Goldfarb B, Irving M. Home parenteral nutrition in adults: a multicentre survey in Europe. Clin Nutr. 1989;8:3-9. https://doi.org/10.1016/0261-5614(89)90018-6
- Messing B, Lémann M, Landais P, Gouttebel MC, Gérard-Boncompain M, Saudin F, et al. Prognosis of patients with nonmalignant chronic intestinal failure receiving longterm home parenteral nutrition. Gastroenterology. 1995;108:1005-10. https://doi.org/10.1016/0016-5085(95)90196-5
- Mikalunas V, Fitzgerald K, Rubin H, McCarthy R, Craig RM. Abnormal vitamin levels in patients receiving home total parenteral nutrition. J Clin Gastroenterol. 2001;33:393-6. https://doi.org/10.1097/00004836-200111000-00010
Otras Referencias – Falla Intestinal Crónica en Síndrome de Intestino Corto
- National Collaborating Centre for Acute Care (UK). Nutrition support in adults: oral nutrition support, enteral tube feeding and parenteral nutrition. London: National Collaborating Centre for Acute Care (UK); 2006 Feb. PMID: 21309138. Fecha de consulta: 7 de enero de 2014. Disponible en: www.rcseng.ac.uk National Institute for Health and Care Excellence. Diabetes in adults – Quality standard. 2011. Disponible en: https://www.nice.org.uk/guidance/qs6 Nightingale JMD, Lennard-Jones JE, Walker ER, Farthing MJG. Jejunal efflux in short bowel syndrome. Lancet. 1990;336:765-8. https://doi.org/10.1016/0140-6736(90)93238-K
- Nightingale JMD, Walker ER, Farthing MJG, Lennard-Jones JE. Effect of omeprazole on intestinal output in the short bowel syndrome. Aliment Pharmacol Ther. 1991;5:405-12. https://doi.org/10.1111/j.1365-2036.1991.tb00044.x
- Nightingale J, Woodward JM, Small Bowel and Nutrition Committee of the British Society of Gastroenterology. Guidelines for management of patients with a short bowel. Gut. 2006;55(Suppl. 4):iv1e12. https://doi.org/10.1136/gut.2006.091108
- O’Keefe SJD, Haymond MW, Bennet WM, Oswald B, Nelson DK, Shorter RG. Long-acting somatostatin analogue therapy and protein metabolism in patients with jejunostomies. Gastroenterology. 1994;107:379-88. https://doi.org/10.1016/0016-5085(94)90162-7
- O’Keefe SJD, Jeppesen PB, Gilroy R, Pertkiewicz M, Allard JP, Messing B. Safety and efficacy of teduglutide after 52 weeks of treatment in patients with short bowel intestinal failure. Clin Gastroenterol Hepatol. 2013;11:815- 23.e1-3. https://doi.org/10.1016/j.cgh.2012.12.029
- Ovesen L, Chu R, Howard L. The influence of dietary fat on jejunostomy output in patients with severe short bowel syndrome. Am J Clin Nutr. 1983;38:270-7. https://doi.org/10.1093/ajcn/38.2.270
Fuentes Bibliográficas – Falla Intestinal Crónica en Síndrome de Intestino Corto
- Pape UF, Iyer KR, Jeppesen PB, Kunecki M, Pironi L, Schneider SM, et al. Teduglutide for the treatment of adults with intestinal failure associated with short bowel syndrome: pooled safety data from four clinical trials. Therap Adv Gastroenterol. 2020;13:1756284820905766. https://doi.org/10.1177/1756284820905766
- Pironi L, Arends J, Baxter J, Bozzetti F, Pelaez RB, Cuerda C, et al. ESPEN endorsed recommendations. Definition and classification of intestinal failure in adults. Clin Nutr. 2015;34:171-80. https://doi.org/10.1016/j.clnu.2014.08.017
- Pironi L, Goulet O, Buchman A, Messing B, Gabe S, Candusso M, et al. Outcome on home parenteral nutrition for benign intestinal failure: A review of the literature and benchmarking with the European prospective survey of ESPEN. Clin Nutr. 2012;31:831-45. https://doi.org/10.1016/j.clnu.2012.05.004
- Pironi L, Hebuterne X, van Gossum A, Messing B, Lyszkowska M, Colomb V, et al. Candidates for intestinal transplantation: A multicenter survey in Europe. Am J Gastroenterol. 2006;101:1633-43.
- Pironi L, Paganelli F, Labate AMM, Merli C, Guidetti C, Spinucci G, et al. Safety and efficacy of home parenteral nutrition for chronic intestinal failure: a 16-year experience at a single centre. Dig Liver Dis. 2003;35:314-24. https://doi.org/10.1016/S1590-8658(03)00074-4
- Preiser JC, Schneider SM. ESPEN disease-specific guideline framework. Clin Nutr. 2011;30:549-52. https://doi.org/10.1016/j.clnu.2011.07.006
- Qvitzau S, Matzen P, Madsen P. Treatment of chronic diarrhoea: loperamide versus ispaghula husk and calcium. Scand J Gastroenterol. 1988;23:1237-40. https://doi.org/10.3109/00365528809090197
- Reichlin S. Somatostatin. N Engl J Med. 1983;309:1556-63. https://doi.org/10.1056/NEJM198312223092506
Otras Fuentes Bibliográficas – Falla Intestinal Crónica en Síndrome de Intestino Corto
- Rolston DD, Zinzuvadia SN, Mathan VI. Evaluation of the efficacy of oral rehydration solutions using human whole gut perfusion. Gut. 1990;31:1115-9. https://doi.org/10.1136/gut.31.10.1115
- Schwartz LK, O’Keefe SJD, Fujioka K, Gabe SM, Lamprecht G, Pape UF, et al. Long-term Teduglutide for the treatment of patients with intestinal failure associated with short bowel syndrome. Clin Transl Gastroenterol. 2016;7:e142. https://doi.org/10.1038/ctg.2015.69
- Seidner DL, Joly F, Youssef NN. Effect of Teduglutide, a Glucagon- like Peptide 2 analog, on citrulline levels in patients with short bowel syndrome in two phase III randomized trials. Clin Transl Gastroenterol. 2015;6:e93. https://doi.org/10.1038/ctg.2015.15
- Shaffer J. Intestinal failure: Definition and service development. Clin Nutr. 2002;21(Suppl. 1):144-5. https://doi.org/10.1016/S0261-5614(02)80034-6
- Staun M, Pironi L, Bozzetti F, Baxter J, Forbes A, Joly F, et al. ESPEN Guidelines on Parenteral Nutrition: home parenteral nutrition (HPN) in adult patients. Clin Nutr. 2009;28:467-79. https://doi.org/10.1016/j.clnu.2009.04.001
- Tappenden KA. Pathophysiology of short bowel syndrome: Considerations of resected and residual anatomy. JPEN J Parenter Enteral Nutr. 2014;38(Suppl 1):14S-22S. https://doi.org/10.1177/0148607113520005
Referencias Bibliográficas – Falla Intestinal Crónica en Síndrome de Intestino Corto
- Tappenden KA, Edelman J, Joelsson B. Teduglutide enhances structural adaptation of the small intestinal mucosa in patients with short bowel syndrome. J Clin Gastroenterol. 2013;47:602-7. https://doi.org/10.1097/MCG.0b013e3182828f57
- Umpierrez GE, Hellman R, Korytkowski MT, Kosiborod M, Maynard GA, Montori VM, et al. Management of hyperglycemia in hospitalized patients in non-critical care setting: An endocrine society clinical practice guideline. J Clin Endocrinol Metabolism. 2012;97:16-38. https://doi.org/10.1210/jc.2011-2098
- Yarandi SS, Zhao VM, Hebbar G, Ziegler TR. Amino acid composition in parenteral nutrition: what is the evidence? Curr Opin Clin Nutr Metabolic Care. 2011;14:75-82. https://doi.org/10.1097/MCO.0b013e328341235a
- Zheng H, Li Y, Zhang W, Zeng F, Zhou SY, Zheng HB, et al. Electroacupuncture for patients with diarrhea-predominant irritable bowel syndrome or functional diarrhea: A randomized controlled trial. Medicine (Baltimore). 2016;95:e3884. https://doi.org/10.1097/MD.0000000000003884. Erratum in: Medicine (Baltimore). 2016;95:e5074.
Autores – Falla Intestinal Crónica en Síndrome de Intestino Corto
1 Iván Katime, MD, especialista en Cirugía general y Docencia universitaria; coordinador, Unidad Soporte Nutricional, Hospital Militar Central,
Bogotá, D.C., Colombia. Presidente Capitulo Nutrición y Metabolismo Quirúrgico, Asociación Colombiana de Cirugia.
2 William Sánchez-Maldonado, MD, FACS, FASA (Hon), especialista en Cirugía general; jefe, Departamento de Cirugía, Hospital Militar Central, Bogotá, D.C.,
Colombia.
3 Jessica Pineda, ND, Hospital Militar Central, Bogotá, D.C., Colombia.
4 Henry Oliveros, MD, magister en Epidemiología, Universidad de La Sabana, Chía, Colombia.
5 Arturo Vergara, MD, FACS, especialista en Cirugía general; jefe, Departamento de Cirugía y Grupo de Soporte Metabólico y Nutricional, Hospital Universitario Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia. Presidente Capítulo de Infección quirúrgica y falla intestinal, Asociación Colombiana de Cirugía.
6 Néstor Pedraza, MD, especialista en Cirugía general, fellow de Cirugía hepatobiliopancreática y trasplante multivisceral, Colombiana de Trasplantes,
Bogotá, D.C., Colombia.
7 Andrés Becerra, MD, especialista en Cirugía general y Cirugía de trasplante de órganos abdominales, Hospital San Vicente Fundación, Rionegro,
Colombia.
8 Sonia Carrero, MD, especialista en Cirugía general y Cirugía de trasplante, Clínica Imbanaco, Cali, Colombia.
9 Mauricio Francisco Duque, MD, especialista en Cirugía general y Cirugía de trasplante, IPS Universitaria, Medellín, Colombia.
10 Manuel Cadena, MD, FACS, especialista en Cirugía general; jefe, Sección de cirugía general, Hospital Universitario Fundación Santa Fe de Bogotá,
Bogotá, D.C., Colombia.
Fecha de recibido: 26/06/2023 – Fecha de aceptación: 10/07/2023 – Publicación en línea: 04/09/2023
Autor de correspondencia: William Sánchez-Maldonado, Calle 100 # 14-63 Oficina 502, Bogotá, D.C., Colombia.
Teléfono: 310 5546201 – 310 5546188. Dirección electrónica: wsanchez@homil.gov.co
Citar como: Katime I, Sánchez-Maldonado W, Pineda J, Oliveros H, Vergara A, Pedraza N, et al. Consenso colombiano de Falla Intestinal Crónica en Síndrome de Intestino Corto. Rev Colomb Cir. 2023;38:704-23. https://doi.org/10.30944/20117582.2425
Este es un artículo de acceso abierto bajo una Licencia Creative Commons – BY-NC-ND https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es