Los mecanismos fisiopatológicos por los cuales se produce la nesidioblastosis después de la derivación gástrica no han sido totalmente esclarecidos 14-17. Se cree que existe un vínculo entre la nesidioblastosis y las incretinas, principalmente el GLP-1 (Glucagon Like Peptide-1) 2,12,18. Después de la cirugía bariátrica el vaciamiento gástrico se ve acelerado, poniendo en contacto directo al intestino con el alimento, lo cual aumenta la secreción del GLP-1 y, como consecuencia, se produce una estimulación prolongada de las células beta del páncreas con la consiguiente hipertrofia e hiperplasia de sus células 2. Se ha encontrado, específicamente, que el GLP-1 incrementa la secreción y la sensibilidad a la insulina, y en modelos en múridos, se ha visto que aumenta la proliferación y neogénesis de las células beta, mientras disminuye su apoptosis 19. Otra posible teoría es que en personas obesas con resistencia a la insulina, las células beta se hipertrofian como mecanismo adaptativo 3. Esta hipertrofia celular puede causar hipoglucemia después de la pérdida de peso consecuente a la cirugía bariátrica, cuando ha mejorado la sensibilidad a la insulina 8.
Algunos pacientes sometidos a derivación gástrica presentan síntomas posprandiales como consecuencia de un vaciado gástrico rápido; este fenómeno ha sido denominado síndrome de evacuación gástrica rápida (dumping syndrome) 20; se caracteriza por síntomas vasomotores, como diaforesis, debilidad, mareo y enrojecimiento facial, pero no se acompaña de neuroglucopenia, lo que permite diferenciarlo de una verdadera hipoglucemia y, por tanto, de una nesidioblastosis.
Las manifestaciones clínicas con las que se presentó el paciente son típicas de hipoglucemia, con síntomas tanto autonómicos como neuroglucopénicos 21. La hipoglucemia se confirmó con los exámenes de laboratorio y, el hiperinsulinismo, mediante los niveles elevados de insulina plasmática y péptido C (tabla 1) 22,23.
En pacientes con hipoglucemia siempre se debe sospechar el uso de sulfonilureas, dado que la única diferencia entre el patrón bioquímico de un hiperinsulinismo endógeno y el que se produce con estos medicamentos, es la detección de sulfonilureas. Sin embargo, las características clínicas del paciente no hacían sospechar el uso de glibenclamida u otros tratamientos similares, y se pudo corroborar, con la arteriografía abdominal con estimulación intraarterial selectiva pancreática con calcio, una fuente endógena de hiperinsulinismo. Además, la resolución de la hipoglucemia después de la pancreatectomía subtotal también confirmó un hiperinsulinismo endógeno 24.
En otras situaciones, como en la hipoglucemia autoinmunitaria o con el uso exógeno de insulina, los anticuerpos antiinsulina pueden ser útiles para identificar la causa de la hipoglucemia 25,26. No obstante, esto no encajaba en el contexto del paciente y el reporte final de histopatología confirmó el diagnóstico de nesidioblastosis del adulto. Los dos estudios paraclínicos anteriormente mencionados (detección de sulfunilureas y anticuerpos antiinsulina) no fueron aprobados por la empresa aseguradora del paciente por ser exámenes no cubiertos por el sistema de seguridad social en Colombia, situación que limita el adecuado estudio de la hipoglucemia en nuestro medio y, aunque no fueron necesarios para hacer el diagnóstico del paciente, se hace hincapié en la importancia de estos estudios en la evaluación de todo paciente con sospecha de hipoglucemia.
Con la sospecha de insulinoma, se indicó una resonancia magnética (RM) con contraste de abdomen, de 1,5 teslas (T). Infortunadamente, la RM en el estudio de insulinoma tiene una tasa de localización correcta promedio de 47,4 %, con una sensibilidad promedio de 53,3 % 27. En este estudio, el páncreas se reportó como completamente normal (figura 1) 28.
Para poder localizar el sitio donde se generaba el hiperinsulinismo, se decidió hacer un cateterismo con estimulación arterial selectiva con calcio 29,30. Con este estudio, se logró comprobar el hiperinsulinismo endógeno, donde las arterias esplénica distal y pancreática dorsal presentaron los mayores niveles de insulinemia, además de presentar una relación entre la insulinemia basal y la posterior al estímulo mayor de 2 (tabla 2); esto permitió la localización anatómica de la hipersecreción de insulina en el cuerpo y la cola, ya que estas arterias son las encargadas principales de la irrigación de estos segmentos del páncreas 31,32.
Tabla 2. Valores de insulinemia en el cateterismo
de arterias pancreáticas con estimulación arterial con calcio
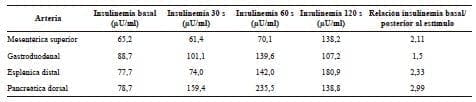 Valores de referencia: 3 a 29,1 μU/ml
Valores de referencia: 3 a 29,1 μU/ml
La relación entre insulinemia basal e insulinemia después del estímulo es significativa si su valor es mayor de 2.
Después del diagnóstico de hiperinsulinismo, se procedió a la pancreatectomía subtotal laparoscópica como tratamiento 2,33,34. Aunque en este paciente se decidió un tratamiento quirúrgico definitivo, se ha reportado el manejo con medicamentos como octreótido, análogo sintético de la somatostatina (el cual se indicó, pero no fue autorizado) 35-37, diazóxido, tiacida que no actúa como diurético sino que impide la secreción de insulina por parte del páncreas sin interrumpir su síntesis 35, y nifedipina, antagonista del calcio de la familia 1,4-dihidropiridinas, que podrían controlar los síntomas 38-4.
En la mayoría de los reportes previos, a pesar de que los pacientes recibieron un tratamiento médico óptimo, finalmente, fue necesaria la cirugía para controlar totalmente los síntomas 15,4. Según la información disponible, la extensión de la resección del páncreas usualmente se establece según la arteriografía de estimulación con calcio, ya que los estudios radiológicos no logran demostrar insulinomas, como se mencionó anteriormente 3.
En el presente caso se practicó una pancreatectomía del 80 %, aproximadamente, incluyendo el área de mayor reacción al estímulo con calcio, lo cual determinó la división del páncreas justo sobre la vena mesentérica superior. Por otro lado, a pesar de que el tratamiento quirúrgico es el más efectivo, debe tenerse en cuenta que la enfermedad puede recurrir en el parénquima pancreático restante y, en algunos casos, se ha presentado la necesidad de completar una pancreatectomía total 25,42. Se recomienda un seguimiento estricto después de cirugía para detectar una eventual recurrencia 43.En el estudio histopatológico de la nesidioblastosis, se deben tener en cuenta varios criterios para el diagnóstico, como aumento del número y variabilidad en el tamaño de los islotes de Langerhans, aumento e hipercromasia de las células, y disposición de los islotes en zonas vecinas a los conductos pancreáticos. Además, la inmunohistoquímica debe ser positiva para CD56 y cromogranina, marcadores neuroendocrinos que confirman, junto a los criterios anteriores, el diagnóstico final de nesidioblastosis del adulto 44-46. En la tabla 3 se resumen los casos de nesidioblastosis del adulto después de cirugía bariátrica que han sido reportados en la literatura científica, con su presentación clínica, diagnóstico y tratamiento.
Tabla 3. Casos reportados en la literatura científica
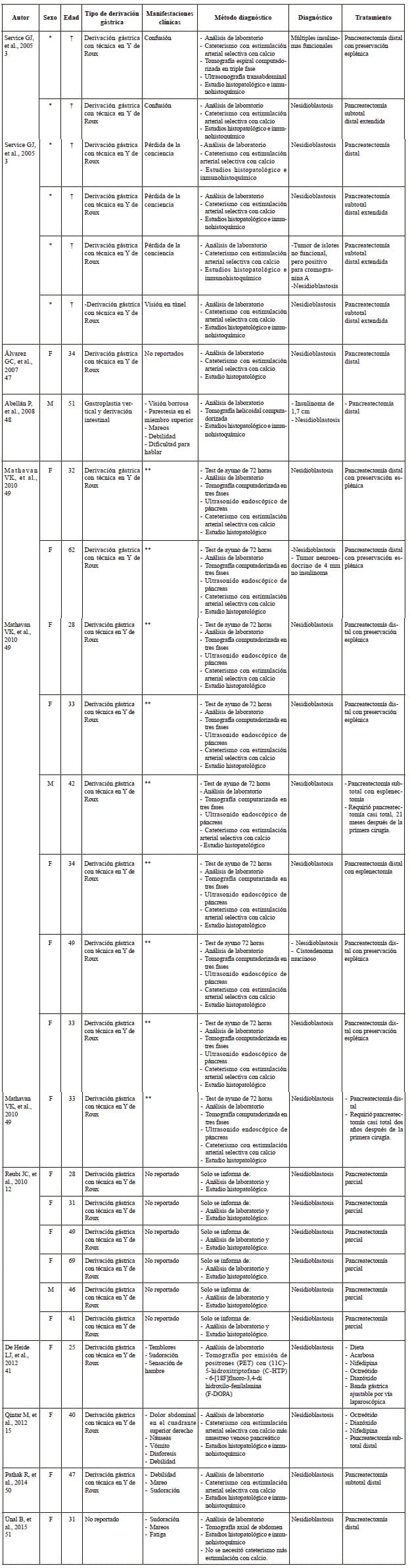
* Se describe que eran cinco individuos de sexo femenino y uno masculino, pero no se especifica cuál era el sexo de cada paciente. † El rango de edad va de 39 a 54 años, con una media de 47 años. ** Los síntomas no son descritos en cada paciente; se menciona que entre los síntomas, de manera común, se presentaron: confusión, desorientación, pérdida del conocimiento, síncope, temblor, debilidad, visión borrosa y ansiedad.
Conclusión
La nesidioblastosis es una complicación rara de la cirugía bariátrica pero que se debe sospechar en pacientes con síntomas recurrentes y graves de hipoglucemia. Su frecuencia viene en aumento como diagnóstico diferencial del síndrome de evacuación gástrica rápida.
En nuestro conocimiento, este es el primer caso reportado de nesidioblastosis en Colombia como complicación de derivación gástrica. Su diagnóstico requiere la detección endógena de hiperinsulinismo y estudios negativos de localización para insulinoma. En cuanto a su tratamiento, se ha intentado el uso de algunos medicamentos, pero la cura definitiva para esta enfermedad es la pancreatectomía del área del páncreas que se encuentre hiperfuncional.
Conflicto de intereses: ninguno reportado por los autores.
Instituciones donde se realizó la investigación: Hospital Universitario San Vicente Fundación; Facultad de Medicina, Universidad de Antioquia
Contribución de los autores: Todos los autores participaron en la búsqueda bibliográfica, la escritura y la corrección del manuscrito.
Nesidioblastosis in the adult following gastric bypass
Abstract
Hypoglycemia due to endogenous hyperinsulinism has been described as a complication of bariatric surgery. We present the case of a 34-year-old man who developed a Whipple’s triad eight years after undergoing gastric bypass.
Hypoglycemia was associated with high serum levels of insulin and C peptide; anatomic localization of endogenous hyperinsulinism was finally demonstrated with a selective intra-arterial calcium-stimulation test. Patient was offered a laparoscopic subtotal pancreatectomy, which resulted in an excellent postoperative course and significant symptoms resolution. Pathology report and inmunohistochemical analysis confirmed the diagnosis of adult nesidioblastosis.
We believe it is important to recognize this condition as a complication of bariatric surgery, a procedure performed more frequently nowadays due to the obesity epidemic. Symptoms might be confused with those of dumping syndrome which does not have severe consequences in the patient´s health as nesidioblastosis does.
Key words: Nesidioblastosis; gastric bypass; postoperative complications; dumping syndrome; hypoglycemia; hyperinsulinism.
Referencias
1. Jameson JL, De Groot LJ. Endocrinology: Adult and pediatric. Seventh edition. Philadelphia, PA: Elsevier Health Sciences; 2010. p. 816-38.
2. Ritz P, Vaurs C, Barigou M, Hanaire H. Hypoglycaemia after gastric bypass: mechanisms and treatment. Diabetes Obes Me¬tab. 2016;18:217-23.
3. Service GJ, Thompson GB, Service FJ, Andrews JC, Collazo- Clavell ML, Lloyd RV. Hyperinsulinemic hypoglycemia with nesidioblastosis after gastric-bypass surgery. N Engl J Med. 2005;353:249-54.
4. Mala T. Postprandial hyperinsulinemic hypoglycemia af¬ter gastric bypass surgical treatment. Surg Obes Relat Dis. 2014;10:1220-5.
5. Longo DL, Kasper DL, Hauser SL, Jameson JL, Loscalzo J. Harrison’s Principles of Internal Medicine. 18th edition . México: Mc Graw Hill; 2012. p. 3003-9.
6. Boshier PR, Huddy JR, Zaninotto G, Hanna GB. Dumping syndrome after esophagectomy: A systematic review of the literature. Dis Esophagus. 2017;30:1-9.
7. Yupanqui H, Muñoz JM, Guerra L. Obesidad y cirugía bariá¬trica: Complicaciones clinicometabólicas. Acta Med Colomb. 2008;33:15-21.
8. Cummings DE. Gastric bypass and nesidioblastosis–too much of a good thing for islets? N Engl J Med. 2005; 353:300-2.
9. Birkmeyer JD, Finks JF, O’Reilly A, Oerline M, Carlin AM, Nunn AR, et al. Surgical skill and complication rates after ba¬riatric surgery. N Engl J Med. 2013;369:1434-42.
10. DeMaria EJ. Bariatric surgery for morbid obesity. N Engl J Med. 2007;356:2176-83.
11. Shoar S, Nguyen T, Ona MA, Reddy M, Anand S, Alkuwari MJ, et al. Roux-en-Y gastric bypass reversal: A systematic review. Surg Obes Relat Dis. 2016;12:1366-72.
12. Reubi JC, Perren A, Rehmann R, Waser B, Christ E, Callery M, et al. Glucagon-like peptide-1 (GLP-1) receptors are not overexpressed in pancreatic islets from patients with severe hyperinsulinaemic hypoglycaemia following gastric bypass. Diabetologia. 2010;53:2641-5.
13. Zagury L, Moreira RO, Guedes EP, Coutinho WF, Appolinario JC. Insulinoma misdiagnosed as dumping syndrome after ba¬riatric surgery. Obes Surg. 2004;14:120-3.
14. Rariy CM, Rometo D, Korytkowski M. Post-gastric bypass hypoglycemia. Curr Diab Rep. 2016;16:19.
15. Qintar M, Sibai F, Taha M. Hypoglycemia due to an adult-onset nesidioblastosis, a diagnostic and management dilemma. Avi¬cenna J Med. 2012;2:45-7.
16. Dravecka I, Lazurova I. Nesidioblastosis in adults. Neoplasma. 2014;61:252-6.
17. Ritz P, Hanaire H. Post-bypass hypoglycaemia: A review of current findings. Diabetes Metab. 2011;37:274-81.
18. Cantini G, Mannucci E, Luconi M. Perspectives in GLP-1 re¬search: New targets, new receptors. Trends Endocrinol Metab. 2016;27:427-38.
19. Vidal J, de Hollanda A, Jiménez A. GLP-1 is not the key mediator of the health benefits of metabolic surgery. Surg Obes Relat Dis. 2016;12:1225-9.
20. van Beek AP, Emous M, Laville M, Tack J. Dumping syndrome after esophageal, gastric or bariatric surgery: Pathophysiology, diagnosis, and management. Obes Rev. 2017;18:68-85. doi: 10.1111/obr.12467.
21. Cryer PE, Axelrod L, Grossman AB, Heller SR, Montori VM, Seaquist ER, et al. Evaluation and management of adult hy¬poglycemic disorders: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2009;94:709-28.
22. Sircar M, Bhatia A, Munshi M. Review of hypoglycemia in the older adult: Clinical implications and management. Canadian J Diabetes. 2016;40:66-72.
23. Restrepo K, Garavito G, Rojas L, Romero A, Neira F, Oliveros R, et al. Nesidioblastosis del adulto coexistente con insulinoma. Rev Colomb Cancerol. 2009;13:49-60.
24. Rustenbeck I. Risk and benefit of sulfonylureas–their role in view of new treatment options for type 2 diabetes. Med Mo¬natsschr Pharm. 2016;39:65-72; quiz 3-4.
25. Li R, Mao J, Yu K, Wang L, Hu M, Xu L. Medical nutrition therapy is effective in the management of hypoglycemia caused by insulin antibodies: A case report and literature review. J Am Coll Nutr. 2016;35:86-90.
26. Palladino AA, Bennett MJ, Stanley CA. Hyperinsulinism in infancy and childhood: when an insulin level is not always enough. Ann Biol Clin (Paris). 2009;67:245-54.
27. Mehrabi A, Fischer L, Hafezi M, Dirlewanger A, Grenacher L, Diener MK, et al. A systematic review of localization, sur¬gical treatment options, and outcome of insulinoma. Pancreas. 2014;43:675-86.
28. Okabayashi T, Shima Y, Sumiyoshi T, Kozuki A, Ito S, Ogawa Y, et al. Diagnosis and management of insulinoma. World J Gastroenterol. 2013;19:829-37.
29. Chatziioannou A, Mourikis D, Konstandinidis P, Kehagias D, Vlachos L. Preoperative localization of pancreatic insulinoma by selective intraarterial calcium injection and hepatic venous sampling. Hepatogastroenterology. 2000;47:884-6.
30. Hayashi Y, Masuda H, Eizawa T, Yamanaka T, Naka M. Use¬fulness of the combination of pre- and intraoperative selective intraarterial calcium injection to detect residual insulinomas. Intern Med. 2001;40:48-51.
31. Netter FH. Atlas of human anatomy. Fifth edition. Philadelphia, PA: Saunders Elsevier; 2010. p. 139-71.
32. Kimura W, Hirai I, Yamaguchi H, Wakiguchi S, Murakami G, Kimura Y. Surgical anatomy of arteries running transversely in the pancreas, with special reference to the superior transverse pancreatic artery. Hepatogastroenterology. 2004;51:973-9.
33. Macedo AL, Hidal JT, Marcondes W, Mauro FC. Robotic near-total pancreatectomy for nesidioblastosis after bariatric surgery. Obes Surg. 2016;26:3082-3.
34. Davi MV, Pia A, Guarnotta V, Pizza G, Colao A, Faggiano A. The treatment of hyperinsulinemic hypoglycaemia in adults: An update. J Endocrinol Invest. 2017;40:9-20. doi: 10.1007/ s40618-016-0536-3.
35. Parker KL, Schimmer BP. Pituitary hormones and hypothalamic release factors. En: Brunton LL, Chabner B, Knollmann BC, editors. Goodman & Gilman’s the pharmacological basis of therapeutics. New York: McGraw-Hill Medical; 2011. p. 1489- 510.
36. Schwetz V, Horvath K, Kump P, Lackner C, Perren A, Forrer F, et al. Successful medical treatment of adult nesidioblastosis with pasireotide over 3 years: A Case report. Medicine (Baltimore). 2016;95:e3272.
37. Giri D, Price V, Yung Z, Didi M, Senniappan S. Fluoxetine-induced hypoglycaemia in a patient with congenital hyperin¬sulinism on lanreotide therapy. J Clin Res Pediatr Endocrinol. 2016;8:347-50.
38. Benowitz NL. Drugs used in hypertension. En: Katzung BG, Masters SB, Trevor AJ, editors. Basic and clinical pharmacology. New York: McGraw-Hill Medical; 2011. p. 182-4.
39. Durmaz E, Flanagan SE, Parlak M, Ellard S, Akcurin S, Bircan I. A combination of nifedipine and octreotide treatment in an hyperinsulinemic hypoglycemic infant. J Clin Res Pediatr En¬docrinol. 2014;6:119-21.
40. Khawash P, Hussain K, Flanagan SE, Chatterjee S, Basak D. Nifedipine in congenital hyperinsulinism – A case report. J Clin Res Pediatr Endocrinol. 2015;7:151-4.
41. de Heide LJ, Glaudemans AW, Oomen PH, Apers JA, Totte ER, van Beek AP. Functional imaging in hyperinsulinemic hypoglycemia after gastric bypass surgery for morbid obesity. J Clin Endocrinol Metab. 2012;97:E963-7.
42. Del Chiaro M, Rangelova E, Segersvard R, Arnelo U. Are there still indications for total pancreatectomy? Updates Surg. 2016;68:257-63.
43. Krieger AG, Smirnov AV, Berelavichus SV, Gorin DS, Kaldarov AR, Karel’skaya NA, et al. Organic hyperinsulinism: Radio¬logical diagnostics and surgical treatment. Khirurgiia (Mosk). 2016;6:14-29.
44. Maitra, A. Sistema endocrino. En: Mitchell R, Kumar V, Abbas AK, Fausto N, Aster JC, editores. Patología estructural y fun¬cional. Barcelona: Elsevier; 2012. p. 1120-2.
45. Gacar A, Pekmezci D, Karayigit MO, Kabak YB, Gulbahar MY. Nesidioblastosis in a simmental calf. J Comp Pathol. 2012;147:491-4.
46. Klöppel G, Anlauf M, Raffel A, Perren A, Knoefel WT. Adult diffuse nesidioblastosis: Genetically or environmentally indu¬ced? Hum Pathol. 2008;39:3-8.
47. Álvarez GC, Faria EN, Beck M, Girardon D, Machado AC. La¬paroscopic spleen-preserving distal pancreatectomy as treatment for nesidioblastosis after gastric bypass surgery. Obes Surg. 2007;17:550-2.
48. Abellán P, Cámara R, Merino-Torres JF, Pérez-Lázaro A, del Olmo MI, Ponce JL, et al. Severe hypoglycemia after gastric bypass surgery for morbid obesity. Diabetes Res Clin Pract. 2008;79:e7-9. doi: http://dx.doi.org/10.1016/j.dia-bres.2007.07.017.
49. Mathavan VK, Arregui M, Davis C, Singh K, Patel A, Meacham J. Management of postgastric bypass noninsulinoma pancreato¬genous hypoglycemia. Surg Endosc. 2010;24:2547-55.
50. Pathak R, Karmacharya P, Salman A, Alweis R. An unusual cause of hypoglycemia in a middle-aged female after bariatric surgery. J Community Hosp Intern Med Perspect. 2014;4:1-3.
51. Ünal B, Uzun ÖC, Başsorgun Ci, Erdoğan O, Elpek GÖ. A rare complication of gastric bypass (weight loss) surgery: Nesidio¬blastosis. Int J Surg Pathol. 2015;23:68-70.
Correspondencia: Alejandro Román-González, MD
Correo electrónico: alejoroman@gmail.com
Medellín, Colombia
