Administración de nutrientes
La administración de nutrientes en el paciente en estado crítico depende de su condición clínica específica y del momento metabólico en que se encuentre: durante la fase flow existe una acentuada alteración metabólica y endocrina que se traduce en el flujo y en la utilización preferencial de sustratos, la cual se mantiene durante los primeros días o hasta que perdure la condición crítica 2.
Las respuestas metabólicas en el estado crítico han sido estudiadas en una variedad de pacientes, especialmente en aquellos con trauma, quemaduras o sepsis. Las respuestas metabólicas ocurren en forma simultánea y primordialmente se manifiestan en el hígado, el músculo esquelético, el intestino, los riñones y la herida o el foco inflamatorio 97-99.
Desde hace más de 60 años, Sir David Cuthbertson 100 definió la respuesta metabólica al trauma en términos de las fases ebb y flow, todo lo cual ha sido revisado en detalle en el texto “Metabolismo, nutrición y shock” editado por uno de los autores 101.
La fase ebb, o fase de shock, se caracteriza por un estado de hipoperfusión por vasoconstricción periférica, bajo gasto cardiaco, hipotensión y gasto energético en reposo disminuido:
Por lo cual se la denomina fase hipometabólica. Es un verdadero estado de depresión o declinación de la vitalidad. El paciente aparece hipovolémico, hipotenso, taquicárdico, con la piel pálida, fría y húmeda, y presenta oliguria y letargo mental; de no ser corregido en forma eficaz, tal estado progresa hacia la necrobiosis y la muerte. Al poco tiempo de iniciado el shock hipovolémico, hay hiperglucemia que aparece como característica bioquímica fundamental. Simultáneamente, ocurren alteraciones en el volumen y la composición de los líquidos corporales, con depleción del líquido intersticial y aumento del líquido intracelular 101 y alcalosis respiratoria inicial, seguida ésta de acentuada acidosis metabólica. Cuthbertson la denominó ebb, en un símil con la ola que choca contra la playa (fenómeno que representa el trauma o la lesión aguda) y luego retrocede hacia el mar.
La fase flow es la de hipermetabolismo e hipercatabolismo, la del resurgimiento de la vitalidad, como el torrente de regreso de la ola sobre la playa. Corresponde a la condición de los pacientes en las unidades de cuidados intensivos quirúrgicos que mediante reanimación ya han salido de la fase de shock (ebb), la cual fue atendida en el servicio de urgencias.
Esta fase se caracteriza por estrés metabólico:
Un estado cardiovascular hiperdinámico y una exagerada circulación de sustratos endógenos con acelerada producción hepática de glucosa a expensas de aminoácidos, principalmente provenientes de la degradación de la proteína muscular, y de otros precursores glucogénicos, como el lactato, todo lo cual se traduce en hiperglucemia sostenida. La manifestación más significativa en esta fase es el persistente balance negativo de nitrógeno, que es la expresión directa, pero incompleta, de la magnitud de la degradación de la proteína corporal 2.
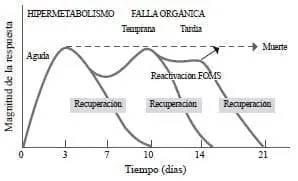
Como lo menciona Cerra 37, esta respuesta no siempre es temporal y sus manifestaciones dependen, en parte, del estímulo o del momento en el que el paciente comience el tratamiento. En ocasiones, su condición es tan crítica que lleva a la muerte; en otras, el paciente mejora y la respuesta al estrés disminuye, pero en algunos casos se reactiva, lo cual anuncia un nuevo estímulo, generalmente una complicación infecciosa. Si la infección u otra complicación son controladas, se entra en la fase de recuperación. Pero, en otros casos, el estado levemente hipermetabólico y fuertemente hipercatabólico se perpetúa hasta cuando las medidas terapéuticas lo controlen o hasta que entre en falla multiorgánica, estado que presagia la muerte (figura 3).
La recuperación es más probable cuando se trata de fallas orgánicas tempranas, en tanto que, en las fallas multiorgánicas tardías, las posibilidades de supervivencia disminuyen 26,37.
El estrés del estado crítico se caracteriza por flujo elevado de glucosa, catabolismo proteico importante, incremento en el consumo de oxígeno y pérdida notoria de tejido adiposo. La depleción de la proteína circulante y de la visceral lleva a disfunción orgánica y, eventualmente, a falla orgánica multisistémica. Con base en nuestra experiencia 2, podemos decir que en esta primera fase el paciente se encuentra más hipercatabólico que hipermetabólico, con un catabolismo proteico exagerado y un hipermetabolismo leve o moderado, fenómeno que se manifiesta por el incremento en la excreción del nitrógeno ureico urinario.
 Figura 3. Respuesta metabólica al trauma FOMS: falla orgánica multisistémica
Figura 3. Respuesta metabólica al trauma FOMS: falla orgánica multisistémica
Traducido con permiso de: Cerra F. The hypermetabolism organ failure complex. World J Surg. 1987;11:173-81.
Puesto que el principal objetivo del soporte nutricional en los estados de estrés es la preservación de la estructura corporal y el mantenimiento de la síntesis proteica, se hace necesario suministrar un régimen nutricional que responda a las necesidades metabólicas y nutricionales específicas de esta condición clínica particular. La síntesis proteica responde más a la administración de proteína que a la administración de calorías en forma de carbohidrato, aunque se debe tener en cuenta que la administración de proteína exógena no reduce ni evita el catabolismo, apenas lo modula 16,36,37.
Se ha determinado que en la fase flow existe un exceso de glucosa circulante y un cambio en la preferencia del sustrato energético, pues, en lugar de utilizar los carbohidratos y la grasa como sustratos preferenciales como ocurre en la persona sana, la proteína viene a ser el sustrato preferencial.
La administración de 2,0 a 2,5 g/día de proteína con cargas de glucosa entre 100 y 200 g/día, modulan el estado hipermetabólico 2,14,17,26,37,61,90. Parece fundamental mantener el paciente con glucemias no mayores de 160-180 mg/dl mediante la disminución en el aporte de glucosa exógena y la administración de insulina en caso necesario. Este régimen, conocido como “soporte hipocalórico”, iniciado precursoramente en nuestro servicio 2 y luego aceptado por múltiples autores 4,23,24,26,35, suministra entre 50 y 70 % del gasto energético basal, y ha sido recomendado también en el paciente obeso 28,102,103.
El soporte metabólico es un componente fundamental del manejo del paciente en estado crítico y se debe aplicar con singular cuidado durante la fase catabólica 2.
Otros motivos para usar la nutrición hipocalórica, y siempre hiperproteica, son el riesgo de realimentación temprana, el marasmo, la enfermedad pulmonar obstructiva crónica, el síndrome de dificultad respiratoria aguda, el síndrome de respuesta inflamatoria sistémica, la sepsis con inestabilidad hemodinámica, el síndrome de disfunción orgánica múltiple, la elevación persistente de la frecuencia respiratoria, la hipercapnia, la hiperglucemia y la hipertrigliceridemia 7,30,104. En estos casos, el soporte metabólico tiene como objeto mantener las diferentes vías metabólicas sin forzarlas hacia direcciones contrarias, reconociendo la inconveniencia de utilizar calorías en exceso que pueden comprometer órganos, tanto en su estructura como en su función 2.
A continuación se detallan algunos de los estudios clínicos recientes más importantes, donde se comprueba la importancia de la administración adecuada de proteína en el paciente en estado crítico:
- En la revisión sistemática y en el metaanálisis informados por Jiang, et al. 26, se concluye que la nutrición parenteral hipocalórica reduce las complicaciones infecciosas y acorta el tiempo de estancia hospitalaria.
- Marik y Hooper 105, en su revisión sistemática y metaanálisis, no lograron demostrar resultados positivos del régimen normocalórico en comparación con la nutrición hipocalórica intencional en pacientes de la unidad de cuidados intensivos durante la fase aguda de su enfermedad.
- Weijs, et al. 7, en su estudio prospectivo en pacientes críticamente enfermos no sépticos, encontraron que una alta administración proteica se asocia con menor mortalidad, mientras que la sobrealimentación energética temprana incrementó la tasa de mortalidad.
- El estudio observacional de Allingstrup, et al. 3, demostró que el grupo de pacientes con mayor aporte proteico (1,4 g/kg) tuvo una menor tasa de mortalidad.
- En el análisis de la información del International Nutrition Survey 106, se encontró que con el suplemento de una cantidad de proteína ≥80 % de lo prescrito, la tasa de mortalidad disminuyó, y cuando se hizo esto mismo con las calorías, el resultado no fue igual. De esta manera se comprobó que la deuda proteica es más importante que la calórica.
- TICACOS, uno de los estudios más famosos sobre cuidado crítico 107, logró probar los efectos negativos secundarios a provisiones calóricas altas. El grupo de estudio recibió la prescripción energética obtenida por la calorimetría indirecta y, el grupo de control, la provisión de 25 kcal/kg al día. La calorimetría indirecta continuó elevándose debido al exceso en el aporte energético proveniente de otras fuentes no nutricionales (propofol), efecto que podemos considerar como “correr en contra de su propia sombra”. Aun así, se logró mostrar un pequeño beneficio en la reducción de la mortalidad debido a la optimización de los aportes nutricionales.
La crítica fundamental de Hoffer 16 es que la mayoría de los estudios clínicos en pacientes en estado crítico:
Han tenido como objetivo el estudio de la provisión y la deuda calórica, y no la proteica, excluyendo así el macronutriente principal que requiere el paciente en estado crítico.
En la fase catabólica, el empleo de emulsiones de lípidos debe ser cauteloso. Se deben evitar aquellas exclusivamente a base de soya y están contraindicadas las concentraciones al 10 %. Aunque no existen estudios definitivos que demuestren los efectos negativos de las emulsiones a base de soya, se puede decir que son desequilibradas, que contienen una sobrecarga de ácidos grasos poliinsaturados n-6 y que generan efectos inmunológicos adversos. Hoy en día, existen varias alternativas de emulsiones de lípidos con mezclas de triglicéridos de cadena media y triglicéridos de cadena larga, aceite de oliva y aceite de pescado, siendo cualquiera de ellas preferibles a las emulsiones solamente a base de soya 66,108.
Estudios recientes muestran los beneficios del empleo de emulsiones de lípidos con mezclas de aceite de soya, aceite de coco, aceite de oliva y aceite de pescado, las cuales aportan cantidades de ácidos grasos poliinsaturados n-3 que actúan como nutrientes terapéuticos y, al mismo tiempo, como agentes antiinflamatorios 109-114.
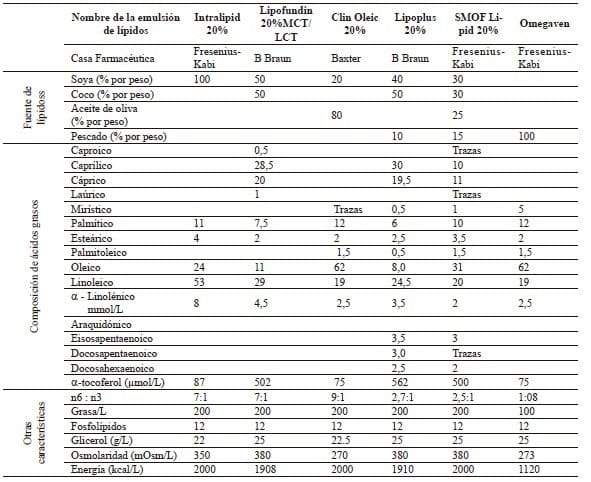
En la tabla 4 se muestra la composición de varias de las emulsiones de lípidos disponibles en nuestro medio 111,112.
Su uso está indicado en los estados inflamatorios graves, como ocurre en los pacientes sometidos a cirugía mayor, en el trauma, en los pacientes quemados y en los sépticos. En la unidad de cuidados intensivos, el aporte diario de grasa parenteral no debe exceder 1g/kg de peso actual, y se debe administrar preferiblemente después del sexto día. Sólo se debe considerar su administración temprana en los pacientes con hiperglucemias graves difíciles de controlar y en los emaciados (índice de masa corporal menor de 17). En todos los casos, la nutrición parenteral debe contener las vitaminas y oligoelementos para cubrir las necesidades diarias.
Tabla 4.
Composición de emulsiones de lípidos para uso intravenoso

MCT: triglicéridos de cadena media LCT : triglicéridos de cadena larga n6:n3: Proporción ácidos grasos n6 y ácidos grasos n3
Modificado con permiso de: Calder P, Jensen G, Koletzko B, Singer P, Wanten G. Lipid emulsions in parenteral nutrition of intensive care patients:
current thinking and future directions. Int Care Med.2010;36:735-49.
Adaptado con permiso de: Vanek V, Sedner D, Bristrian B, Gura K, Valentine C, et al. A.S.P.E.N. Position Paper: Clinical Role for Alternative
Intravenous Fat Emulsions. Nut Clin Pract. 2012;2:150-192.
Una vez ha pasado la fase catabólica que usualmente dura entre 3 y 7 días, viene la fase anabólica, que es la fase de recuperación. La duración de esta depende de varios factores: el estado nutricional previo a la lesión biológica, la duración de la fase catabólica, el adecuado soporte nutricional y otras intervenciones médicas.
Pueden transcurrir meses hasta que el paciente logre la completa recuperación.
Ahora es importante un aporte calórico de 100 y más de 130 % del gasto energético basal para atender las necesidades de reparación, repleción y recuperación. En algunas oportunidades, el régimen hipocalórico o metabólico es tan tolerable que se mantiene por periodos mayores a los recomendados y, entonces, se debe reconocer que prolongarlo en forma inadecuada puede llevar a la desnutrición intrahospitalaria iatrogénica 105.
La subalimentación, igualmente, trae sus consecuencias, tales como disminución de la fuerza muscular respiratoria, alteración de la función orgánica, inmunosupresión, pobre cicatrización de heridas, incremento en la infección hospitalaria, y mayor propensión a infecciones renales y respiratorias 82,105.
¿Soporte entérico o parenteral?
Berger 113 resumió el pensamiento de lo que debe ser el soporte nutricional actual en el paciente en estado crítico: “El debate de la nutrición enteral (sic.) versus la nutrición parenteral ha terminado”: la una es complementaria de la otra. Igual planteamiento hizo Stanley J. Dudrick, a quien se da justo crédito por la iniciación de la nutrición parenteral total como un advenimiento mayor, un verdadero hito, en el devenir histórico de la medicina 115.
Las complicaciones generadas por la nutrición parenteral han sucedido por la sobrealimentación del paciente, el desconocimiento del manejo metabólico en las diferentes fases, la administración excesiva de emulsiones de lípidos fuentes de ácidos grasos esenciales, creyendo que “si algo es bueno, mucho es mejor”, la preparación incorrecta de las mezclas de nutrición parenteral, el pobre cuidado del acceso venoso central, el seguimiento metabólico inadecuado y la extinción del grupo multidisciplinario para el seguimiento del soporte nutricional.
El caso de Colombia es diferente al de Norteamérica: nosotros contamos, al igual que los países europeos, con diferentes concentraciones de aminoácidos, glutamina intravenosa, viales de multivitaminas y minerales, y emulsiones de lípidos de última generación, lo cual nos permite seleccionar la mejor opción para la nutrición parenteral.
La nutrición entérica tiene ventajas claras y concretas.
Obviamente, debe ser el método de elección en el soporte nutricional de cualquier paciente, por ser la más fisiológica, porque contribuye a la estimulación de la inmunidad intestinal y porque reduce costos 116,117. La nutrición entérica trófica es el método por medio del cual se administran pequeñas cantidades de nutrición entérica (200 a 500 ml) con el objeto de obtener sus beneficios 118, y se complementa con nutrición parenteral para lograr las cantidades necesarias de macronutrientes y micronutrientes 17,113.
Es bien reconocida la intolerancia a la alimentación entérica por parte del paciente en estado crítico:
¿hasta dónde hay que forzarlo a tolerarla?, ¿hasta cuándo hay que esperar para suministrar todas las necesidades nutricionales? Durante toda una época, la nutrición entérica se convirtió en el tratamiento de elección; infortunadamente pasó desapercibido que los productos entéricos que trataron de reemplazar a la nutrición parenteral fueron diseñados para personas sanas, por lo cual su contenido proteico era deficiente, sobre todo en aquellos en estado crítico 16. La mayoría de las fórmulas entéricas disponibles contienen una relación kcal/N de 150/1; esta relación fija dificulta el aporte de proteína 5, 61,116,117,119,120 u obliga a un aporte energético innecesario. Además, en la medida que exista intolerancia, el volumen administrado se reduce entre 300 y 600 ml, castigando aún más el aporte proteico y dificultando la contribución adecuada de vitaminas y oligoelementos 18,117.
Hoy se reconoce que la nutrición entérica exclusiva en el paciente en estado crítico es el factor iatrogénico de desnutrición más importante en las unidades de cuidados intensivos.
Por lo tanto, es necesario evaluar los nutrientes administrados y tolerados por esta vía, y el empleo de nutrición parenteral suplementaria debe ser una alternativa que siempre debe estar presente para el adecuado manejo nutricional 10,17,61.
Finalmente, se puede decir que el beneficio real para el paciente radica en el empleo adecuado de las herramientas disponibles para su manejo metabólico y nutricional, y no en la elección de una vía de soporte nutricional con exclusión de la otra. Con un soporte metabólico y nutricional adecuado, algunas veces sólo con nutrición parenteral, otras con sólo nutrición entérica y muchas veces con la mezcla de las dos, se logran mejores resultados clínicos, limitación de costos, disminución en los tiempos de hospitalización, reducción de la tasa de infección y del periodo de soporte respiratorio, menor uso de antibióticos y menores tasas de morbimortalidad 17,113,116. Esto implica un seguimiento meticuloso, cercano y multidisciplinario del paciente en estado crítico.
Conflicto de interés: Asesor Científico de Boydoor Nutrition.
Metabolism and nutrition in the critically ill patient
Abstract
The mode of nutritional support in the critically ill patient is controversial. Some authors consider caloric demand as the main objective of nutritional support based on a supposed high level of hypermetabolism, but we have demonstrated that such really does not exist, and that protein requirement should be primarily addressed for hypercatabolism as the predominant metabolic feature. Hormonal and humoral environment in the critically ill state lead to body protein degradation to attend the caloric requirements and the synthesis of acute phase proteins.
In the critical condition there is a kind of dependence from amino acid and protein metabolism. Different authors remark that the protein requirement can reach 2.0 to 3.0 g/kg/d, in patients with severe sepsis, major trauma, extensive burns, and even on those on renal replacement therapy. The overall conditions of the patient in the state of acute stress make it difficult to conduct prospective randomized trials. Different variables affect the outcome, such as the current nutritional status of the patient, the elapsed time of fasting or starvation, age, basal and concurrent pathologies, number of organs involved, and the presence of infection. Characteristic of the acute stress condition is the liability and variability of the pathophysiologic parameters.
The Surgical Metabolism and Nutrition Support Service at Hospital Universitario Fundación Santa Fe de Bogotá has recognized for many years the importance of the protein supply concomitant with reduced caloric intake from carbohydrates to no more than 600 kcal/24 hours (150-200 g/24h) as the foundation for the prescription of any type of nutritional support in the critical state.
In this article we review the reasons that lead to consider protein as the key nutrient in patients in critical condition.
Key words: diet, food, and nutrition; critical care; energy metabolism; caloric restriction; parenteral nutrition; enteral nutrition.
Referencias
- 1. Freijer K, Wijnkoop L, Russell C, Koopmanschap M, Kruizenga H, Lhachimi S, et al. The view of European experts regarding health economics for medical nutrition in disease-related malnutrition. Eur J Clin Nutr. 2015;69:539-45.
- 2. Patiño JF, Pimiento S, Vergara A, Savino P, Rodriguez M, Escallón J: Hypocaloric support in the critical ill. World J Surgery. 1999;23:553-55.
- 3. Allingstrup M, Esmailzadeh N, Wilkens Knudsen A. Espersen K, Hartvig J, Wils J, et al. Provision of protein and energy in relation to measured requirements in intensive care patients. Clin Nutr. 2012:31:462-8.
- 4. Hoffer J, Bristian B. Appropriate protein provision in critical illness: a systematic and narrative review. Am J Clin Nutr. 2012; 96:591-600.
- 5. Hoffer J, Bristian B. Why critically Ill patients are protein deprived. J Parenter Enteral Nutr. 2013; 37:300-9.
- 6. Kreyman G, Grosser S, Buggisch P, Gottschall C, Matthaei S, Greten H. Oxygen consumption and resting metabolic rate in sepsis, sepsis syndrome, and septic shock. Crit Care Med. 1993;21:1012-9
- 7. Weijs PJ, Looijaard WG, Beishuizen A, Girbes AR, Oudemans-van Straaten HM. Early high protein intake is associated with low mortality and energy overfeeding with high mortality in non-septic mechanically ventilated critically ill patients. Crit Care. 2014;18:701.
- 8. Weijs PJ, Wischmeyer PE. Optimizing energy and protein balance in the ICU. Curr Opin Clin Nutr Metab Care. 2013;16:194- 201.
- 9. Weijs P, McClave S. The need to differentiate fear for energy overfeeding from future benefits of protein feeding: so much to gain. Curr Opin Clin Nutr Metab Care. 2016;19:116-9.
- 10. Hoffer J, Bistrian BR. Energy deficit is clinically relevant for critically ill patients: no. Intensive Care Med. 2015;41:339-41.
Otras Referencias
- 11. Dickerson R. Hypocaloric, high protein nutrition therapy for critically ill patients with obesity. Nutr Clin Pract. 2014;29:786-91.
- 12. Weissman C, Kemper M, Askanazi J, Hyman A , Kinney J. Resting metabolic rate of the critically ill patient: Measured versus predicted. Anesthesiology. 1986;64:673-9.
- 13. Blackburn G, Wollner S, Bistrian B. Provision of protein and energy in relation to measured requirements in intensive care patients. Clin Nut. 2012;31:462e-8e.
- 14. Kondrup J. Nutritional-risk scoring systems in the intensive care unit. Clin Nutr Metab Care. 2014;17:177-82.
- 15. Japur C, Monteiro J, Marchini J, García R, Basile-Filho A. Can an adequate energy intake be able to reverse the negative nitrogen balance in mechanically ventilated critical ill patients? J Crit Care. 2010; 25:445-50.
- 16. Hoffer J. Human protein and amino acid requirements. J Parenter Enteral Nutr. 2016. In Press
- 17. Heidegger C, Berger M, Graf S, Zingg W, Damon P, Constanza M, et al. Optimisation of energy provision with supplemental parenteral nutrition in critically ill patients: a randomised controlled clinical trial. Lancet. 2013;381:385-93.
- 18. Hoffer L. Protein requirement in critical illness. Appl Physiol Nutr Metab 2016. In press
- 19. Marian M, Roberts S. Carbohydrate metabolism. A comparison of stress and non stress states. En: Cresci G, editor. Nutrition for the Critically Il Patient. A Guide to Practice. Second ed. , Boca Raton, Fl. CRC Press; 2015.
- 20. Moore F. Energy and the maintenance of the body cell mass. The Jonathan E. Rhoads Lecture. J Parenter Enteral Nutr. 1980;4:228-60.
Bibliografías
- 21. Arabi Y, Aldawood A, Haddad S, Al-Dorzi H, Tamim H, Jones G, et al. Permissive underfeeding or standard enteral feeding in critically ill adults. N Engl J Med. 2015;372:2398-408.
- 22. Heyland D. Should we PERMIT systematic underfeeding in all intensive care unit patients? Integrating the results of the PERMIT Study in our clinical practice guidelines. J Parenter Enteral Nutr. 2016;40:156-8.
- 23. Lohlein D. Principles and indications of hypocaloric parenteral nutrition. World J Surg. 1986;10:64-71.
- 24. Lohlein D. The concept of hypocaloric parenteral nutrition: one form of protein-sparing therapy. J Clin Nutr Gastroenterol. 1987;2:57.
- 25. Villazón A, Corona A, Terrazas F, Madrigal V. Gasto basal energético en el paciente quirúrgico. En: Patiño JF editor. Infección Quirúrgica. Bogotá, Fundación Santa Fe de Bogotá, Centro Médico de los Andes; Bogotá: 1989; p. 173-190.
- 26. Jiang H, Sun M, Hefright B, Chen W, Daien C, Zeng J. Efficacy of hypocaloric parenteral nutrition for surgical patients: A systematic review and meta-analysis. Clinical Nutrition. 2011; 30:730-7.
- 27. Singer P, Hiesmayr M, Biolo G, Felbinger T, Berger M, Goeters C, et al. Pragmatic approach to nutrition in the ICU: Expert opinion regarding which calorie protein target. Clin Nutr. 2014;33:246-51.
- 28. Hurt R, Frazier T, McClave S, Cave M. Pharmaconutrition for the obese critically ill patient. J Parenter Enteral Nutrition. 2011;35(Suppl.):S60-72.
- 29. Burke P, Young L, Bristian B. Metabolic vs nutrition support: a hypothesis. J Parenter Enteral Nutr. 2010;34:546-8.
- 30. Hoffer LJ, Bistrian BR. What is the best nutritional support for critically ill patients? Hepatobiliary Surg Nutr. 2014;3:172-4.
Otras Bibliografías
- 31. Blackburn G, Bistrian B, Maini B, Schlamm H, Smith M. Nutritional and metabolic assessment of the hospitalized patient. J Parenter Enteral Nutr. 1977;1:11-21.
- 32. Long C. Energy balance and carbohydrate metabolism in infection and sepsis. Am J Clin Nutr. 1977;30:1301-10.
- 33. Hollander J, Mechanick J. Nutrition support and the chronic critical illness syndrome. Nut Clin Pract. 2006;21:587-604.
- 34. Hill GL. Disorders of Nutrition and Metabolism in Clinical Surgery. Understanding and Management. Edinburgh, New York; Churchill Livingstone. , 1992.
- 35. Patiño JF. Soporte metabólico hipocalórico del paciente en estado séptico. En: Patiño JF editor. Infección Quirúrgica. Bogotá: Fundación Santa Fe de Bogotá, Centro Médico de los Andes; 1989. p.161-72
- 36. Cerra F, Siegel J, Colman, Border J, Menamy R. Septic Autocannibalism. A failure of exogenous nutritional support. Ann Surg. 1980;192:570-8.
- 37. Cerra F. The hypermetabolism organ failure complex. World J Surg. 1987;11:173-81.
- 38. Singer P. Toward protein-energy goal-oriented therapy? Critical Care. 2009;13:188-9.
- 39. Lawson CM, Miller KR, Smith VL. Appropiate protein and specific aminoacid delivery can improve patient outcome: Factor or fantasy? Curr Gastroenterol Rep. 2011;13:380-7.
- 40. Menamy R, Birkhan R, Oswald R, Cerra F, Borde J. Multiple systems organ failure II. The effect of infusions of aminoacids and glucose. J Trauma.1981;21:228-36.
Lecturas Recomendadas
- 41. Rudman D, DiFalco T, Columbus J, Smith R, Salan A, Warren W. Maximal rates of excretion and synthesis of urea in normal and cirrhotic subjects. J Clin Invest. 1973;52:2241-9.
- 42. Dickerson RN, Maish GO, III, Croce MA, Minard G, Brown RO. Influence of aging on nitrogen accretion during critical illness. JPEN J Parenter Enteral Nutr. 2015;39:282-90.
- 43. Dickerson RN, Tidwell AC, Minard G, Croce MA, Brown RO. Predicting total urinary nitrogen excretion from urinary urea nitrogen excretion in multiple-trauma patients receiving specialized nutritional support. Nutrition. 2005;21:332-8.
- 44. Hoffer J. How much protein do parenteral amino acid mixtures provide? Am J Clin Nutr. 2011; 94:1396-8.
- 45. Carpenter K. Protein and Energy: A study of changing ideas in nutrition. New York, NY: Cambridge University Press; 1994.
- 46. Rooyackers O, Kouchek-Zadeh R, Tjader I, Nordberg A, Klaude M, Wernerman J. Whole body protein turnover in critically ill patients with multiple organ failure. Clin Nutr. 2015;34:95-100.
- 47. Van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, et al. Intensive insulin therapy in critically ill patients. N Eng J Med. 2001;345:1359-67.
- 48. Gamble J. Physiological information gained from studies on the life raft ration. In: The Harvey Society of New York, eds. The Harvey Lectures. Lancaster, PA: The Sciences Press Printing Co. 1947. p 247-73.
- 49. Long C, Nelson K, Akin J, Geiger J, Merric H, Blakemore W. A physiologic basis for the provision of fuel mixtures in normal and stressed patients. J Trauma. 1990;30:1077-86.
- 50. Elwyn D. The unique role of glucose in artificial nutrition: impact of injury and malnutrition. Clin Nutr. 1988;7:195-202.
Otras Lecturas Recomendadas
- 51. Askanazy J, Kvetan V, Goldiner P. Nutrition in the Acutely Ill. Anesthesia Clin North Am.1988;6:49-77.
- 52. Sobotka L, Soeters P, Raguso C, Kolliet P, Pichard C. Nutritional support in the critically ill and septic patients In: Sobotka L, Allison S, Furst P, Meier R, Pertkiewicz, Soeters P, editors. Basics in clinical nutrition. 3rd ed. Prague: House Galén; 2011 p.302-8.
- 53. Singer P, Berger M, Van den Berghe G, Biolo G, Calder P, Forbes A, et al. ESPEN guidelines on parenteral nutrition: intensive care. Clin Nutr. 2009;28:387-400.
- 54. Mehanna HM, Moledina J, Travis J. Refeeding syndrome: what it is, and how to prevent and treat it. Br Med J. 2008;336:1495-8.
- 55. Hiesmayr M. Nutrition risk assessment in the ICU. Curr Opin Clin Nutr Metab. 2012;15:174-80.
- 56. Patiño JF. Determinación del gasto energético básico. Rev Colomb Cir.1990;5:116-8.
- 57. Van den Berghe G, Wilmer A, Hermans G, Meersseman W, Wouters P, Milants I, et al. Intensive insulin therapy in the medical ICU. N Engl J Med. 2006; 354:449-61.
- 58. The NICE-SUGAR Study Investigators. Intensive versus conventional glucose control in critically ill patients. N Engl J Med. 2009;360:1283-97.
- 59. The NICE-SUGAR Study Investigators. Hypoglycemia and risk of death in critically ill patients. N Engl J Med. 2012;367: 1108-18.
- 60. American Diabetes Association. Standards of medical care in diabetes-2012. Diabetes Care. 2012;35(Suppl 1):S11-S63.
Fuentes
- 61. McClave S, Taylor B, Martindale R, Warren M, Johnson D, Braunschweig C, et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) J Parenter Enteral Nutr. 2016;40:159-211.
- 62. Carpentier YA, Sobotka L. Lipids En: Sobotka L. editor. Basics in Clinical Nutrition. 4th ed. Praque: House Galén; 2011. p. 257-62.
- 63. Calder P, Grimble R. Nutrients that influence inflammation and immunity: ω3 fatty acids. En: Sobotka L. editor. Basics in Clinical Nutrition. 4th ed. Praque: House Galén; 2011. p. 292-8.
- 64. Calder P, Jensen G, Koletzko B, Singer P, Wanten G. Lipid emulsions in parenteral nutrition of intensive care patients: current thinking and future directions. Intensive Care Med. 2010;36:735-49.
- 65. Singer P, Shapiro H, Theilla M, Anbar R, Singer J, Cohen J. Anti-inflammatory properties of omega-3 fatty acids in critical illness: novel mechanisms and an integrative perspective. Intensive Care Med. 2008;34:1580–92.
- 66. Mizock B, DeMichele S. The acute respiratory distress syndrome: Role of nutritional modulation of inflammation through dietary lipids. Nut Clin Pract. 2004;19:563-74.
- 67. Calder P. The 2008 ESPEN Sir David Cuthberson lecture: Fatty acids and inflammation – from the membrane to the nucleus and from the laboratory bench to the clinic. Clin Nutr. 2010;29:5-12.
- 68. Lee S, Gura K, Arsenault D, Bristian B, Puder M. Current clinical applications of omega-6 and omega-3 fatty acids. Nut Clin Pract. 2006;21:323-41.
- 69. Fraipont V, Preiser J. Energy estimation and measurement in critically ill patients. J Parenter Enteral Nutr. 2013;37:705-13.
- 70. Frankenfield D, Coleman A, Alam S, Cooney R. Analysis of estimation methods for resting metabolic rate in critically ill adults. J Parenter Enteral Nutr. 2009;33:27-36.
Otras Fuentes
- 71. Krenisty J. Adjusted Body weight, Pro: evidence to support the use of adjusted body weight in calculating calorie requirements. Nutr Clin Pract. 2005;20:468-73.
- 72. Harris JA, Benedict FG. A biometric study of human basal metabolism. Proc Natl Acad Sci USA. 1918;4(12):370-3.
- 73. Mifflin M, Jeor S, Hill L, Scott B, Daugherty S, Koh Y. A new predictive equation for resting energy expenditure in healthy individuals. Am J Clin Nutr.1990;51:241-7.
- 74. MacDonald A, Hildebrandt L. Comparison of formula equations to determine energy expenditure in the critically ill patient. Nutrition. 2003;19:233-9.
- 75. Flancbaum L, Choban PS, Sambucco S, Verducci J, Burge JC. Comparison of indirect calorimetry, the Fick method, and prediction equations in estimating the energy requirements of critically ill patients. Am J Clin Nutr.1999; 69:461-6.
- 76. Frankenfield D, Smith S, Cooney R. Validation of 2 approaches to predicting resting metabolic rate in critically ill patients. J Parenter Enteral Nutr. 2004;28:259-64.
- 77. Wooley J, Frankenfield D. Energy. In: Mueller C, Kovacevich D, Mc Clave, S, Miller S, Scwartz D, editors. Second edition. The A.S.P.E.N. Nutrition Support Core Curriculum. Silver Spring: American Society for Parenteral and Enteral Nutrition; 2012. p. 22 -35.
- 78. Rahman A, Hasan R, Agarwala R, Martin C Day A, Heyland D. Identifying critically-ill patients who will benefit most from nutritional therapy: Further validation of the “modified NUTRIC” nutritional risk assessment tool. Clin Nutr. 2016;35:158-62.
- 79. Hoffer J. Protein requirements in protein-catabolic critical illness. Lecture presented at; 2016 Clinical Nutrition Week ASPEN. Conference; 2016, January 17, Austin, Texas.
- 80. Rombeau J, Caldwell M, Forlaw L, Guenter P. Atlas of Nutrition Support Techniques. Boston: Little Brown and Company; 1989. p.14.
Citas Bibliográficas
- 81. Schlein K Coulter S. Best practices for determining resting energy expenditure in critically ill adults. Nutr Clin Pract. 2014;29:44-55.
- 82. Schols A, Ferreira I, Franssen F, Gosker H, Janssens W, Muscaritoli M, et al. Nutritional assessment and therapy in COPD: a European Respiratory Society statement. Eur Respir J. 2014;44:1504-20.
- 83. Schols AM. The 2014 ESPEN Arvid Wretlind Lecture: Metabolism & nutrition: shifting paradigms in COPD management. Clinical Nutrition. 2015;34:1074-9.
- 84. Schols A. Nutrition as a metabolic modulator in COPD. Chest. 2013;144:1340-5.
- 85. Rice T. Gluttony in the intensive care unit. 2013. Am J Resp Crit Care Med. 2013;187:223-4.
- 86. Dickerson R. Hypocaloric feeding of obese patients in the intensive care unit. Curr Opin Clin Nutr Metab Care. 2005;8: 189-96.
- 87. Casaer M, van den Berghe G. Nutrition in the acute phase of critical illness. N Engl J Med. 2014;370:1227-36.
- 88. Frankenfield, D, Smith J, Cooney R. Accelerated nitrogen loss after traumatic injury is not attenuated by achievement of energy balance. J Parenter Enteral Nutr. 1997;21:324-9.
- 89. Behrendt W, Bogatz V, Gianni G. The influence of posttraumatic parenteral calorie and nitrogen supply upon the cumulative nitrogen balance. Infusionstherapie. 1990;17:32-9.
- 90. Preiser J, van Zanten A, Berger M, Biolo G, Casaer M, Doig G, et al. Metabolic and nutritional support of critically ill patients: consensus and controversies. Crit Care. 2015;19:2-11.
Otras Citas Bibliográficas
- 91. Wilmore DW. The metabolic management of the critically ill. New York: Plenum Medical Book Company; 1977. p. 36.
- 92. Dudrick SJ, MacFadyen BV Jr, Van Buren CT, Ruger R, Maynard A: Parenteral hyperalimentation; metabolic problems and solutions. Ann Surg. 1972;19:259-64.
- 93. Blackburn G, Wollner S, Bistrian B. Nutrition support in the intensive care unit. Arch Surg. 2010;145:533-8.
- 94. Meng H. Fat Emulsions in Parenteral Nutrition. En: Fischer J, editor. Total Parenteral Nutrition. Boston: Little Brown and Company; 1976. p.305.
- 95. Wanten G, Calder P. Immune modulation by parenteral lipid emulsions. Am J Clin Nutr. 2007;85:1171-84.
- 96. Patiño JF, Escallón J, Gómez G, Savino P, Rodríguez Y. Los lípidos de tercera generación. Nuevas emulsiones con triglicéridos de cadena media para nutrición parenteral. Rev Colomb Cir.1988;3:133-36.
- 97. Bessey PQ. Metabolic response to critical illness. En: Wilmore D, Cheung L, Harken A, Holcroft J, Meakins J, editors. Scientific American Surgery. New York: Scientific American Inc.; 1995.
- 98. Monk DN, Plank LD, French-Arcas G, Finn P, Streat S, Hill G. Sequential changes in the metabolic response in critically injured patients in the first 25 days after blunt trauma. Ann Surg. 1996;223:395.
- 99. Soeters MR, Soeters PB. The evolutionary benefit of insulin resistance. Clin Nutr. 2012; 31:1002–7.
- 100. Cuthbertson D. Surgical metabolism: historical and evolutionary aspects. En: Metabolism and the Response to Injury. Wilkinson A and Cuthbertson D (editors). Chicago: Year Book Medical Publishers, Inc; 1975.
Referencias Bibliográficas
- 101. Patiño JF. Metabolismo Nutrición y Shock en el Paciente Quirúrgico. Tercera edición. Bogotá: Fundación Lucía Patiño Osorio; 1985.
- 102. Martindale R, Delegue M, McClave S, Monroe C, Smith V, Kiraly L. Nutrition delivery for obese ICU patients: Delivery issues, lack of guidelines, and missed opportunities. J Parenter Enteral Nutrition. 2011;35(Suppl.):S80-7.
- 103. 103) McClave S, Kushner R, van Way III C, Cave M, Delegue M, Dibaise J, et al. Nutrition therapy of the severely obese, critically ill patient: Summation of conclusions and recommendations. J Parenter Enteral Nutrition. 2011; 35(Suppl.):S88-96.
- 104. Crook M, Hally V, Panteli J. The importance of the refeeding syndrome. Nutrition. 2001;17: 632-7.
- 105. Marik P, Hooper M. Normocaloric versus hypocaloric feeding on the outcomes of ICU patients: a systematic review and meta-analysis. Intensive Care Med. 2016;42:316-23.
- 106. Nicolo M, Heyland DK, Chittams J, Sammarco T, Compher C. Clinical outcomes related toprotein delivery in a critically ill population: a multicenter, multinational observation study. J Parenter Enteral Nutr. 2016;40:45-51.
- 107. Singer P, Anbar R, Cohen J, Shapiro H, Shalita-Chesner M, Lev S, Grozovski E, et al. The tight calorie control study (TICACOS): a prospective, randomized, controlled pilot study of nutritional support in critically ill patients. Intensive Care Med. 2011;37:601-9.
- 108. Wanten G, Calder P. Immune modulation by parenteral lipid emulsions. Am J Clin Nutr. 2007;85:1171-84.
- 109. Calder PC. Lipids for intravenous nutrition in the hospitalized adult patients: a multiple choice of options. Proc Nutr Soc. 2013;72:263-76.
- 110. Kleck S, Chambrier C, Singer P, Rubin M, Bowling T, Staun M, et al. Four-week parenteral nutrition using a third generation lipid emulsion (SMOFlipid) – A double-blind, randomized, multicenter study in adults. Clin Nutr. 2013;32:224-31.
Otras Referencias Bibliográficas
- 111. Calder P, Jensen G, Koletzko B, Singer P, Wanten G. Lipid emulsions in parenteral nutrition of intensive care patients: current thinking and future directions. Int Care Med. 2010;36:735-49.
- 112. Vanek V, Sedner D, Bristrian B, Gura K, Valentine C, et al. A.S.P.E.N. Position Paper: Clinical Role for Alternative Intravenous Fat Emulsions. Nut Clin Pract 2012; 27:150-92.
- 113. Berger M. The 2013 Arvid Wretlind lecture: Evolving concepts in parenteral nutrition. Clin Nutr. 2014;33:563-70.
- 114. Green P, Theilla M, Singer P. Lipid metabolism in critical illness. Curr Opin Clin Nutr Metab Care 2016. In press.
- 115. Dudrick S, Wilmore D, Vars H, Rhoads J. Long-term total parenteral nutrition with growth, development and positive nitrogen balance. Surgery. 1968;64:134-42.
- 116. Thibault R, Pichard C. Nutrition and clinical outcome in intensive care patients. Curr Opin Clin Nutr Metab Care. 2010;13:177-83.
- 117. Berger M, Soguel L, Charriere M, Theriault B, Pralong F, SchallerM. Impact of the reduction of the recommended energy target in the ICU on protein delivery and clinical outcomes. Clinical Nutriton. (2016). In press
- 118. Rice T, Wheeler A, Thompson B, Steingrub J, Hite R, Moss M, et al. Initial trophic vs full enteral feeding in patients with acute lung injury: the EDEN randomized trial. JAMA. 2012; 307:795-803.
- 119. Marik PE. Feeding critically ill patients the right ‘‘whey’’: thinking outside the box. Ann Intensive Care. 2015;5:11.
- 120. van Zanten A. Should we increase protein delivery during critical illness? J Parenter Enteral Nutr 2016. In press
Correspondencia: Patricia Savino, ND, MBA
Correo electrónico: patricia.savino@gmail.com
Bogotá, D.C.