Los lípidos son un importante sustrato energético
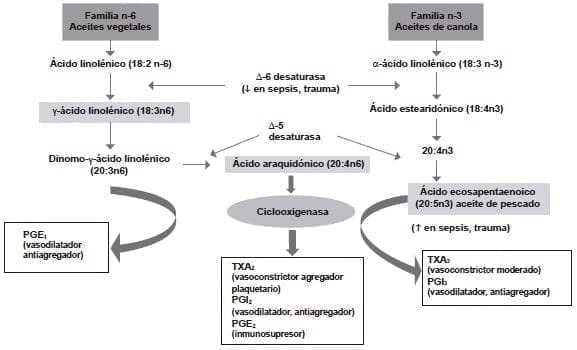
El ácido graso ω6, ácido araquidónico, es el sustrato común para la síntesis de eicosanoides mediante la acción de las enzimas ciclooxigenasa y lipoxigenasa.
Estos eicosanoides incluyen varias series 2 de protaglandinas, series 2 de tromboxanos y series 4 de leucotrienos, los mediadores inflamatorios clásicos que juegan un papel importante en la regulación de la función inmunitaria.
Una de las funciones relevantes del ácido graso ω3 es la de reemplazar parcialmente al ácido araquidónico en las membranas celulares, tanto en la acción inmunitaria como en el proceso inflamatorio, lo que lleva a la disminución de las protaglandinas, los tromboxanos y los leucotrienos del ácido araquidónico. Entre los ω3, están el ácido eicosapentaenoico y el docosahexaenoico.
El ácido eicosapentaenoico puede también actuar como sustrato para las enzimas ciclooxigenasa y lipoxigenasa, generando una familia diferente de eicosanoides, las prostaglandinas y los tromboxanos de la serie 3 y los leucotrienos de la serie 5 63-65. Los mediadores generados por el ácido eicosapentaenoico son menos potentes que los que provienen del ácido araquidónico (figura 1) 66.
 Figura 1. Metabolismo de los ácidos grasos poliinsaturados
Figura 1. Metabolismo de los ácidos grasos poliinsaturados
PGE1: prostaglandina E1; PGE2: prostaglandina E2; PGI2: prostaglandina I2; PGI3: prostaglandina I3; TXA2:
tromboxano A2; TXA3: tromboxano A3. Traducido con permiso de: Mizock B, DeMichele S. The acute respiratory distress syndrome:
Role of nutritional modulation of inflammation through dietary lipids. Nut Clin Pract. 2004;19:563-74.
Se han identificado componentes de lípidos que incluyen las resolvinas, las protectinas y las maresinas, potentes mediadores antiinflamatorios generados a partir del ácido eicosapentaenoico y del docosahexaenoico, a los cuales se atribuyen las acciones antiinflamatorias de los ácidos grasos de cadena larga ω3 presentes en el aceite de pescado 67,68.
El metabolismo de los lípidos y de las lipoproteínas se modifica sustancialmente en el paciente en estado crítico. La actividad de la lipasa sensible a hormonas (Hormone-Sensitive Lipase, HSL), antes conocida como la hidrolasa de ésteres de colesterol (Cholesteryl Ester Hydrolase, CEH), se incrementa en respuesta a las catecolaminas y a las citocinas inflamatorias.
Esto favorece la producción de ácidos grasos provenientes de la movilización de la grasa almacenada en el tejido adiposo hacia el plasma. Los ácidos grasos son depurados por el hígado y reesterificados como triglicéridos.
En el posoperatorio se incrementa la depuración de triglicéridos y la oxidación de la grasa, lo cual disminuye los niveles plasmáticos. En el paciente séptico o en el críticamente enfermo, tanto la hidrólisis de los triglicéridos como la oxidación de la grasa se pueden ver disminuidas.
Gasto energético y requerimientos calóricos
El gasto energético total incluye tres componentes: el gasto energético basal, la termogénesis inducida por la dieta (la denominada acción dinámica específica de los alimentos), y el gasto calórico de la actividad y el ejercicio (figura 2).
 Figura 2. Componentes del gasto energético total
Figura 2. Componentes del gasto energético total
Adaptado con permiso de: Wooley J, Frankenfield D. Energy. In: Mueller C, Kovacevich D, Mc Clave, S, Miller S, Scwartz D, editors. Second edition.
The A.S.P.E.N. Nutrition Support Core Curriculum. Silver Spring: American Society for Parenteral and Enteral Nutrition; 2012. p. 22 -35.
El gasto energético basal está constituido por las calorías necesarias para mantener la actividad celular metabólica básica y el normal funcionamiento del organismo: respiración, función cardiovascular, temperatura corporal, síntesis y degradación proteica y otros, en la persona en estado de reposo total. Sin ingestión reciente de alimentos y libre de cualquier tipo de estrés 69,70.
Es, por mucho el mayor componente del gasto metabólico total: representa entre 60 y 70 % del gasto energético total.
El gasto energético total se calcula en la persona sana y con actividad normal, añadiendo al gasto energético basal la acción dinámica específica de los alimentos, que lo incrementa en 10 %, y el gasto energético por actividad o ejercicio, que bordea el 30 %. Según el grado y la intensidad de la actividad física.
Los componentes del gasto energético total en el individuo sano y en reposo, no pueden ser extrapolados al paciente en estado crítico porque las condiciones metabólicas son diferentes. Y, además, la fiebre, los medicamentos, la alimentación o el tipo de soporte nutricional y otras variables fisiopatológicas, incrementan o disminuyen el gasto energético.
Gasto energético
Existen diferentes formas de calcular el gasto energético: la calorimetría indirecta y las ecuaciones predictivas, como las de Harris y Benedict, Ireton Jones, Mifflin St. Jeor, el American College of Chest Physicians (ACCP), el Penn State y la regla del pulgar (tabla 1) 70-77.
Tabla 1.
Fórmulas para calcular el gasto energético en el paciente en estado crítico

Tmax: temperatura corporal máxima en grados centígrados en las 24 horas anteriores
Ve: es la respiración por minuto en el momento de la toma de la medida, leída del respirador no del calorímetro.
Adaptado con permiso de: Wooley J, Frankenfield D. Energy. In: Mueller C,
Kovacevich D, Mc Clave, S, Miller S, Scwartz D, editors. Second edition. The A.S.P.E.N. Nutrition Support Core Curriculum.
Silver Spring: American Society for Parenteral and Enteral Nutrition; 2012. p. 22 -35.
Estas ecuaciones se basan en variables antropométricas y algunas de ellas tienen en cuenta otros factores con miras a incluir el estado clínico (fiebre, frecuencia respiratoria, etc.). Por ello, la información exacta de las medidas antropométricas es fundamental.
En las unidades de cuidados intensivos no es fácil conocer los datos antropométricos del paciente y, en general, son los familiares quienes suministran la información. La cual muchas veces no es confiable. El método del NUTRIC Score desarrollado por Heyland 78 y la evaluación global subjetiva específica para la unidad de cuidados intensivos que practica Hoffer 79, que incluye CHOPIN, una nemotecnia por sus siglas en inglés (caquexia, hormone excess, old age, protein-energy malnutrition, inactivity, and neuromuscular disease), la cual tiene como objetivo evaluar en forma rápida y práctica las posibles causas del deterioro de la masa muscular en el paciente en estado crítico.
La talla se puede determinar en forma aproximada con el paciente en decúbito dorsal:
Colocando la rodilla en ángulo de 90 grados y midiendo la longitud desde el talón hasta la parte inferior del muslo o superior de la rodilla para aplicar una fórmula según el sexo 80.
El peso corporal es un factor determinante de la prescripción nutricional, y el peso usual es el más usado. Si no se conoce, se debe emplear el peso actual, asegurándose de que el paciente esté libre de edema, y si lo está, se emplea el peso ideal.
En el caso del paciente en estado de inanición (debilidad y desnutrición extrema) y si antes de su hospitalización mostraba pérdida importante de peso, siempre se debe emplear el peso actual para iniciar el esquema de soporte nutricional.
Existen otras consideraciones para seleccionar el peso al iniciar el soporte metabólico y nutricional:
Cuando los pacientes se encuentran extremadamente delgados por un serio grado de desnutrición, no se puede emplear el peso ideal por cuanto el régimen de soporte, parenteral o entérico, fácilmente los puede llevar al síndrome de realimentación 54,55.
En tal situación, es preferible utilizar el peso actual para los cálculos de la provisión calórica, y aumentar progresivamente el aporte en la medida en que el paciente mejore y vaya recuperando peso. Cobra mucha importancia el registro cuidadoso de los signos vitales por parte de la enfermera, por cuanto la taquicardia y la taquipnea son manifestaciones tempranas del síndrome de realimentación.
Actualmente, muchos de los pacientes que llegan a las unidades de cuidados intensivos se encuentran con sobrepeso o con franca obesidad.
En tal condición se debe emplear el peso ajustado, el cual se determina sumando al peso ideal la diferencia existente entre el peso actual y el peso ideal, y multiplicando la suma por un factor de corrección. Este factor de corrección varía entre 0,25 para obesidad de clase I y II, y 0,5 para la obesidad mórbida 71.
La fórmula es la siguiente:
Peso ajustado (kg):
(peso actual – peso ideal) x 0,25 + peso ideal.
La ecuación de uso más frecuente para el cálculo de la provisión calórica es la de Harris y Benedict (J. Arthur Harris y Francis G. Benedict, Nutrition Laboratory and Station for Experimental Evolution, Carnegie Institution of Washington) publicada en 1918 72; utiliza el peso, la talla, el sexo y la edad como los factores de predicción para el gasto energético en reposo.
Es poco precisa para la estimación calórica del gasto energético en el paciente en estado crítico.
La forma más simple para estimar el gasto energético es la “regla del pulgar”, que es el resultado de multiplicar el peso corporal por 20-25 kcal. ASPEN tiene como guía el empleo de 20-35 kcal/kg en el paciente adulto en estado normal.
Para los pacientes obesos, la recomendación es entre 11-14 kcal/kg por peso actual por día o de 22-25 kcal/kg por peso ideal 61.
El método de referencia para la determinación del gasto energético basal en el paciente en estado crítico, es la calorimetría indirecta.
Las condiciones para practicar una calorimetría indirecta en un paciente ambulatorio son muy diferentes a las del paciente que se encuentra en la unidad de cuidado intensivo o inclusive en el paciente hospitalizado.
En el paciente que respira por sí solo, este se debe encontrar en reposo absoluto, con no menos de cinco horas de ayuno, sin realizar ejercicio físico alguno y evitando el consumo de cafeína o nicotina.
En el paciente hospitalizado realmente se cuantifica, no el gasto energético basal, sino el gasto energético en reposo, puesto que si está recibiendo nutrición entérica continua o nutrición parenteral, estas no se descontinúan y, por lo tanto, el gasto energético que se mide es el gasto energético en reposo. Sin embargo, es necesario mantener la misma fórmula de nutrición y la misma tasa de infusión para una mayor exactitud en la medición.
Cuando se tiene nutrición cíclica entérica o parenteral o cuando la nutrición entérica es por bolos, se deben descontinuar una hora antes si se va a incluir el efecto de termogénesis (gasto energético en reposo) o, cuatro horas antes, si no se incluye.
La calorimetría indirecta calcula el gasto energético basal por medio del intercambio de gases: la producción de dióxido de carbono (VCO2) y el consumo de oxígeno (VO2). Según Schlein 81:
“[…] este concepto se basa en una fuerte correlación entre el consumo de oxígeno y la liberación de dióxido de carbono con la producción de energía. Se estima que aproximadamente el 80 % del gasto energético se debe al consumo celular de oxígeno y el 20 % remanente corresponde a la producción de CO2 […]”.
Los valores tanto de VO2 como de VCO2 se aplican a la ecuación de Weir:
Gasto energético basal = (3,94 x VO2) + (1,11 x VCO2).
La ecuación de Weir completa incluye la determinación del nitrógeno ureico en orina, pero en la práctica esta información se excluye porque corresponde a menos del 4 % del gasto energético 64,70,81.
Aunque sería preferible practicar la calorimetría indirecta en todos los pacientes, no siempre es posible por diferentes razones, tales como la disponibilidad del equipo, los costos, las características propias de la enfermedad y el mismo estado crítico del paciente. Existen factores que pueden alterar la exactitud de la calorimetría indirecta, tales como los que aparecen en la tabla 2 70,77,80.
Además de estimar el gasto energético basal, con la calorimetría indirecta también se calcula el cociente respiratorio, definido como la proporción entre el VCO2 y el VO2.
Tradicionalmente, el cociente respiratorio se ha utilizado para determinar el tipo de sustrato que el paciente utiliza y existen diferentes estados metabólicos que pueden alterarlo. Por ejemplo, un cociente respiratorio <0,71 puede corresponder a la oxidación de etanol y cetonas, pero también, puede ser un reflejo de lipólisis y subalimentación o de cetoacidosis por diabetes mellitus.
Se puede reportar un cociente respiratorio <1,0 a pesar de estar sobrealimentando a un paciente hipermetabólico, por razón de los cambios en la utilización endógena de sustratos generados por mediadores inflamatorios 77.
Es importante tener en cuenta que el intercambio de gases es una medida orgánica integral y que en un momento dado pueden ocurrir simultáneamente en algunos tejidos la oxidación de grasa y en otros la lipogénesis, con un resultado neto de un cociente respiratorio igual a uno (1,0).
Algunas condiciones que pueden generar un cociente respiratorio mayor de uno, son la provisión externa de agentes amortiguadores de pH, como el bicarbonato de sodio, la lipogénesis y la sobrealimentación 77,79.Los niveles fisiológicos del cociente respiratorio oscilan entre 0,67 y 1,3, y cuando aparecen valores fuera de este rango se puede considerar que la calorimetría indirecta es inválida. Los valores de oxidación de los diferentes sustratos se pueden ver en la tabla 3.
Se recomienda no utilizar el cociente respiratorio como un indicador del sustrato que se está administrando, sino como validación de la calorimetría indirecta 77.
Tabla 2.
Alteraciones en la precisión de la calorimetría en la unidad de cuidados intensivos
- Enfermedad respiratoria aguda o crónica
- Heridas abiertas o quemaduras extensas
- Bajo peso
- Obesidad
- Amputación de algún miembro
- Edema periférico
- Ascitis
- Trauma múltiple o lesión neurológica
- Falla orgánica multisistémica
- Posoperatorio de trasplante de órganos
- Sepsis
- Síndrome de respuesta inflamatoria
- Empleo de barbitúricos o paralizantes
Tabla 3.
Cociente respiratorio dependiendo del sustrato energético
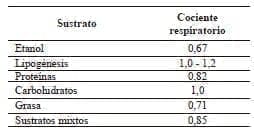
Traducido con permiso de: Wooley J, Frankenfield D. Energy. In: Mueller C, Kovacevich D, Mc Clave, S, Miller S,
Scwartz D, editors. Second edition. The A.S.P.E.N. Nutrition Support Core Curriculum.
Silver Spring: American Society for Parenteral and Enteral Nutrition; 2012. p. 22 -35.
Actualmente, se considera que la composición de macronutrientes en la nutrición poco afecta la producción de CO2, siempre y cuando el aporte calórico total no exceda las necesidades calóricas individuales.
Por lo tanto, tanto en la nutrición entérica como en la parenteral, un régimen con alto contenido de lípidos y bajo en carbohidratos, el cociente respiratorio carecería de validez 61.
La administración de grasa como fuente energética única o principal, tan frecuentemente utilizada en el paciente con enfermedad pulmonar obstructiva crónica y en el proceso de retirar el tubo, no estaría indicada. Por el contrario, puede ser deletérea cuando su principal fuente son los ácidos grasos omega 6, por su efecto proinflamatorio 82-84.
Aunque existen diferentes fórmulas para establecer la necesidad calórica, e idealmente se reconoce la calorimetría indirecta como el método de mayor precisión, es fundamental establecer cuál es el más apropiado para emplear en cada institución y poder repetirlo en el curso de la evolución clínica del paciente. En algunas instituciones se repite la calorimetría indirecta día de por medio 77 y, aunque esto puede parecer exagerado, el mensaje es que la determinación de la necesidad calórica varía dependiendo de las modificaciones de la antropometría del paciente y, principalmente, de su condición clínica; aunque nosotros no lo hacemos de rutina.
Nutrición no es sinónimo de calorías.
El aporte energético es importante para el ahorro proteico, pero proveer más del 50 % de la necesidad calórica mejora muy poco el balance de nitrógeno, especialmente en pacientes en la unidad de cuidados intensivos 15,85-90.
Por lo tanto, el aporte calórico en la primera fase no debe exceder 50 a 70 % del gasto energético, siempre y cuando el aporte proteico se incremente en tal magnitud que compense la leve reducción de la eficiencia en la retención de proteína inducida por el régimen hipocalórico 4,5,16.
Parece ser que la frase que se ajusta en este caso es la de Rice 85: “en el paciente en estado crítico es una de esas situaciones donde menos nutrición es mejor”, entendiendo por nutrición el aporte calórico.
¿Es soporte calórico o soporte metabólico?
Hiperalimentación parenteral
En Colombia, por el año 1980, los pacientes en estado crítico recibían “hiperalimentación parenteral”. En 1972, en la Clínica de Marly de Bogotá, José Félix Patiño administró nutrición parenteral total en un paciente con paresia estomacal postoperatoria, y fue la primera que se administró en Colombia y, tal vez, en Latinoamérica.
Y en el Hospital de La Samaritana, Patiño creó el primer grupo de soporte nutricional, el cual calculaba los requerimientos calóricos multiplicando la necesidad basal por 1,5 a 1,8 para determinar el gasto energético total, que era lo usual en todas las unidades de cuidado intensivo del mundo, según el planteamiento de Blackburn, Long y Wilmore 31,49,91.
El total de calorías diarias oscilaba entre 2.500 y más de 3.000, que se administraban básicamente como dextrosa al 50 % y, ocasionalmente, al 70 %.
El control de las hiperglucemias se hacía con insulina, que se colocaba la mitad dentro de la mezcla de nutrición parenteral y el remanente en un goteo separado. El coma hiperosmolar no cetónico era una de las principales y más temidas complicaciones 92,93.
Además, existían alertas tanto en la historia clínica como en la cabecera de la cama del paciente para descontinuar súbitamente la nutrición parenteral por los riesgos de hipoglucemia.
Por esa época, no había bombas de infusión y como era necesario el control estricto de líquidos, el interno o el estudiante de medicina eran los responsables de vigilar la administración y llevar el registro.
En la pared de la habitación del paciente se colocaban pliegos de papel con cuadros donde cada hora se registraban los líquidos administrados y eliminados, y las cruces de glucosuria como indicador de la necesidad de agregar mayor cantidad de insulina.
La concentración más alta de aminoácidos disponibles era de 8,5 %, no existían oligoelementos, sólo complejo B, y tampoco, emulsiones de lípidos. También, por esa época se creía que las transfusiones de sangre contrarrestaban las deficiencias de los micronutrientes. Para prevenir las deficiencias de ácidos grasos esenciales, se frotaba aceite sobre la piel del paciente 94.
La complicación más frecuente con tan elevadas provisiones calóricas, era la ictericia que, hoy sabemos, era por colestasis y esteatosis hepática.
Sin embargo, para muchos pacientes la nutrición parenteral en tales dosis significó la oportunidad de vivir, particularmente para aquellos con fístulas intestinales.
Como ya se mencionó, en ese momento se creía que el hipermetabolismo era paralelo al hipercatabolismo, por lo cual la excreción de nitrógeno urinario se consideraba como indicador del grado de hipermetabolismo, o sea, que midiendo la excreción del nitrógeno ureico urinario se podía determinar, por correlación y erróneamente, el grado o la magnitud del hipermetabolismo 31,49,91.
Tales aportes calóricos tan elevados representaban una real ‘hiperalimentación’, una sobrealimentación, una provisión calórica muy por encima del gasto metabólico basal o, para efectos prácticos, del gasto metabólico en reposo.
La mayoría de las complicaciones de tal sobrealimentación con nutrición parenteral, se debieron a tan exageradas provisiones calóricas en forma de glucosa.
Otras complicaciones se han detectado en el transcurso del tiempo, como son las relativas al exceso en la administración de lípidos, particularmente de las emulsiones de triglicéridos de cadena larga (segunda generación de emulsiones de lípidos parenterales) en concentraciones al 10 % 95,96.