Evaluación preoperatoria
La selección apropiada de los pacientes es el punto clave para el tratamiento exitoso de los cánceres de recto por medio de resección local 43,44.
Los tumores candidatos a resección local deben ser de menos de 4 cm de diámetro y con menos de 40 % de compromiso de la circunferencia. La distancia del tumor a la línea dentada es importante, ya que determina el tipo de tratamiento. Los tumores con menos de 5 cm desde la línea dentada son candidatos a resección transanal, mientras que aquellos en el recto medio pueden requerir una resección transcoccígea o cirugía microscópica transanal. Los tumores fijos son probablemente transmurales y no serían candidatos para escisión local. En los tumores T2, la sola resección local no es suficiente y se requiere tratamiento adyuvante.
Los criterios de selección para la escisión local se muestran a continuación:
- Tumores de menos de 4 cm de diámetro
- Tumores con menos de 40 % de compromiso de la circunferencia
- Tumores a 10 cm de la línea dentada
- Tumores móviles al examen rectal
- Lesiones T1,T2 en ultrasonografía
- Sin compromiso linfático
Técnica
Escisión transanal. La resección local se ha logrado para la mayoría de los cánceres bajos de recto 45. Después de la inducción anestésica, se coloca al paciente en posición de navaja con los glúteos separados con cintas y se coloca un dilatador anal para poder identificar más fácilmente la lesión. Una vez se ha identificado, se colocan suturas de tracción entre 1 y 2 cm distales a la lesión. La línea de disección se marca sobre la mucosa usando un electrocauterio. Esta línea de disección debe quedar entre 1 y 2 cm de distancia hasta el borde del tumor, en círculo.
Si la lesión no se visualiza fácilmente, se colocan varias suturas de tracción para prolapsar la lesión en el campo quirúrgico. El siguiente paso es utilizar electrocauterio para disecar toda la mucosa y extraer así toda la lesión previamente marcada. Una vez extraída, se debe observar la grasa perirrectal que se encuentra debajo de la lesión para confirmar la extracción completa. Hay que tener cuidado en caso de lesiones anteriores, ya que se puede lesionar la vagina en mujeres o la próstata en hombres. El defecto de la pared rectal se cierra transversalmente con puntos separados de sutura de ácido poliglicólico.
Las complicaciones que se pueden presentar asociadas a estos procedimientos locales, son retención e infecciones urinarias, hemorragia, infección de los espacios perirrectales e isquiorrectales, e impactación fecal. Sin embargo, estas complicaciones son bastante raras y la mortalidad es de 0 % en muchas series 46.
Microcirugía endoscópica transanal. La microcirugía endoscópica transanal fue descrita en 1984 por Gerhard Buess en Tubingen, Alemania 47. La cirugía se realiza con un rectoscopio especial, el cual tiene 4 cm de diámetro y una longitud de 12 a 20 cm. El rectoscopio se introduce con el obturador, el cual se retira y se reemplaza con una tapa hermética. La insuflación del recto se hace manualmente, como en la rectosigmoidoscopia rígida.
Se comienza con una inyección de epinefrina al 1:100.000 en el plano submucoso alrededor de la lesión, para ayudar con la hemostasia (figura 4). El margen de resección se marca a 1 a 1,5 cm alrededor de la lesión usando electrocauterio. La lesión se toma y se procede a la resección sobre toda la pared rectal hasta la grasa perirrectal. Una vez hecho esto, se cierra la lesión de manera transversal con sutura absorbible (figura 5).
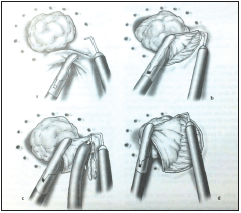 Figura 4. Inicio de la resección a espesor total. (a) Marcación de la línea de incisión. (b) Inicio de la resección. (c) Coagulación de los puntos sangrantes. (d) Progresión de la resección por toda la circunferencia.
Figura 4. Inicio de la resección a espesor total. (a) Marcación de la línea de incisión. (b) Inicio de la resección. (c) Coagulación de los puntos sangrantes. (d) Progresión de la resección por toda la circunferencia.
Reproducida con permiso de: Croce E, Olmi S. Chirurgia del colon, del retto e dell’ano. Milano: Masson Spa; 2004.
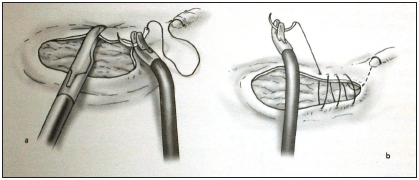 Figura 5. Sutura de la pared rectal
Figura 5. Sutura de la pared rectal
Reproducida con permiso de: Croce E, Olmi S. Chirurgia del colon, del retto e dell’ano. Milano: Masson Spa; 2004.
Aunque la microcirugía endoscópica transanal es una técnica relativamente nueva, se muestra como una técnica ideal para la resección local del cáncer de recto. Hay pocos estudios retrospectivos o prospectivos en que se describan su uso y resultados. En general, dichos escritos muestran supervivencia y recurrencias que varían entre 83 y 100 % y entre 0 y 27 %, respectivamente (tabla 2).
Tabla 2.
Supervivencia a cinco años

Escisión local y tratamiento adyuvante. La recurrencialocal es la mayor causa de mortalidad y morbilidad después de una resección local o una resección radial para el cáncer de recto 48,49. El mayor factor de riesgo para la recurrencia incluye la profundidad de invasión del tumor primario, los márgenes positivos, el grado histológico del tumor y la presencia de compromiso ganglionar. La radioterapia adicional adyuvante o neoadyuvante ha mostrado una tasa baja de recurrencia. Existe evidencia de que la quimiorradioterapia podría tener beneficio en la supervivencia. Una de las mayores dificultades después de una resección local, es la inhabilidad de poder evaluar el compromiso ganglionar. La enfermedad microscópica se puede presentar en el 12 % de lesiones T1, en el 22 % de lesiones T2 y en el 58 % de lesiones T3 o T4 50. La enfermedad microscópica puede llevar a recurrencia local si se deja sin tratamiento. Estos hallazgos han hecho que muchos observadores recomienden la radiación posoperatoria después de una resección local, con el objetivo de erradicar cualquier enfermedad ganglionar, especialmente en tumores agresivos con los factores de riesgo previamente descritos 51,52.
Después de la evaluación exhaustiva del paciente, se puede proceder a una resección local. Los márgenes deben ser de 1 cm 53,54. Lo más importante es obtener un borde libre de tumor independientemente del tamaño. La escisión debe ser de toda la pared, incluso la grasa perirrectal. Las muestras deben evaluarse de acuerdo con su margen alrededor, profundidad de invasión, grado histológico e invasión vascular o linfática. Los pacientes con márgenes positivos deben recibir tratamiento adicional, sea reseccion, quimiorradioterapia o resección radical. Los tumores son categorizados en bajo o grado alto, de acuerdo con su grado de diferenciación y la presencia de invasión linfática o vascular. Los pacientes con lesiones T1 con bajo riesgo, no deben recibir tratamiento adicional, mientras que aquellos con lesiones T1 con alto riesgo y lesiones T2 de bajo riesgo, deben recibir quimiorradioterapia. Los pacientes con lesiones T2 de alto riesgo o lesiones T3, deben someterse a resecciones radicales. En todos los pacientes el seguimiento debe ser estricto para detectar recurrencias locales tempranas.
Los tumores con evidencia de compromiso ganglionar deben considerarse como una enfermedad avanzada y deben tratarse con una cirugía radical, sea con una resección anterior baja de recto o ultrabaja con anastomosis pélvica baja. Las lesiones T1 tienen una baja probabilidad de producir compromiso ganglionar y son excelentes candidatos para escisión local, mientras que lesiones T3 y T4 probablemente deban tratarse con una resección radical. El tratamiento de las lesiones T2 es controvertido. Históricamente, los mejores resultados se han visto con resecciones anteriores bajas para lesiones T2. Sin embargo, la escisión local con quimiorradioterapia posoperatoria ha mostrado resultados similares. Si se ofrece la resección local a estos pacientes, se debe administrar quimiorradioterapia obligatoriamente antes o después de la cirugía 55,56.
Si hay presencia de enfermedad metastásica incurable, se puede hacer resección local para lesiones pequeñas T2 y T3, porque estos pacientes seguramente morirán de su enfermedad metastásica antes que presenten una recurrencia local.
Resección laparoscópica para cáncer de recto
Hoy en día se está utilizando la laparoscopia para el tratamiento de neoplasias intraabdominales, incluyendo la proctectomía 57,58. Parte de este procedimiento se realiza por laparoscopia y la cirugía se completa en forma tradicional; en particular, la exploración y la movilización del colon y del recto se hacen por vía laparoscópica, y la ligadura del pedículo vascular se hace con clips laparos cópicos o con equipos de ligadura por radiofrecuencia. La disección pélvica se puede llevar a cabo laparoscópicamente con una buena visualización; sin embargo, la anastomosis aún se practica extracorpóreamente.
La principal pregunta sobre la cirugía laparoscópica para la proctectomia es si provee el mismo tejido resecado que con la técnica tradicional o si existen cambios en la biología del cáncer que afecten la supervivencia o la recurrencia. Con respecto a esto, se ha reportado recurrencia sobre la herida de los trocares en pacientes sometidos a cirugía laparoscópica. En estudios de asignación aleatoria comparando la cirugía abierta con la laparoscópica, no se ha demostrado estadísticamente diferencia en la supervivencia. Según estudios recientes llevados a cabo en Londres, en la resección anterior de recto asistida por laparoscopia se han demostrado márgenes circunferenciales positivos, al compararla con la técnica abierta. Por estas razones, hay que seguir estudiando esta técnica para estandarizarla en el futuro.
Se ha reportado un tiempo promedio de 180 a 220 minutos para practicar la resección laparoscópica. En una revisión reciente de Cochrane se confirmó que la cirugía laparoscópica está asociada a menos pérdida sanguínea. En el estudio CLASICC, el tiempo de estancia hospitalaria disminuyó de 13 a 11 días. Igualmente, no hubo mortalidad en los primeros 30 días, se presentaron menos infecciones de la herida quirúrgica, 1 % frente a 14 % en cirugía abierta, hubo morbilidad en 21 % frente a 28 %, respectivamente, y menor estancia hospitalaria para el grupo de laparoscopia; también, el regreso a una dieta normal fue mucho más rápida, hubo menor dolor, menos necesidad de narcóticos y mejor respuesta inmunológica.
Proctectomía robótica
Operar dentro de los confines de la pelvis para practicar una buena escisión total del mesorecto es técnicamente demandante con la laparoscopia; los sistemas robóticos son útiles cuando el campo operatorio es pequeño y se requiere una disección completa y exitosa. Se tienen reportes recientes sobre la facilidad de la cirugía robótica para el tratamiento del cáncer de recto. La potencial ventaja consiste en obtener un ángulo cómodo para la entrada de los instrumentos en la pelvis, lo cual provee al cirujano de una visión en un ángulo como si estuviera sentado en el tórax del paciente. Se reporta igual éxito que con la proctectomía laparoscópica. La proctectomía robótica ofrece mejor visión de los nervios, disminuye la tasa de disfunciones sexuales y vesicales, e igualmente es más ergonómica para el cirujano; sin embargo, es una técnica nueva en desarrollo que requiere estudios más rigurosos antes de que su uso pueda ser estandarizado para el tratamiento del cáncer de recto 59.
