La mortalidad global fue 21,5% y la mortalidad para PAS necrotizante infectada 28,9%. Los factores asociados con muerte en forma significativa, luego del análisis univariado, fueron: SDRA (OR: 5,98, IC 95% 1,3-31, p<0,02), shock (OR 24, 2,8-671, p=0,002) y APACHE II>20 (OR 16,2, 3,2-37,9, p<0,0007); sin embargo, no se encontró asociación con presencia de fístulas, infección, necrosis, uso de antibióticos y ser sometidos a cirugía. La mortalidad en los pacientes que al momento de su admisión a la UCI presentaban shock fue de 41,18%, mientras que en aquellos que permanecieron hemodinámicamente estables sólo se presentó una muerte (2,94%).
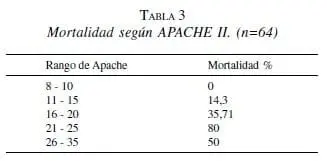
En los pacientes que presentaron SDRA la tasa de mortalidad fue 37,93% y en aquellos sin esta complicación 10,26%. El análisis de regresión logística mostró que la presencia de shock y el APACHE II > 20 fueron predictores de muerte (OR: 31,25 (2,7-345) y 1,27 (1,07 – 1,51) respectivamente, p<0,05). (tabla 3).
Discusión
La mortalidad en esta cohorte retrospectiva en pacientes con pancreatitis aguda severa se mantiene baja con respecto a los parámetros considerados en la literatura: 21,5%. Si bien el curso de la PA por lo regular no es predecible, la severidad en los estadios iniciales por lo general está acompañada de necrosis pancreática. Se ha encontrado que la severidad no siempre se correlaciona con la extensión de la necrosis (6-7); sin embargo, en nuestra experiencia no se alcanza a observar esta asociación por el tamaño de la muestra del estudio. Tal como se observa en esta serie, la necrosis pancreática no fue un predictor independiente de severidad ni de mortalidad. La PAS, según el sistema de clasificación de Atlanta se define con base en las manifestaciones clínicas, puntaje de Ranson (8) > 3 ó Apache II (9) > 8 y evidencia de disfunción del órgano o patología intrapancreática (necrosis primaria, menos común el edema intersticial).
La utilidad del APACHE II en PA se ha estudiado prospectivamente en comparación con la escala de Ranson y los criterios de Glasglow. El APACHE II mayor de 7 durante la admisión del paciente predice el 68% de los ataques severos, en comparación con el 34% del diagnóstico clínico. A las 48 horas el APACHE II fue superior a la escala de Ranson o de Glasgow para predecir los ataques severos. Este ofrece la habilidad de determinar la severidad al ingreso, con la estratificación potencial para ingresar a cuidado intensivo (10). Además el recálculo diario de los puntajes permite mostrar que la severidad del ataque corresponde a un aumento del puntaje, mientras que los ataques moderados tienden a disminuir los puntajes (11). Recientemente se propuso el APACHE –O con la adición de obesidad, un probable factor de riesgo para severidad (12). El APACHE > 8 se relaciona con 20% más del riesgo de PAS con una sensibilidad de 68%, especificidad de 67% y VPP 40%, y un APACHE >14 se relaciona con una mortalidad > 15%. En este estudio el APACHE > 20 fue predictor independiente de muerte. El curso de la PAS puede incluir una fase temprana tóxica de inestabilidad y una fase tardía dominada por las complicaciones sépticas.
La infección del páncreas se ha reportado en 40 a 70% de los pacientes con pancreatitis necrotizante (13) y es la principal complicación en el tratamiento de la enfermedad; además la sepsis que sigue y su relación con la falla de múltiples órganos son las responsables que la mortalidad se eleve hasta el 50% (14).
El uso de los antibióticos está fundamentado en el pensamiento racional que la reducción de la infección disminuiría la mortalidad y la morbilidad tardía. Sin embargo, es controvertido el beneficio de los antibióticos profilácticos. Las recomendaciones del Consenso Internacional de abril de 200415 se dirigen al no uso de antibióticos profilácticos con nivel de evidencia 2b, grado B.
La necrosis pancreática usualmente se infecta en un estadio tardío de la enfermedad y esto depende de la extensión de la necrosis intra y extrapancreática (16). Beger y cols. encontraron tasas de contaminación de 24% dentro de la primera semana en pacientes con PAS que requirieron manejo quirúrgico, incrementándose a 46 y 71% en la segunda y en la tercera semana; en conjunto la tasa de infección en ese estudio fue de 39% (17). Similares resultados fueron reportados por Gerzof y cols. (18) y Bassi y cols. (19); sin embargo, la frecuencia de infección pancreática fue más alta con tasas de 60 y 63% respectivamente. En esta serie se observaron 52 casos con necrosis pancreática (81,3%) de los cuales 38 tenían necrosis infectada (71,7%) manteniéndose una mortalidad baja: once pacientes (28,9%). Absceso pancreático se presentó en siete casos (10,9%) con mortalidad de 29%. De los catorce casos con necrosis estéril sólo murió uno (7,1%).
La permanencia en ventilación mecánica de los pacientes con necrosis infectada fue de 13,9 días en promedio, mientras que en los pacientes con PAS sin necrosis fue de 8,8. Igualmente los días de hospitalización en la UCI fueron en promedio 16,12 días y en los pacientes sin necrosis de 11,7. La influencia de la infección bacteriana en la morbilidad y mortalidad en la PAS ha sido analizada en pacientes tratados quirúrgicamente con necrosis pancreática infectada y en pacientes con necrosis estéril sometidos a cirugía.
La morbilidad preoperatoria en el grupo con necrosis pancreática infectada fue significativamente más alta que en aquellos con necrosis estéril, con respecto a insuficiencia pulmonar (56 frente a 72%), renal (28 frente a 45%) y cardiocirculatorio (13 frente a 30%). La tasa de mortalidad en el grupo infectado fue 20% y en el grupo estéril 11% (17). Hay coincidencia en que la principal causa de muerte es la infección, especialmente necrosis pancreática infectada. La mortalidad en individuos sin necrosis es prácticamente 0%, en pacientes con necrosis estéril 0 – 11%, mientras que con necrosis infectada alcanza 40% (17-18). En este estudio se encontró una mortalidad global del 21,5% y la mortalidad para PAS necrotizante infectada de 28,9%. En resumen, la necrosis pancreática infectada es un significante factor pronóstico en PAS.
En el curso natural de la PAS los cultivos de las necrosis infectadas son monomicrobiales en 60 – 87% de los casos; en estos estudios se confirmó flora polimicrobial en el 13 – 40% de casos (19-21). Usualmente existe preponderancia de bacterias aerobias gramnegativas las cuales sugieren un origen entérico, pero también se pueden encontrar bacterias grampositivas anaerobios y ocasionalmente hongos. Luiten y cols. estudiaron prospectivamente la diferencia entre grampositivos y gramnegativos en pacientes con necrosis pancreática infectada. Encontraron que la infección por gramnegativos fue ligada de manera significativa a una mortalidad más alta que la infección por grampositivos (22). En el estudio se encontró más asociación con gérmenes grampositivos (tabla 2).
La infección de la necrosis pancreática inicialmente estéril se desarrolla en períodos tardíos de la enfermedad, así que un tratamiento antibiótico podría reducir la mortalidad tardía. Tres estudios acerca del uso de antibióticos profilácticos endovenosos en el tratamiento de pacientes no seleccionados con PAS fallaron en mostrar algún efecto favorable en la morbilidad y mortalidad (23-24). Sin embargo, la mayoría de los pacientes en esos estudios tenían pancreatitis moderadas con bajo riesgo de infección. La evaluación de la concentración de varios tipos de antibióticos mostró que las quinolonas y los carbapenem son sustancias con actividad bactericida contra los organismos más frecuentes presentes en la infección del páncreas que alcanzan altas concentraciones en el tejido de la glándula (25). Por el contrario, los aminoglucósidos son incapaces de penetrar el tejido pancreático para alcanzar concentraciones bactericidas. El factor de eficacia de los antibióticos incluye el tipo y frecuencia de bacteria encontrada en la necrosis infectada del páncreas, concentración del antibiótico en el tejido y el porcentaje de inhibición bacteriana según la MIC. Consecuentemente el antibiótico ideal tiene un factor de 1. El imipenem tiene un factor de eficacia excelente (0,98) comparado con los aminoglucósidos (0,13). El tratamiento profiláctico con imipenem usado en los estudios clínicos controlados por Pederzoli y cols. reduce la incidencia de sepsis de origen pancreático (12,2 frente a 30,3%) y no pancreático (14,6 frente a 48,5%) en pacientes con PAS. Sin embargo, la tasa de falla orgánica múltiple y la necesidad de cirugía no se modifican (26). Infortunadamente todos los estudios prospectivos que analizan la profilaxis con antibióticos en PAS han usado poblaciones pequeñas. Golub y cols. desarrollaron un meta-análisis de todos los estudios prospectivos para evaluar el rol terapéutico de los antibióticos en PA (27). En éste se encontró que la mortalidad fue significativamente reducida en el subgrupo de pacientes con PAS que recibieron antibióticos de amplio espectro.
En conclusión no hay suficientes estudios controlados, aleatorizados que demuestren definitivamente que los antibióticos profilácticos tienen alguna función en la PAS (28). Sin embargo, existe evidencia que podría justificar la administración temprana de antibióticos profi lácticos que se concentren en el páncreas (imipenem) en pacientes con PAS (29, 30). En esta cohorte se administraron antibióticos a los pacientes con gérmenes cultivados en el 62,5% de los casos. Los antibióticos profilácticos se usaron en doce pacientes (18,5%), y nueve de ellos murieron (75%).
Con respecto al manejo quirúrgico aún existen varios puntos en controversia: cuándo operar a los pacientes con necrosis estéril, se debe usar desbridamiento con cierre inmediato y drenes de evacuación o desbridamiento con empaquetamiento y abdomen abierto para lavados programados y a demanda. Los resultados de la terapia convencional, en la cual la necrosis es desbridada y en paciente cerrado dejando los drenajes peripancreáticos fueron descritos por Altemeier y Alexander (31) desde 1963. Con esta técnica la tasa de reoperación es del 30 – 40%, con mortalidad cerca al 40%. En la técnica de tratamiento de abdomen abierto, en la cual se lleva a desbridamiento seguido por lavados repetidos cada 24 a 48 horas en la UCI ha mostrado una disminución de la mortalidad comparada con el manejo convencional, aunque no está completamente demostrado (32-37).
Una de las desventajas de esta terapia es la relativa alta formación de fístulas y de sangrado. Estas complicaciones se pueden disminuir con el uso de gasas no adherentes entre las compresas y la superficie del tejido. Esta técnica ha bajado la mortalidad hasta 20% en series como la de Emory University School of Medicine, Atlanta, Georgia (38). El tiempo requerido para que el material necrótico se delimite es incierto; algunos autores reportan que tarda alrededor de una semana (39-41). En el consenso de abril 2004 se recomienda necrosectomía cuando se requiera preferiblemente entre la segunda y tercera semanas (15). La decisión de operar a los pacientes con necrosis estériles es difícil. Esta conducta podría beneficiar a aquellos que no mejoran con el manejo en la UCI. Rau y cols. (42) reportaron una serie de 172 pacientes con necrosis estéril; 105 fueron sometidos a necrosectomía con base en la falla en la respuesta al manejo en la UCI después de la primera semana. Concluyeron que más pacientes con necrosis pancreática estéril responden al manejo en la UCI. El incremento de complicaciones como falla orgánica aun en la UCI fueron las más claras indicaciones para exploración.
Uomo y cols. (43) reportaron una serie de 199 pacientes con necrosis pancreática; 169 de éstos tenían necrosis estéril, 23 (14%) fueron operados. La tasa de mortalidad fue más baja en el grupo de pacientes no operados (9,5 frente a 23,5%).
En esta serie se sometieron a cirugía 53 pacientes (82,81%). El promedio de tiempo en que fueron intervenidos fue 8,1 días, con rango entre 1 – 26 días. La principal causa fue la necrosis infectada en 38 casos (73,1%).
La mortalidad en este grupo fue de 28,9% (once pacientes); seis casos de necrosis estéril (9%) se manejaron médicamente y ninguno murió. Ocho pacientes (12,5%) con necrosis estéril fueron llevados a cirugía por falta de respuesta al manejo, de éstos sólo falleció uno (12,5%).
La incidencia de fístulas en pacientes quirúrgicos fue de 32,8% (21 casos), fístulas pancreáticas (en 18 casos), dos de colon (uno de ellos murió, el otro sobrevivió con colostomía) y una de estómago (que falleció). En todos los sobrevivientes y que presentaron fístulas pancreáticas, éstas cerraron espontáneamente en un período máximo de seis meses.
El soporte nutricional en los pacientes con pancreatitis es crítico y complejo debido a varios factores que promueven el deterioro nutricional. Existe evidencia de que hay varios beneficios potenciales con el uso de la nutrición enteral en los pacientes con PAS en comparación con la nutrición parenteral como: disminución en la translocación bacteriana, mejoría de la circulación esplácnica y preservación de la inmunidad de la superficie de la mucosa intestinal. Estudios en voluntarios sanos confirman que las secreciones pancreáticas son estimuladas por la alimentación directamente en el estómago, duodeno a yeyuno (44). Los efectos en la secreción pancreática son menores cuando la nutrición ocurre significativamente después del ligamento de Treitz (45, 46). Las recomendaciones actuales sugieren que se debe preferir la nutrición enteral en comparación con la nutrición parenteral en pacientes con PAS. Nivel 1ª, recomendación grado A. La nutrición parenteral debe ser usada cuando los accesos para nutrición enteral no se hayan logrado después de cinco a siete días del inicio de los síntomas (15). En esta serie 24 pacientes recibieron nutrición enteral, 22 nutrición parenteral y 34 los dos métodos de nutrición consecutivos.
Aun reconociendo las limitantes de los estudios observacionales tipo cohorte retrospectiva, como son los sesgos en la selección y ante todo de la calidad de la información recolectada, este estudio muestra muy buenos resultados en cuanto a una baja mortalidad global del 21,5 y 28,9% en PA infectada, en pacientes con condición severa y médico-quirúrgica compleja, reproduciendo los resultados de otras series. La ventaja de este diseño es que incluye pacientes del mundo real, que usualmente no se incluyen en los estudios controlados y que se tratan con un protocolo riguroso en una UCI de nivel IV, de más de diez años de experiencia.
Conclusiones
La presencia de shock y el APACHE II fueron predictores independientes de muerte. La mortalidad global y la mortalidad por PAS necrotizante infectada fueron bajas: 21,5 y 28,9% respectivamente.
Infected Necrotizing Pancreatitis: Results in a Low Mortality Cohort
Abstract
Objective: To analyze prognostic factors in patients with severe acute pancreatitis.
Methods: Retrospective cohort of 64 consecutive patients with the diagnosis of severe acute pancreatitis defined as APACHE II > 8 or Ranson > 3 seen at Fundación Valle del Lili, Cali, Colombia, in the period 1995-2004. Demographic, clinical and surgical data were analyzed.
Results: In the series of 64 patients, the most common etiology was cholelithiasis (51.6%). The median APACHE II score was 13. Average stay in the ICU was 16 ± 14.8 days (rank 1-63), total hospital stay was 28.1 ± 19.8 days (1-84); 82.8 % of patients were operated on, with an average number of repeat laparotomies of 4.2 ± 4.4 (1-18); 81.3% developed necrosis, infected or abscess = 84.9%, and sterile = 26.4%, with 81.3% of patients receiving antibiotics during 14 days. Positive cultures from abdomen were found in 60.9%, with Enterococcus fecalis and Staphylococcus aureus being the most commonly encountered organisms. The global mortality rate was 21.5% and the mortality rate in severe acute infected necrotizing pancreatitis was 28.9%. Factors associated with mortality were: ARDS (5.98%, IC 95% 1.3-31, p<0.02), shock (24, 2.8-671, p=0.002), and APACHE II > 20 (16.2, 3.2-37.9, p<0.0007), all of them statistically significant. No association was found with the presence of fistulae, infection, necrosis, use of antibiotics, or surgical interventions. The logistic regression analysis demonstrated that shock and APACHE II > 20 were predictors of death (OR: 31.25, 2.7-345, and OR: 1,27, 1.07-1.51, respectively, p <0.05).
Conclusion: The presence of shock and the APACHE II score appeared as independent predictive factors of death. Global mortality and mortality of severe acute infected necrotizing pancreatitis were low: 21.5% and 28.9% respectively.
Key words: acute necrotizing pancreatitis, prognosis, APACHE, mortality
Referencias
1. STEINBERG W, TENNER S. Acute pancreatitis. N Engl J Med 1994; 330: 1198-1210.
2. COMPANY L, SÁEZ J, MARTÍNEZ J, APARICIO JR, LAVEDA R, GRINO P, PÉREZ-MATEO M. Factors predicting mortality in severe acute pancreatitis. Pancreatology 2003; 3: 144-148.
3. WEBER CK, ADLER G. Acute pancreatitis. Current Opinion in Gastroenterology 2001; 17:426–429.
4. BANK S, SINGH P, HALONEN KI, LEPPANIEMI AK. Severe acute pancreatitis: prognostic factors in 270 consecutive patients. Pancreas 2000; 21: 266-271.
5. POORAN N, STARK B. Evaluation of factors that have reduced mortality from acute pancreatitis over the past 20 years. J Clin Gastroenterol 2002; 35: 50-60.
6. TENNER S, SICA G, HUGHES M, et al. Relationship of necrosis to organ failure in severe acute pancreatitis. Gastroenterology. 1997; 113: 899-903.
7. LANKISCH PG, PFLICHTHOFER D, LEHNICK D. No strict correlation between necrosis and organ failure in acute pancreatitis. Pancreas 2000; 20:319–322.
8. RANSON JHC, RIFKIND KM, ROSES DF, et al. Prognostic signs and the role of operative management in acute pancreatitis. Surg Gynaecol Obstet 1974; 139: 69-81.
9. KNAUS WA, DRAPER EA, WAGNER DP, et al. APACHE II: a severity of disease classification system. Crit Care Med 1985;13:818– 29.
10. STUART LT, KRIS VK. Clinical reviews pancreatic and biliary disease prognostic factors in acute pancreatitis. J Clin Gastroenterol 2002; 34: 167-176.
11. WILSON C, HEATH DI, IMRIE CW. Prediction of outcome in acute pancreatitist: a comparative study of APACHE II, clinical assessment and multiple factor scoring systems. Br J Surg 1990; 77: 1260-1264.
12. TOH SKC, WALTERS J, JOHNSON CD. APACHE-O: a new predictor of severity in acute pancreatitis [abstract]. Gut 1996; 38 (supp 1): A35.
13. BÜCHLER MW, MALFERTHEINER P. Review the role of infection in acute pancreatitis. Gut 1999; 45: 311-316.
14. RATTNER DW, LEGERMATE DA, LEE MJ, et al. Early surgical debridement of symptomatic pancreatic necrosis is beneficial irrespective of infection. Am J Surg 1992; 163: 105-109.
15. NATHENS AB, CURTIS JR, et al. Management of the critically ill patient with severe acute pancreatitis. Crit Care Med 2004; 32: 2524-2536.
16. BANKS PA. Infected necrosis: morbidity and therapeutic consequences. Hepatogastroenterology 1991; 38: 116-119.
17. BRADLEY E, ALLEN K. A prospective longitudinal study of observation versus surgical intervention in the management of necrotizing pancreatitis. Am J Surg 1991; 161: 19-25.
18. WIDDISON A, KARANJIA N. Pancreatic infection complicating acute pancreatitis. Br J Surg 1993; 80: 148-154.
19. BEGER HG, BITTNER R, BLOCK S, et al. Bacterial contamination of pancreatic necrosis. A prospective clinical study. Gastroenterology 1986; 91: 433-438.
20. GERZOF SG, BANKS PA, ROBBINS AH, et al. Early diagnosis of pancreatic infection by computed tomography-guided aspiration. Gastroenterology 1987; 93: 1315-1320.
21. BASSI C, FALCONI M, GIRELLI R, et al. Microbiological findings in severe acute pancreatitis. Surg Res Commun 1989; 5: 1-4.
22. LUITEN EJ, HOP WC, LANGE JF, et al. Differential prognosis of Gram-negative versus Gram-positive infected and sterile pancreatic necrosis: results of a randomized trial in patients with severe acute pancreatitis treated with adjuvant selective decontamination. Clin Infect Dis 1997; 25: 811-816.
23. CRAIG RM, DORDAL E, MYLES L. The use of ampicillin in acute pancreatitis [letter]. Ann Intern Med 1975; 83: 831-832.
24. FINCH WT, SAWYERS JL, SCHENKER S. A prospective study to determine the efficacy of antibiotics in acute pancreatitis. Ann Surg 1976; 183: 667- 71.
25. BÜCHLER M, MALFERTHEINER P, FRIESS H, et al. Human pancreatic tissue concentration of bactericidal antibiotics. Gastroenterology 1992; 103: 1902.
26. PEDERZOLI P, BASSI C, VESENTINI S, et al. A randomized multicenter clinical trial of antibiotic prophylaxis of septic complications in acute necrotizing pancreatitis with imipenem. Surg Gynecol Obstet 1993; 176: 480-483.
27. GOLUB R, SIDDIQI F, POHL D. Role of antibiotics in acute pancreatitis: a metaanalysis. J Gastrointest Surg 1998; 2: 496- 503.
28. BARIE PS. A critical review of antibiotic prophylaxis in severe acute pancreatitis. Am J Surg 1996; 172: 38S-43S.
29. POWELL JJ, MILES R, SIRIWARDENA AK. Antibiotic prophylaxis in the initial management of severe acute pancreatitis. Br J Surg 1998; 85: 582-587.
30. ISENMANN R, RUNZI M, KRON M, et al. Prophylactic antibiotic treatment in patients with predicted severe acute pancreatitis: a placebo-controlled, double-blind trial. Gastroenterology 2004; 126: 997-1004.
31. ALTEMEIER WA, ALEXANDER JW. Pancreatic abscess: an unresolved surgical problem. Arch Surg 1963; 87: 80-85.
32. NIETO JA. Fisiopatología de la pancreatitis aguda. Rev Colomb Cir 1992; 7: 101-109.
33. NIETO JA, Pancreatitis aguda. Cirugía y Hospital 1992; 1: 1-37.
34. ORDÓÑEZ CA. Nuevas estrategias en el manejo de la pancreatitis aguda. Médicas UIS.1997; 11 (4): 187-194.
35. PATIÑO JF. Pancreatitis aguda. En: Lecciones de Cirugía, 1a. ed. Bogotá: Editorial Médica Panamericana, 2000; 681-706.
36. ORDÓÑEZ CA, SARMIENTO G. Pancreatitis aguda severa. En: Cuidado Intensivo y Trauma. 1a. ed. Bogotá. Editorial Distribuna, 2002; 769-782.
37. ORDÓÑEZ CA. Pancreatitis aguda grave. En Situaciones críticas en medicina de urgencias. 1a. ed. Cali. Publicaciones Salamandra, 2005; 447-458.
38. MIER J, LEÓN EJ, CASTILLO A, et al. Early versus late necrosectomy in severe nectorizing pancreatitis. Am J Surg 1995; 173: 71-75.
39. BRANUM G, GALLOWAY J. Pancreatic necrosis: results of necrosectomy, packing, and ultimate closure over drains. Ann Surg 1998; 227: 870-877.
40. STEINBERG WM, BARKIN J, BRADLEY EL, III, et al. Controversies in clinical pancreatology. Pancreas 1996; 13: 219-225.
41. RATTNER DW, LEGERMATE DA, LEE MJ, et al. Early surgical debridement of symptomatic pancreatic necrosis is beneficial irrespective of infection. Am J Surg 1992; 163: 105-110.
42. RAU B, PRALLE U, UHL W, et al. Management of sterile necrosis in instances of severe acute pancreatitis. J Am Coll Surg 1995; 181: 279-288.
43. UOMO G, VISCONTI M, MANES G, et al. Nonsurgical treatment of acute necrotizing pancreatitis. Pancreas 1996; 12: 142-148.
44. O’KEEFE SJ, LEE RB, ANDERSON FP, et al. Physiological effects of enteral and parenteral feeding on pancreaticobiliary secretion in humans. Am J Physiol Gastrointest Liver Physiol 2003; 284:G27–G36
45. VU MK, VAN DER VEEK PP, FROLICH M, et al. Does jejunal feeding activate exocrine pancreatic secretion? Eur J Clin Invest 1999; 29: 1053-1059.
46. MARIK PE, ZALOGA GP. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ 2004; 328: 1407.


