Reporte de caso
Antrectomía Laparoscópica: Una Opción Terapéutica
Jesús Eduardo Díaz R., MD*, Carlos Felipe Chaux M., MD*, Juan Fernando Medina R. MD**
Palabras clave: ectasia vascular antral gástrica, ” estomago de sandía “, laparoscopia, hemorragia gastrointestinal, gastrectomía.
Resumen
La ectasia vascular antral gástrica es una enfermedad poco frecuente, habitualmente pasa desapercibida, pero actúa como un factor determinante de la aparición de episodios de sangrado digestivo alto de severidad variable. Su fisiopatología determina características propias por lo cual comúnmente se conoce como “estómago de sandía” y presenta ciertas asociaciones con otras enfermedades patológicas cuya relación no está bien determinada.
A continuación se presenta un caso clínico que permitió la respectiva revisión de la literatura y el manejo mediante antrectomía por vía laparoscópica.
Presentación del Caso
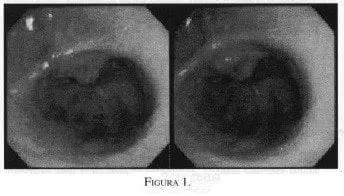
Mujer de 48 años de edad con historia de epigastralgia de dos años de evolución. En los últimos seis meses consultó por melenas, en una ocasión con diagnóstico de hemorragia de vías digestivas altas. Se realizó endoscopia, informada como “gastritis eritematosa antral” que fue manejada con omeprazol y antibióticos para la erradicación del Helicobacter pylori, sin obtener mejoría. Al cuadro se agregó un síndrome anémico que ameritó hemo-transfusión en dos ocasiones en los últimos seis meses. Se realizó un nuevo estudio, en el que se hallaron lesiones que presentaban pliegues longitudinales que cruzaban el antro y terminaban convergiendo en el píloro, cada uno contenía una columna enrollada y visible de vasos, que además estaban separados por mucosa de aspecto atrófico. La imagen recuerda las rayas de una sandía (“estomago de sandía”). Se hizo el diagnóstico de ectasia vascular antral. (Figura 1) y ante lo típico de la presentación endoscópica no se realizó biopsia. Entre las opciones terapéuticas con que contamos en nuestro medio, en junta quirúrgica se decidió realizar una antrectomía por vía laparoscópica. El informe histopatológico de la pieza quirúrgica (antro) corroboró el diagnóstico de ectasia vascular antral. Seis meses después del procedimiento la paciente es catalogada como Visick-I.
Revisión de la Literatura
Definición
La OMS la define como: “Prominencia anormal de los capilares de la mucosa antral gástrica, que se acompaña de adelgazamiento de la misma mucosa, con presencia de bandas rojas brillantes y atrofia gástrica en el antro del estómago, que se irradia longitudinalmente entre el píloro y este último, recordando la visión por endoscopio a las bandas de la superficie de una sandía, lo cual corresponde a los hallazgos típicos de la ectasia vascular del antro gástrico” .
Epidemiología
Es más común en las mujeres de mayor edad, con una relacion 9:1 respecto a los hombres, y con una edad media de presentación de 69,1 años con un rango de 40-90. Aunque se desconoce la verdadera incidencia, se estima que esta patología es responsable entre 1,2 y el 8% del sangrado de vías digestivas altas, y en casos de insuficiencia renal crónica alcanza hasta un 24%. Existen muy pocos estudios prospectivos dirigidos a conocer la prevalencia o incidencia de esta patología. El hecho de no reconocer a la ectasia gástrica como causa de sangrado gastrointestinal o confundirla con otras enfermedades (gastritis hemorrágica aguda, carcinoma gástrico, etc.) se suma a la dificultad para identificar la verdadera frecuencia de su presentación (20).
Histología
Histológicamente esta lesión cursa con dilatación y trombosis de capilares y venas con hiperplasia fibromuscular reactiva dentro de la lámina propia. La proliferación de celulas fusiformes en la mucosa es característica del “estómago en sandía”, tiene como base una mucosa antral con signos de atrofia (lo cual la distingue de la gastritis aguda y de la gastritis atrófica).
Etiopatogenia
La etiología de esta condición permanece desconocida y se considera una malformación arteriovenosa; actualmente se especula que la formación del “estómago de sandía” es el resultado de episodios recurrentes de prolapso de la mucosa antral. La hipercontractilidad antral prolapsa la mucosa fijada laxamente a través del píloro, con posterior traumatismo e isquemia de la mucosa.
La repetitividad del cuadro lleva a elongacion y ectasia de los vasos mucosos antrales, así como a proliferacion reactiva de las celulas fusiformes (20).
Asociaciones Patológicas
Se han informado varias asociaciones con esta enfermedad: aclorhidria, hipergastrinemia, desórdenes del tejido conjuntivo, trastornos autoinmunes, poliesplenia, estenosis aórtica, insuficiencia renal crónica, enfermedad de Von Willebrand, EPOC y cirrosis, sin tener bien dilucidada su relación. En diversas series los desórdenes asociados más comunes son el fenómeno de Raynaud (31%) y la esclerodactilia (18%), pero tambien se reconocen otras condiciones autoimmunes habitualmente relacionadas como hipotiroidismo, cirrosis biliar primaria, diabetes mellitus y enfermedad hepática autoinmune (1-6, 21-25). Está bien documentada su presencia ante escleroderma difusa progresiva y existen múltiples casos reportados. Las asociaciones patológicas permiten confirmar que el “estómago de sandía” no se relaciona con cirrosis, mientras que la ectasia en “panal de abejas” lo hace hasta en un 50%; estos últimos son los que presentaban enfermedad más grave, dada su mayor tendencia al sangrado. Se ha identificado la coexistencia de ectasias colónicas hasta en un 22% de las ectasias vasculares antrales gástricas, y ambas son morfoló-gicamente similares. Aunque el cuadro se origina por malformaciones arteriovenosas, éstas no son reconocidas al realizar angiografías selectivas o durante procedimientos quirúrgicos, ya que las bandas distintivas se aprecian mucho mejor durante la endoscopia porque se da un mejor flujo sanguíneo gástrico al realizar este procedimiento, que cuando el paciente se somete a anestesia.
Presentación Clínica
La mayoría de los pacientes con ectasia vascular antral cursa habitualmente con pérdida crónica y oculta de sangre o con hemorragia aguda recurrente que desencadena anemia severa ferropénica (20 – 25). Las presentaciones clínicas más comúnes son (3):
• Anemia por deficiencia férrica 88%,
• Heces guayaco positivo 42%,
• Melenas 15%,
Hematoquezia 1%.
El sangrado gastrointestinal oculto es dependiente de transfusiones, que en promedio alcanza a requerir diez unidades en un período de doce meses (4,5). Aunque la pérdida de sangre raramente excede los 250 mg/día, el reemplazo férrico por sí solo, no puede mantener los niveles de hemoglobina a nivel normal (2). Hasta un 50% de los pacientes presenta sangrados recurrentes, los cuales son dados por:
• No obliteración de las ectasias.
• Presencia de múltiples ectasias.
• Ectasias no diagnosticadas en otras áreas del tubo digestivo.
• Aparición de nuevas ectasias
Diagnóstico
El diagnóstico se basa en los hallazgos endoscópicos, con tres formas de presentación: la forma difusa de la ectasia vascular gástrica con aspecto en “panal de abejas”, cuya imagen está dada por la coalescencia de las mismas ectasias que forman una gran lesión de color rojo; una segunda variedad o tipo “clásico”, donde las lesiones presentan pliegues longitudinales que cruzan el antro y terminan convergiendo en el píloro; cada uno contiene una columna enrollada y visible de vasos; además están separados por mucosa de aspecto atrófico, cuya imagen recuerda las rayas de una sandía. Finalmente, una tercera variedad consistente en una lesión grande, aplanada, tipo hongo que produce un area bien delimitada, aislada, ligeramente elevada y constituida por un ramillete de vasos ectásicos.
La importancia de reconocer las distintas formas de presentación radica en que estas mismas sirven de predictores de respuesta al tratamiento endoscópico, puesto que en el “estomago de sandía” se reconoce una satisfactoria respuesta al láser de neodimio: itrio-aluminio-granate (Nd:YAG); las ectasias de aspecto difuso (en “panal de abejas”) responden menos al tratamiento láser. Las ectasias antrales habitualmente son múltiples y presentan un tamaño promedio de 1 a 5 mm de diámetro, y cuando se ubican en el cuerpo gástrico, lo hacen preferencialmente sobre la pared posterior o a lo largo de la curvatura mayor.
Aunque estas lesiones se confinan predominantemente en el antro, 27% de los pacientes tiene compromiso proximal gástrico con presencia de hernia diafragmática concomitante (1).
Sin embargo, es importante hacer énfasis, en que estas lesiones podrían ser erróneamente diagnosticadas como gastritis o gastropatía portal, lo cual podría ocasionar un retraso en el tratamiento.
Diagnóstico Diferencial
Básicamente se hace con la gastritis aguda inflamatoria y la gastropatía hipertensiva. Cuadro 1.

Manejo
Las opciones terapéuticas son de tipo médico, farmacológico, endoscópico o quirúrgico.
Médico
Es la forma más simple de terapia y consiste en dar suplementos férricos y realizar transfusiones de sangre ocasionales.
Farmacológico
Según los diversos estudios, los agentes farmacológicos, como la prednisona, (5,11) la prednisolona, (12,13) y las preparaciones estrógeno-progesterona, se han usado con relativas tasas de éxito (12). El octreótide no ha demostrado ser eficaz en ningún estudio (14), al igual que el uso de antiácidos, sucralfate, anti-H2 o inhibidores de la bomba de potasio (5-9,12,13, 22). Cuando esta medida falla, se requieren terapias endoscópicas o quirúrgicas.
Endoscopia
La terapia endoscópica, incluyendo el YAG láser, láser argón, terapia de sonda caliente, terapia bipolar y electrocoagulación multipolar, han demostrado ser eficaces en la resolución de la enfermedad visible, corrigen la anemia y eliminan la necesidad de transfusiones sanguíneas. La mayoría de las series ha demostrado la seguridad de la biopsia endoscópica para confirmar el diagnóstico. También se ha informado que puede ocurrir sangrado, por lo cual se recomienda la toma de biopsias cuando hay inseguridad en el diagnóstico, aunque ésta no es obligatoria si el diagnóstico es obvio. El número de sesiones endoscópicas necesarias varió entre tres y cuatro sesiones durante un periodo de cuatro a doce meses; se reportaron recidivas tras este tratamiento (1,4,6,9,22). La terapia endoscópica ha demostrado ser eficaz, con una baja tasa de morbi-mortalidad (2,1%).
Quirúrgico
La antrectomía fue el tratamiento utilizado en el 88% de casos quirúrgicos informados (3,22,24). Durante un período de 1 a 24 meses no se presentó reaparición del sangrado en el 100% de los pacientes sometidos a este procedimiento. La antrectomía ofrece una terapia definitiva excelente, pero presenta una mortalidad asociada de 7.4% (10).
Discusión
La ectasia vascular antral gástrica es una enfermedad plenamente identificada, endoscópica e histológicamente, con una fisiopatología aún no bien dilucidada y es una causa reconocida de sangrado gastrointestinal oculto o evidente. En la paciente que presentamos, se trata de un caso típico de ectasia vascular, que no ameritó confirmación histológica por biopsia previa al manejo quirúrgico. La antrectomía es el tratamiento más eficaz, y mejor aún si se realiza por método mínimamente invasor como la laparoscopia, cuya principal ventaja es que las estructuras anatómicas no se deforman en su parte externa.
Abstract
Gastric antral vascular ectasia is a rare entity and usually remains undiagnored. However, it is a determinant factor in the development of upper gastrointestinal bleeding of diverse degrees of severity. Its pathophysiology determinates special characteristics known as “watermelon stomach” it may be associated with other pathologic entities; but this relationship has not been well established.
We report a clinical case and a literature review. Management consisted of laparoscopic antrectomy.
Key words: gastric astral vascular ectasia, watermelon stomach, laparoscopy, gastrointestinal hemorrhage, gastretomy.
Rererencias
1. Gostout CJ, Viggiano TR, Ahlquist DA, Wang KK, Larson MV, Balm R. The clinical and endoscopic spectrum of the watermelon stomach. J Clin Gastroenterol 1992; 15: 256-263.
2. Merrett MN, Machet D, Ring J, Desmond PV, Martin CJ. Watermelon stomach: An unusual cause of chronic gastro-intestinal blood loss. Australian & New Zealand J Surg 1991; 61: 393-396.
3. Gretz JE, Achem SR. The watermelon stomach: Clinical presentation, diagnosis, and treatment. Am J Gastroenterol 1998; 93: 890-895.
4. Gostout CJ, Ahlquist DA, Radford CM, Viggiano TR, Bowyer BA, Balm RK. Endoscopic laser therapy for watermelon stomach. Gastroenterology 1989; 96: 1462-1465.
5. Jabbari M, Cherry R, Lough JO, Daly DS, Kinnear DG, Goresky CA. Gastric antral vascular ectasia: The watermelon stomach. Gastroenterology 1984; 87: 1165-1170.
6. Tsai HH, Smith J, Danesh BJ. Successful control of bleeding from gastric antral vascular ectasia (Watermelon stomach) by laser photocoagulation. Gut 1991; 32: 93-94.
7. Bjorkman DJ, Buchi KN. Endoscopic laser therapy of the watermelon stomach. Lasers in Surgery & Medicine 1992; 12: 478-481.
8. Frager JD, Brandt LJ, Frank MS, Morecki R. Treatment of a patient with watermelon stomach using transendoscopic laser photocoagulation. Gastrointestinal Endos 1988; 34: 134-137.
9. Watson M, Hally RJ, McCue PA, Varga J, Jiménez SA. Gastric antral vascular ectasia (Watermelon stomach ) in patients with systemic sclerosis. Arthritis & Rheumatism 1996; 39: 341-346.
10. Borsch G. Diffuse gastric antral vascular ectasia: The «Watermelon Stomach» Revisited. Am J Gastroenterol 1987; 82: 1333-1334.
11. Kruger R, Ryan ME, Dickson KB, Núnez JF. Diffuse vascular Ectasia of the gastric antrum. Am J Gastroenterol 1987; 82: 421-426.
12. Moss SF, Ghosh P, Thomas DM, Jackson JE, Calam J. Gastric antral vascular ectasia: Maintenance treatment with estrogen-progesterone. Gut 1992; 33: 715-717.
13. Rawlinson WD, Barr GD, Lin BP. Antral vascular ectasia – The «watermelon stomach”. Med Australia 1986; 144: 709-711.
14. Nardone G, Rocco A, Balzano T, Budillon G. Tominaga K. Arakawa T. The efficacy of octreotide therapy in chronic bleeding due to vascular Abnormalities of the Gastrointestinal Tract. Aliment Pharmacol Ther 1999. 13: 1429-1436.
15. Fabian G. Tovari E. Baranyay F. et al. Watermelon-stomach as a cause of chronic iron deficiency anemia in a patient with systemic sclerosis. J Eur Acad Dermatol Venereol 1999 12: 161-164
16. Makharia GK. Behra A. Kaman L. Vaiphei K. Singh K. Kochhar R, et al. Watermelon Stomach: A rare cause of upper gastro-intestinal bleeding. Indian J Gastroenterol 1999; 18: 86-87
17. Masahiko Yamada, Daisaku Nishimura, Hiroshi Hoshino, Naoyuki Katada, Hiroshi Sano, Katsumoto Kato. Gastric antral vascular ectasia successfully treated by endoscopic electrocoagulation. Journal of Gastroenterology 1998; 33: 546-549
18. Puricet Kumar AB, Fleisher I. Thermal therapy for gastro-intestinal bleeding. Gastrointestinal Endosc Clin North Am 1997; 7: 593-609
19. Guillian H, Geisenger KR, Wu W.C. et al. Endoscopic biopsy is diagnostic in gastric antral vascular ectasia: The watermelon Stomach. Dig Dis Sci 1989; 34: 885.
20. Weiner FR, Simon DR. Gastric Vascular Ectasia. Occult Gastrointestinal bleeding. Gastrointestinal endoscopy. Clinics of North America 1996; 29: 643-657.
21. Poniachik Teller J, Quera R, Sáenz Fuenzalida R, Alfaro J, Somok G. Coagulación endoscópica con plasma de argón: una opción terapéutica en la ectasia vascular astral. Rev méd Chile 2001; 129: 547-51.
22. Llanos López J, Valdés Moyano E, Cruzat CC, Llanos MC. Ectasia vascular gástrica antral: infrecuente causa de anemia ferropriva: comunicación de un caso. Gastroenterol Latinoam 2000; 11: 58-62.
23. Ferrarin R, Mayer G, Lersch E, Hahn G, Lubini M. Ectasia vascular antral gástrica. Rev Med Hosp San Vicente de Paúl 2000; 26: 72-74.
24. Paniagua Estévez M, Piñol Jiménez F. Ectasias vasculares del antro gástrico como causa de hemorragia digestiva crónica: presentación de 1 caso. Rev Cuba Med 1999; 38: 71-78.
25. Oliveira CV, Chaves DM, Iriya K, Sakai P, Ishioka S. Watermelon stomach e tumor carcinóide gástrico em um paciente cirrótico. Arq Gastroenterol 1995; 32: 66-70.
Correspondencia:
Jesús Eduardo Díaz R.
Carrera 8 No 18N – 02
Correo electrónico: jesuseduardodiaz@hotmail.com
Popayán – Colombia
* Docente departamento de ciencias quirúrgicas. Facultad de ciencias de la salud. Universidad del Cauca – Hospital Universitario “San José”. Popayan – Colombia.
** Residente de 1er Año – Cirugia General, Universidad del Cauca – Hospital Universitario “San Jose” , Popayan – Colombia.
Fecha de recibo: Abril 24 de 2003
Fecha de aprobación: Julio 10 de 2003
