Revisión de Temas
LUIS CARLOS DOMÍNGUEZ*, LILlAN TORREGROSA ALMONACID**
Palabras Claves: neuroplasmas del estómago, leimioma, sarcoma de célula fusiforme.
Resumen
Los tumores gástricos de origen estromal constituyen un grupo especial de lesiones cuya definición patológica se ha establecido recientemente dada la evolución en las técnicas de análisis patológico. A pesar de su infrecuente presentación, es importante para el cirujano conocer su clasificación, características biológicas y las modalidades de tratamiento existentes.
Caso Clínico
Mujer de 41 años de edad sin antecedentes médicos relevantes, quien consulta a medicina general por cuadro de dolor abdominal epigástrico tipo ardor, de cuatro meses de evolución, manejado con inhibidor de bomba de protones sin ninguna mejoría. Ocasionalmente el cuadro se asociaba ocasionalmente con la presencia de vómito con pintas de sangre y síntomas de ortostatismo, por lo que es remitida a valoración especializada donde se solicita una endoscopia de vías digestivas altas en la que se evidencia gastritis crónica antral y una lesión tumoral de 5 a 7 cm (de probable origen estromal) ubicada en el antro gástrico. La biopsia de la lesión confirma la presencia de un tumor estromal gástrico.
Se realiza además una tomografía axial computarizada, en la que como único hallazgo se evidencia una masa sólida, redonda, de 3 cm, ubicada en el antro gástrico.
Durante su estudio ambulatorio, la paciente presenta un episodio de sangrado digestivo alto por el cual se hospitaliza. En la nueva endoscopia se evidencia la misma masa redondeada, submucosa, localizada en la curvatura menor inmediatamente por debajo de la incisura angularis con sangrado activo por un vaso pulsátil que se esclerosa (figura 1).

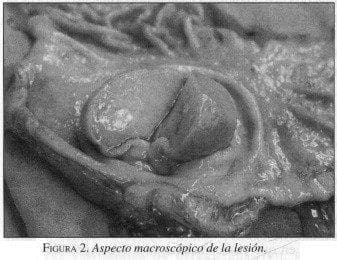
La paciente es transfundida y llevada a cirugía, donde se encuentra una lesión tumoral prepilórica de 4 x 3 cm, redonda, rosada, de bordes bien definidos que no compromete la capa muscular ni la serosa (figura 2). Se realiza una gastrectomía subtotal del 75% con disección ganglionar D1 y reconstrucción tipo gastroyeyunostomía en Y de Roux .
La evolución postoperatoria es satisfactoria, por lo que al cabo de siete días la paciente es dada de alta.
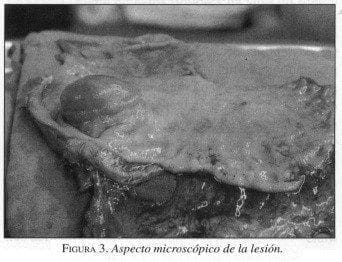
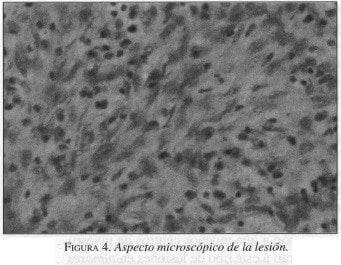
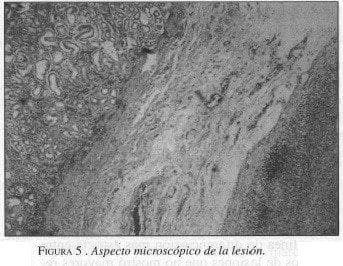
El reporte de patología muestra un “Tumor estromal de tracto gastrointestinal de tipo fusiforme, intramural, de 4 cm, de bajo riesgo de metástasis , con actividad mitótica en número de 5 x 50 campos de alto poder (CAP), sin necrosis ni hemorragia “ (Figura 3 a 5 ).
 |
 |
Se obtuvieron nueve ganglios, reportados como negativos para malignidad.
Los controles ambulatorios han sido satisfactorios en sus cinco primeros meses de postoperatorio.
Introducción
La primera definición, aceptada hasta cerca de los años sesenta, de los tumores gástricos de origen estromal fue realizada por Stout en 1940, al referirse a un grupo particular de lesiones que nacían exclusivamente del músculo liso y que se denominaron inicialmente como leiomioma, leiomiosarcoma, leiomioblastoma y leiomioma bizarro. Sin embargo, durante los años setenta, con el desarrollo de la Microscopía Electrónica (ME), se reveló que relativamente pocos de estos tumores ultraestructuralmente presentaban diferenciación de músculo liso exclusivamente, y a principio de los años ochenta, con la introducción de la inmunohistoquímica, se demostró que muchas de estas lesiones perdían sus características inmunofenotípicas exclusivas de diferenciación de músculo liso, lo que permitió a Mazur y Clark, en 1983, introducir el término más genérico de “tumores estromales”. Estos mismos autores observaron que dichos tumores expresaban antígenos de la cresta neural como la proteína S100 y la enolasa neuroespecífica (NSE) y que en algunos casos demostraban diferenciación neuroaxonal. Dichas características condujeron a que muchos centros de investigación subdividieran a este tipo de lesiones en tumores gastrointestinales de nervios autónomos (GANT) y tumores estromales del tracto gastrointestinal (GIST), para referirse con el primer término a los que mostraban una diferenciación casi exclusiva del sistema autónomo y con el segundo a los de origen miogénico. Esta doble clasificación, desde principios de la década de los noventa, generó una gran confusión acerca de la línea o líneas de diferenciación (histogénesis) de los tumores de músculo liso, los de origen neural, los mixtos y los de fenotipo no clasificable.
A partir de ese momento con los avances inmunohistoquímicos, especialmente con el estudio de la sobre-expresión de la proteína CD34, se pretendió generar una línea de diferenciación más estricta entre los dos grupos de lesiones que no mostró mayores resultados, dado que la inmunopositividad para CD34 se acercó en la mayoría de los estudios al 60-70% para los GIST y en porcentajes menores pero significativamente representativos del 30% para los GANT. Surgió entonces una gran controversia acerca de si tales lesiones resultaban ser entidades puramente separadas, o si formaban parte de una misma enfermedad pero con un espectro histológico diferente.
Actualmente los estudios han revelado mutaciones del KIT y sobre-expresión de la proteína KIT (CD117) la cual define un grupo de tumores que demuestran diferenciación a partir de las células intersticiales de Cajal. Estas células, también conocidas como marcapasos del tracto gastrointestinal, se forman en la interfase entre la inervación autónoma de la pared intestinal y el músculo liso. Las células muestran características inmunofenotípicas y ultra estructurales de ambos tipos de tumores. De esta forma cada vez más tumores que anteriormente eran denominados como GANT hoy en día demuestran diferenciación similar a los GIST y viceversa, por lo cual se propone con más fuerza unificar a los dos tipos de lesiones.
Estos tumores se han vuelto centro de atención para muchos investigadores dada la importancia del rol de la mutación KIT y la expresión de la proteína KIT, y por los avances en el desarrollo de la terapia, en estadios tempranos, con el uso del inhibidor del receptor de la tirosina kinasa STI-571.
Pese a estos avances, la controversia actual se centra en si son lesiones mesenquimales intra abdominales que demuestran inmunopositividad para el KIT exclusivamente, o si son más bien un grupo de lesiones que comparten características comunes de diferenciación entre el músculo liso y el tejido nervioso autónomo, pero que muestran diversos grados de expresión del KIT y de otras proteínas. Igualmente, esta controversia propone aclarar en qué circunstancias la sobre expresión del KIT debe utilizarse rutinariamente o no, y si debe considerarse como el “patrón de oro” en el diagnóstico.
Lo único claro parece ser que tal vez el KIT sea confirmatorio de este tipo de lesiones en un 90–95%, en el orden de facilitar la terapia con STI-571, con un mejor rendimiento que otro tipo de marcadores como el CD34, SMA y el S-100, que demuestran positividad en un 60, 40 y 5% respectivamente.
Características Clínicas
La mayoría de estas lesiones se presentan entre la quinta y la séptima década de la vida. Pocos estudios han mostrado predominancia en hombres, y hoy en día se acepta que no existe comportamiento diferente entre los dos sexos. La verdadera incidencia es desconocida; sin embargo, las estadísticas muestran que existen aproximadamente 150 nuevos casos diagnosticados cada año en los Estados Unidos.
En general, este tipo de tumores comprende menos del 1% de todas las lesiones malignas del tracto gastrointestinal y puede presentarse desde la faringe hasta el ano. El estómago es el sitio más frecuentemente comprometido (52%), seguido por el intestino delgado (25%); el colon (11%) y el esófago (5%) son poco frecuentemente comprometidos. En modelos animales se han demostrado como probable factor de riesgo la exposición a nitrosaminas (N-metil-N-nitro-N- nitrosoguanidina) y se ha observado en humanos luego de tratamiento con radioterapia, para otro tipo de lesiones tumorales del tracto gastrointestinal; sin embargo, los factores de riesgo hoy en día permanecen casi completamente desconocidos.
En ocasiones la presentación clínica de estas lesiones es asintomática, razón por la cual son diagnosticadas incidentalmente en muchos casos y dependen del tamaño tumoral, patrón de crecimiento y localización, siendo más común una masa abdominal palpable y dolorosa que usualmente causa sangrado digestivo, secundario a ulceración mucosa. También es frecuente encontrar sintomatología obstructiva, anorexia, disfagia y perforación. En 1977, Carney describió una rara tríada (la “tríada de Carney”), caracterizada por tumores estromales de origen gástrico, asociados a paragangliomas extraadrenales y condromas pulmonares. Por razones aún desconocidas, los pacientes con esta tríada presentan un mejor pronóstico representado en una sobrevida cercana al 80% a 20 años de seguimiento, lo que ha permitido caracterizar a estas lesiones en este tipo de presentación como: crónicas, persistentes e indolentes.
Patología
La célula origen de estos tumores ha sido un tópico de continua discusión. En la era de la pre inmunohistoquímica, la localización en la muscularis propia del intestino y la frecuente morfología de células fusiformes implicaron un origen del músculo liso para este tipo de lesiones. Luego, la evaluación ultraestructural y los análisis inmunohistoquímicos permitieron diferenciar una serie de lesiones que mostraban características mioides, neurales y/o gangliónicas, con frecuencia observadas en el mismo tumor. Citológicamente predominan dos tipos celulares, uno fusiforme (60-70%) y otro epitelioide (30-40%). Las primeras son células con núcleo agrandado con contornos definidos, y por lo regular presentan un halo claro perinuclear y citoplasma rosado abundante. Las segundas se caracterizan por tener un contorno poligonal o redondo, con un núcleo central o ligeramente excéntrico y abundante citoplasma, que a veces aparece densamente eosinofílico y exhibe características “rabdoides”. Cada tipo celular puede demostrar características celulares de malignidad dadas por pleomorfismo nuclear, aumento de la actividad mitótica, hipercromasia y nucléolo prominente. Ocasionalmente se puede encontrar también un infiltrado inflamatorio caracterizado por eosinófilos.
Recientemente se ha reconocido el papel de las células intersticiales de Cajal en la histopatogénesis de estas lesiones, dado que son parte de la interfase entre la inervación autónoma de la pared intestinal y el músculo liso de la misma y muestran características inmunofenotípicas y ultraestructurales combinadas de los anteriormente denominados GANT y los GIST propiamente dichos.
Inmunohistoquímica
Los anticuerpos más utilizados en varios estudios para caracterizar los GIST están dirigidos contra vimentina, desmina, actina específica muscular (MSA/HHF-35), actina de músculo liso (SMA), proteína S-100, neurofilamento (NF), enolasa neuro-específica (NSE), PGP9.5, CD34 y CD117 (c-kit). Estos marcadores, dado el posible origen neural o miogénico, varían ampliamente en su inmunopositividad de estudio a estudio. Sin embargo, los utilizados con más frecuencia han sido el CD34 y el CD117 (c-kit) porque han demostrado mayor rendimiento en la diferenciación de los GIST, aunque no son tumor-específicos, de tumores puros de músculo liso y de otros tumores mesenquimales del tracto gastrointestinal.
El CD34 es una glucoproteína transmembrana presente en las células progenitoras hematopoyéticas y en el endotelio vascular, como también en un gran número de tumores. Se encuentra en el 60% de los GIST, por lo cual no ha resultado ser un marcador ideal en este tipo de tumores. En comparación, el CD117, una proteína que actúa como receptor extracelular de ligandos, que según se cree desempeña un papel fundamental en la supervivencia, proliferación y diferenciación celular ha mostrado positividad en cerca del 90-95% de las lesiones tumorales, lo que lo convierte hoy en día en el primer marcador para el diagnóstico de los GIST.
El proto-oncogén c-kit se ha encontrado en el cromosoma 4q11-21 y se ha asociado a un receptor del factor de crecimiento de la tirosina kinasa III, expresándose en una amplia variedad de tejido normal, incluyendo el tracto gastrointestinal, pero sobre todo por su sobre-expresión en cerca del 95% de los GIST. Este hecho ha permitido implicarlo en el rol de la génesis de estas lesiones tumorales y ser objeto de estudio para el desarrollo de una nueva terapia, el STI-571, un inhibidor del receptor de la tirosina kinasa que inhibe la proteína kit activada y ha demostrado hasta el momento (en estudios clínicos en fase II-III) ser un efectivo tratamiento para la enfermedad recurrente o metastásica de los tumores estromales del tracto gastrointestinal.
Clasificación
Durante años ha sido discutido el potencial de malignidad de estas lesiones, aceptándose como límite, casi arbitrario, el tamaño tumoral de 5 cm y la actividad mitótica (5 mitosis / 50 campos de alto poder –CAP-). Parte de la discusión se ha centrado en evaluar el potencial metastático de lesiones más pequeñas y de actividad mitótica menor, admitiendo hasta hace pocos años, que este grupo de lesiones tenían un potencial maligno incierto. Hoy en día, sin embargo, se ha logrado demostrar que lesiones menores de 1 cm y de actividad mitótica menor a 5 / 50 CAP tienen un comportamiento benigno, pero lesiones de tamaño mayor (entre 2 y 5 cm), dada la escasa cantidad de estudios de seguimiento a largo plazo (diez años) son de comportamiento incierto, pues cerca del 50% metastatizan al final de los cinco años.
En el consenso americano del año 2002 se sugirió clasificar estas lesiones como de muy bajo riesgo, de bajo riesgo, de riesgo intermedio y de riesgo alto, ya que el comportamiento biológico del tumor se ha relacionado directamente con el tamaño y la actividad mitótica del mismo. (tabla 1)

Tratamiento
Se ha reconocido que es innecesaria la resección radical para este tipo de lesiones. Se utilizan entonces la resección segmentaria o la enucleación como tratamiento quirúrgico suficiente y seguro. Igualmente, para la mayoría de las metástasis, casi siempre encontradas en el peritoneo o en el hígado, las resecciones segmentarias han demostrado alguna utilidad. La quimioterapia y la radioterapia son inefectivas.
En la comunidad oncológica ha sido tema de continuo debate el tratamiento apropiado para los pacientes con diagnóstico de GIST de alto grado pero sin metástasis. El Grupo de Oncología del Colegio Americano de (ACOSOG) ha propuesto como benéfico el uso de la terapia con STI-571 después de la resección completa de los GIST de alto grado en ausencia de metástasis. Así, aunque ha sido demostrada la cirugía como la única terapia efectiva para los GIST, después de la resección completa muchos de los pacientes con lesiones de alto grado mueren por recurrencia de la enfermedad. De esta forma, con el advenimiento del STI-571 se ha cambiado sustancialmente el manejo de los GIST en la etapa post-operatoria, para el control de la recurrencia de la enfermedad. Sin embargo continua en investigación su papel como terapia adyuvante o neoadyuvante.
Particularmente los efectos colaterales de STI-571, han sido la dispepsia y la diarrea. Aún no existen los estudios de seguimiento a largo plazo con este tipo de terapia y son todavía son objeto de estudio las vías que determinan la respuesta clínica a la terapia con STI-571. Sin embargo, el STI-571 puede reducir el tamaño del tumor, sugiriendo que la respuesta del GIST al STI-571 no es únicamente citostática.
Abstract
Gastric tumors ofstromal origin constitute a special group of lesions whose pathologic definition has been recently established with the modern techniques ofpathologic analysis. Although they exhibit a low incidence, the surgeon must be aware of their classification, biologic characteristics, and available treatment modalities.
Key words: stomach neoplasms, leiomyoma, ,~pindle cell sarcoma
Referencias
- Fletcher C. Berman J. et. al. Diagnosis of Gastrointestinal Stromal Tumors: A Consensus Approach [Consensus Conference]. International Journal of Surgical Pathology 2002;10: 81-89.
- Mazur MT, Clark HB. Gastric stromal tumors: Reappraisal of histogenesis. Am J Surg Pathol 1983; 7:507-519
- Lauwers GY, Erlandson RA, Casper ES, Brennan MF, Woodruff JM. Gastrointestinal autonomic nerve tumors: A clinicopathologic, immunohistochemical and ultrastructural study of 12 cases. Am J Surg Pathol 1993;17:887-897
- Debiec-Richter M., Pauwels P., et. al. Complex genetic alteratios in gastrointestinal stromal tumors with autonomic nerve differentiation. In: Modern Pathology 2002;15:692-8
- Kindblom L-G, Remotti HE, Aldenborg F, Meis-Kindblom JM. Gastrointestinal pacemaker cell tumor (GIPACT): Gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 1998;152:1259-1269.
- Pidhrorecky, I. Cheney, R., et. Al. Gastrointestinal Stromal Tumors: Current diagnosis, biologic behavior, and management. In: Annals of surgical oncology 2000;7: 705-12.
- Sanabria, A., Henao, C. Tumores gástricos no carcinomatosos. En: Botero, M, et.al. Cirugía- Gastroenterología. Editorial Universidad de Antioquia. 2002;142-69
- Alvarado, I., Ramírez, L. Et.al. Tumor estromal gástrico con degeneración mixoide. En: Rev. Gastroenterol. Méx 2000; 65: 22-25
- Graadt Van Roggen, J. Van Velthiysen, ML., et al. The histopathological differentiañ diagnosis of gastrointestinal stromal tumors, In: Journal of clinical Pathology 2001;54:96-112.
- Rosai J. Stromal Tumors In: Ackerman´s Surgical Pathology. Vol. 1 Eighth Edition, Mosby, 1996;1642-92.
- Benavide, C. Burmeister, R., et al. Tumores gástricos estromales. En : Rev Chilena Cirugía 2002; 54: 44-48
- DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors. Recurrence patterns and prognostic factors for survival. Ann Surg 2000;231:51-58.
- Rosin R. Tumors of the stomach. In: Maingot¨s Abdominal Operations. Volume 1. Appleton & Lange 1997; pp 1001-3.
- Dematteo RP, Reinrich MC, et al. Clinical Management of gastrointestinal stromal tumors: before and after STI-571. In: Human Pathology 2002; 33:466-77.
Correspondencia:
LILIAN TORREGROZA ALMONACIO
Hospital Universitario San Ignacio
Pontificia Universidad laveriana
Bogotá, D.C., Colombia
*Residente Primer Año Cirugía General Hospital Universitario San Ignacio – Pontificia Universidad Javeriana Bogotá, Colombia
**Profesora Cirugía General
Hospital Universitario San Ignacio. Pontificia Universidad Javeriana
Fecha de recibo: Noviembre 29 de 2002
Fecha de aprobación: Abril 15 de 2003
