JIMÉNEZ M.F., SCC.
Palabras clave: Apoptosis, Célula apoptósica, Muerte celular programada, Desarrollo de procesos inflamatorios sistémicos.
La apoptosis o muerte celular programada, es el resultado de la expresión de un programa endógeno genético que resulta en la muerte celular sin inducir una respuesta inflamatoria. Hace parte del proceso normal del desarrollo embrionario en los organismos multicelulares y de los tejidos de organismos maduros para asegurar su buen funcionamiento. Su importancia clínica se debe a que la alteración de este mecanismo de suicido celular, ya sea por defecto o por exceso, podría contribuir al desarrollo de entidades tales como el cáncer, el Alzheimer, la artritis reumatoidea o incluso la disfunción orgánica múltiple. La apoptosis tiene una serie de características morfológicas y fisiológicas distintivas que la diferencian claramente de la forma más conocida de la muerte celular para los cirujanos, la necrosis. Se puede identificar una célula apoptósica morfológicamnete por la presencia de condensación de cromatina nuclear, cuerpos apoptósicos y el reconocimiento por parte del macrófago, de la célula apoptósica para ser fagocitada. El entendimiento de los mecanismos de regulación y de la biología molecular de las enfermedades puede crear nuevas alternativas terapéuticas en la resolución de los procesos inflamatorios sistémicos.
Introducción
El mecanismo de muerte celular programada o apoptosis pasó desapercibido hasta la década de los noventa, cuando se demostró que la alteración de este proceso podía contribuir al desarrollo de enfermedades tan diversas como el cáncer, la artritis reumatoidea, el SIDA y el Alzheimer.
En la actualidad, la investigación inmunológica y de biología molecular trata de evaluar el papel que juega la apoptosis en la fisiopatología del síndrome de disfunción orgánica múltiple (SDOM).
Apoptosis significa en griego clásico «caída de», comparable a la manera natural como las hojas de los árboles o los pétalos de las flores caen en otoño . Este mecanismo de muerte es una forma de suicidio celular que se efectúa a través de la expresión de un programa endógeno genético que resulta en la eliminación de las células sin evocar una respuesta inflamatoria importante. Fue identificada desde 1950 como el mecanismo del desarrollo embriológico por el cual los organismos multicelulares prescinden selectivamente de las células que no son necesarias para adquirir su forma definitiva. De esta manera, la lombriz redonda Caenorhabditis elegans elimina 131 células de sus 1.090 células iniciales en su estado hermafrodita para convertirse en un organismo adulto; el renacuajo pierde su cola y el embrión humano elimina las membranas interdigitales de sus manos para dar orígen a unos dedos normales.
Posteriormente en 1972, los patólogos John F. Kerr, Andrew H. Wylie y Alastair R.Currie demostraron que la apoptosis no sólo ocurría durante el desarrollo embrionario, sino que también se evidenciaba en los organismos maduros durante su vida. Kerr y Searle comprobaron, que todos los tumores malignos presentaban apoptosis espontánea lo mismo que producían mitosis. El resultado de estas y posteriores investigaciones han demostrado que la salud de los organismos multicelulares no sólo depende de la capacidad de formación celular sino también de la posibilidad de prescindir de las células que son excesivas o superfluas.
Diferencias Morfológicas entre la Apoptosis y la Necrosis
Las células de los organismos multicelulares pueden morir por dos mecanismos diferentes: la apoptosis o la necrosis. A continuación se presentan las diferencias morfológicas entre las dos entidades.
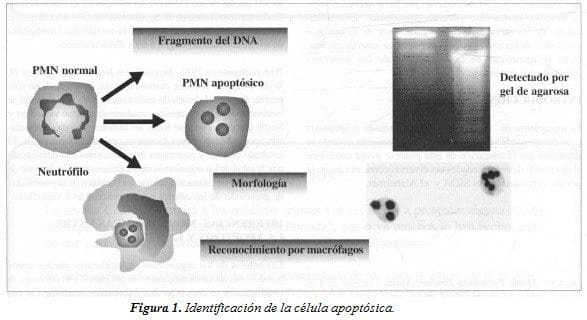
La apoptosis presenta una secuencia de cambios ultraestructurales que la diferencian claramente de la necrosis. Una célula apoptósica inicialmente se caracteriza por compactación y marginalización de la cromatina nuclear y condensación del citoplasma. Posteriormente, se produce una fragmentación nuclear y formación de los cuerpos apoptósicos, donde los organelos celulares son empacados y preservados por la membrana celular.
La célula es posteriormente fagocitada por los macrófagos sin inducir una respuesta inflamatoria significativa. Característicamente el proceso de muerte celular por apoptosis, a diferencia de la necrosis, requiere de la utilización de energía para su autodestrucción.
Una célula destinada a morir por necrosis, muestra por lo contrario, edematización de todos sus compartimentos citoplasmáticos, ruptura de membranas, liberación de enzimas proteolíticas y, finalmente, degeneración celular.
El área de necrosis es reemplazada por tejido de granulación y eventualmente termina en la formación de una cicatriz. La necrosis a diferencia de la apoptosis va acompañada característicamente por una respuesta inflamatoria que induce la migración de macrófagos y neutrófilos. Aunque estos mediadores celulares contribuyen a la resolución del proceso inflamatorio, la liberación por los neutrófilos de sustancias enzimáticas y radicales libres en forma indiscriminada, puede también lesionar el tejido normal subyacente.
Métodos de Evaluación de la Apoptosis
Cuantitativamente las células apoptósicas han sido extensamente estudiadas mediante la determinación de sus cambios morfológicos al microscopio de luz y electrónico. Se puede identificar una célula apoptósica por la presencia de condensación de cromatina nuclear y de cuerpos apoptósicos. Desafortunadamente, aunque este método de evaluación es quizás el más sencillo, tiene la desventaja de que no provee información cualitativa, es dispendioso y observador dependiente.
En 1980, se demostró que los cambios morfológicos de suicidio celular estaban asociados a la fragmentación de la doble cadena nuclear de DNA en las regiones de unión de los nucleosomas. Los fragmentos oligonucleosomales pueden ser evaluados por la electroforesis del gel de agarosa, que presenta un patrón característico en escalera. Por el contrario, la necrosis muestra un patrón de degradación del DNA al azar que se traduce en una mancha difusa en el gel. El descubrimiento de un patrón distintivo de fragmentación del DNA permitió reconocer este proceso bioquímicamente y ofreció un punto inicial para el estudio de los mecanismos responsables de la apoptosis ( Figura 1).
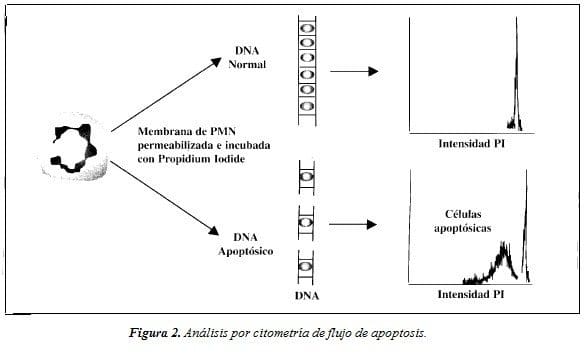
El análisis de la apoptosis por el método de citometría de flujo, se basa también en el reconocimiento de un patrón distintivo de fragmentación en escalera del DNA de la célula apoptósica. Las células normales se diferencian de las células apoptósicas por la concentración del marcador celular que absorben. Una célula normal, con DNA intacto, absorbe mayores concentraciones de marcador que la célula apoptósica cuyo DNA se encuentra fragmentado. La citometría de flujo permite realizar rápidamente análisis cualitativos y cuantitativos de diferentes grupos celulares. Es por lo tanto, uno de los métodos más utilizados por los investigadores. Generalmente, la evaluación de la apoptosis de diferentes líneas celulares, debe hacerse utilizando por lo menos dos de estos sistemas de evaluación para asegurar la confiabilidad de los resultados ( Figura 2).
Mecanismos de Regulación de la Apoptosis
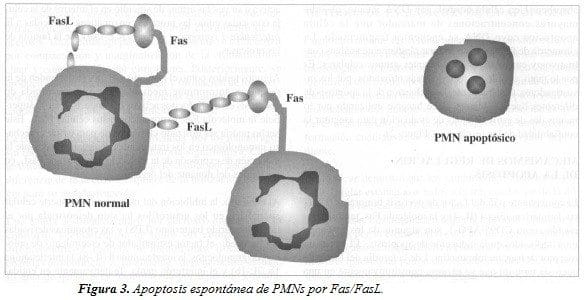
El componente p55 del factor de necrosis tumoral a (FNT-a), la interleuquina 4 (IL-4) y la molécula Fas, también conocida como CD95/APO-1, son algunos de los mecanismos implicados en la inducción de apoptosis. El Fas es un receptor de transmembrana tipo 1 de la familia del factor de necrosis tumoral que se expresa constitutivamente en una variedad de tipos celulares, incluyendo linfocitos, eosinófilos, monocitos y neutrófilos. Cuando una célula es activada por un antígeno, ésta produce la molécula Fas que a su vez expresa una molécula de superficie celular conocida como Fas ligand (FasL). La unión del receptor de superficie celular Fas con un anticuerpo agonista o por su molécula fisiológica de unión, Fas ligand (FasL), se traduce en una señal que resulta en muerte celular programada (Figura 3). La activación del receptor de membrana Fas, activa a su vez las armas de suicidio en el interior de la célula conocidas como las proteínas enzimáticas “parecidas a la Interleukin-1 converting enzyme (ICE-like)” de la familia de las proteasas.
Algunos tejidos como el testículo y el ojo, se defienden de la respuesta autoinmune mediante la inducción rápida de apoptosis en los linfocitos activos que muestran en su superficie la molécula Fas, expresando en sus células FasL. Este hecho podría ser utilizado clínicamente para evitar el rechazo inmunológico en los transplantes de órganos mediante la inducción de expresión de la molécula de superficie FasL, en los tejidos del donante del órgano.
Al contrario, la inhibición del mecanismo de muerte celular apoptósico en los neutrófilos ha sido demostrada por el lipopolisacárido bacteriano (LPS) y las citoquinas derivadas del huésped: el factor estimulador de crecimiento de colonias de granulocitos, la interleuquina 8 (IL-8), la interleuquina 1b (IL-1b) y el interferón gama. Tentativamente en entidades que presentan cambios en la concentración de citoquinas, como el síndrome de disfunción orgánica múltiple, se podría modificar la tasa de suicidio celular.
No todas las células son igualmente susceptibles a morir por apoptosis. Las células del sistema hematopoyético y de la epidermis son rápidamente reemplazadas mientras que las neuronas y las células miocárdicas son más resistentes a este mecanismo. Se evitan así los efectos deletéreos de la desaparición de células no reemplazables en órganos vitales como el sistema nervioso central o el corazón. Por otra parte, la sensibilidad de los linfocitos a la apoptosis podría explicarse desde el punto de vista teleológico ya que sería muy riesgoso la expansión de células con mutaciones que pudiesen volverse autorreactivas al huésped. A nivel molecular, la modulación de la susceptibilidad de los diferentes grupos celulares a la apoptosis está definida por un grupo de proteínas Bcl-2, Bax y Bad, que bloquean o inducen respectivamente este suicidio celular.
El conocimiento de los factores reguladores de la muerte celular programada permite establecer los mediadores que determinan la muerte celular en condiciones normales, y también puede modular farmacológicamente la respuesta inmunológica e inflamatoria.
La Apoptosis en los Procesos Patológicos
Cáncer
El cáncer se define como una proliferación celular excesiva y la pérdida de la capacidad de las células para morir. Una célula que sufre una mutación prefiere desaparecer antes que volverse incontrolable y reproducirse aceleradamente. La apoptosis de células con lesión significativa de su material genético representa una forma altruista de cometer suicidio evitando el perjuicio de su huésped. Kerr y Searle comprobaron en 1972, que todos los tumores malignos presentaban apoptosis espontánea de la misma forma que producían mitosis. La regulación de la apoptosis espontánea en los tumores se debe al parecer por proto-oncogenes y genes supresores de tumores. No obstante, en más de la mitad de los tumores sólidos del pulmón, seno y colon, el gen que codifica la proteína p53 se encuentra inactivo. Esto lleva a que no se pueda iniciar el proceso de muerte celular programada y que el tumor crezca indiscriminadamente. Otro tipo de tumores presenta una cantidad excesiva de la proteína Bcl-2, inhibidor del suicidio celular, o producen FasL para evitar la apoptosis mediada por el sistema inmune.
Dosis moderadas de radiación y algunos agentes quimioterapéuticos inducen apoptosis en poblaciones celulares de rápida proliferación y órganos linfoides. La ausencia de un gen normal para producir la proteína p53 o los niveles elevados de Bcl-2 condicionan cierta resistencia a los tratamientos anticancerosos convencionales. Por lo tanto, la terapia genética busca actualmente introducir un gen normal productor de p53 que restaure la capacidad de muerte celular.
Enfermedades autoinmunes
El sistema inmunológico debe defender al organismo de los antígenos por medio de la producción de células inflamatorias lo mismo que reconocer sus propios tejidos para no destruirlos. Los linfocitos T son los principales efectores de la respuesta inmune a la invasión por virus y otros patógenos. Es importante conocer que estos linfocitos T pueden ser inducidos a suicidarse en diferentes etapas del ciclo vital. Alteraciones en este mecanismo podrían tener consecuencias nefastas para el húesped.
Las células tímicas se suicidan por apoptosis si no son capaces de producir receptores funcionales o si estos se unen firmemente a los receptores de superficie expresados en el timo evitando así una destrucción autoinmune.Estas células pueden ser también inducidas a la muerte programada si son sometidas a radiación al producir la proteína p53, facilitadora de la apoptosis.
Las células inmaduras precursoras de linfocitos T provenientes de la médula ósea, invaden el timo donde crean receptores que se unirán al antígeno para asegurar el control del agente invasor. Este mecanismo permite la eliminación del agente infeccioso cuando los receptores de dichas células se unen al agente invasor. Sin embargo, una vez se ha resuelto la infección, es deseable que estas células inflamatorias desaparezcan de los tejidos con lo que se evita perpetuar un proceso inflamatorio crónico.
Los linfocitos T maduros circulantes permanecen en estado de reposo hasta cuando son activados a producir citoquinas cuando se unen al antígeno. Los linfocitos T que han sido activados por un agente infeccioso permanecen en la circulación por algunos días hasta que cumplen su función y son programados luego a morir por apoptosis.
Algunas enfermedades autoinmunes se explican por un defecto en el sistema para eliminar los linfocitos que reaccionan contra los tejidos propios. La respuesta inflamatoria inicialmente leve puede destruir tejidos extensos del huésped cuando estos episodios se repiten. La señal de muerte celular apoptósica mediada por Fas resulta en la desaparición de células T autorreactivas. En entidades clínicas como la artritis reumatoidea y el lupus eritematoso sistémico se ha demostrado un retardo en la muerte celular programada de los linfocitos autorreactivos. Por lo tanto, el proceso inflamatorio se perpetúa por un período más largo. A nivel molecular se ha encontrado que posiblemente estos linfocitos autorreactivos bloqueen el FasL impidiendo que se active el programa de muerte celular. En consecuencia, se podrían diseñar algunas intervenciones terapéuticas administrando en las articulaciones enfermas compuestos con moléculas activadoras de Fas.
Síndrome de inmunodeficiencia adquirida (SIDA)
Cuando un virus invade una célula busca que su nuevo huésped produzca únicamente las proteínas que son vitales para producir más virus. Esto llevaría a la muerte de la célula y por lo tanto su propia destrucción. Por lo tanto, algunos virus han evolucionado para inhibir la muerte celular programada de las células infectadas. Algunos virus producen proteínas similares al inhibidor de la apoptosis Bcl-2 o degradan las proteínas responsables de la apoptosis como el p53 y las proteasas parecidas a ICE. El huésped para defenderse de esta invasión por los virus produce los linfocitos T citotóxicos que destruyen las células infectadas mediante la inyección de enzimas que llevan a la necrosis celular.
Los pacientes con SIDA presentan característicamente una disminución de linfocitos T ayudadores que los hace más susceptibles a enfermedades virales y parasitarias que la población general. La evidencia actual demuestra que probablemente el mecanismo de disminución de estos linfocitos sea dado por la muerte celular programada. Esto por lo tanto, lleva a que las células citotóxicas también disminuyan ya que requieren de una señal enviada por los linfocitos T ayudadores para evitar su suicidio. Las células producen normalmente cierta cantidad de Fas, tiempo después de ser activadas. Sin embargo, los linfocitos T ayudadores de los pacientes con SIDA presentan grandes cantidades de Fas antes de ser activadas y podrían morir prematuramente antes de cumplir con su función.
Lesiones isquémicas
A diferencia del cáncer en el que la muerte celular programada está inhibida, algunas enfermedades se producen por una aumento en la tasa de apoptosis celular. El infarto miocárdico o un accidente cerebrovascular es el resultado de la obstrucción del vaso sanguíneo que produce la muerte celular por necrosis en la zona no perfundida. El tejido circundante que sobrevivió inicialmente a la hipoxia gracias a la presencia de circulación colateral, muere posteriormente por apoptosis debido a la reperfusión que libera gran cantidad de radicales libres. Característicamente las neuronas y las células miocárdicas no se dividen y son reemplazadas únicamente por tejido de cicatrización. Por lo tanto, es importante diseñar intervenciones farmacológicas que controlen la producción de radicales libres o que inhiban las proteasas parecidas a ICE, inhibiendo así la apoptosis. El Alzheimer, la enfermedad de Parkinson y la esclerosis lateral amiotrófica son algunas otras entidades que se explican por un exceso de apoptosis celular. Desafortunadamente, todavía no se conoce exactamente la causa de esta disregulación.
Respuesta inflamatoria
El estudio de la muerte celular programada se desarrolló inicialmente en linfocitos por su asociación al cáncer y a alteraciones del sistema autoinmune. Sin embargo, en los últimos años la evaluación de la alteración de la apoptosis en los neutrófilos ha adquirido preponderancia ya que podría explicar la persistencia de algunos procesos inflamatorios y la disfunción orgánica múltiple.
Los polimorfonucelares neutrófilos (PMNs) son las células efectoras centrales en la defensa inicial del organismo frente a la lesión y la infección. La migración de los neutrófilos a las áreas comprometidas lleva a su activación y a una inhibición significativa de la muerte celular por apoptosis. Estas células liberan en forma indiscriminada enzimas proteolíticas y radicales libres que controlan la infección pero también lesionan el tejido circundante. Si en circunstancias normales la terminación de la respuesta inflamatoria está determinada por la desaparición de los neutrófilos mediante el programa de muerte celular apoptósico, entonces se podría considerar que el retardo en la apoptosis del PMN contribuiría a la neutrofilia y a la lesión orgánica.
Los neutrófilos han sido implicados en la patogénesis de enfermedades tales como el síndrome de dificultad respiratoria del adulto (SDRA) y las lesiones secundarias al síndrome de isquemia/reperfusión. La supervivencia prolongada de los PMN ha sido ampliamente demostrada en pacientes quemados. En un estudio realizado en la Universidad de Toronto por Marshall JC. y cols, se evaluó la sobrevida de los PMNs de pacientes críticamente enfermos y su implicación sobre el desarrollo de SDOM. Para esto, se estudiaron los PMNs obtenidos de voluntarios sanos, pacientes que habían sido sometidos electivamente a resección de aneurisma de aorta abdominal y pacientes de la Unidad de Cuidados Intensivos que cumplían los criterios de síndrome de respuesta inflamatoria sistémica (SRIS). Se encontró que los neutrófilos de los pacientes llevados a cirugía electiva mayor y de los pacientes críticamente enfermos tenían una sobrevida significativamente mayor que los neutrófilos de los pacientes sanos. Se determinó que los neutrófilos de los pacientes con SRIS no sólo vivían más sino que permanecían funcionalmente activos. Por otra parte, los PMN de los pacientes críticamente enfermos tenían un número normal de receptores de Fas, pero eran refractarios a esta señal inductora de muerte celular. La demostración que la disminución de la tasa de apoptosis de los PMNs provenientes de voluntarios sanos incubados por 24 horas con el plasma de pacientes críticamente enfermos o quirúrgicos, habla de la presencia de un mediador en el plasma responsable de este mecanismo de retardo. Al estudiar el mecanismo de mayor sobrevida de los PMNs en los pacientes críticamente enfermos y quirúrgicos, no se encontró que se debiese a la disminución de la expresión de los genes pro-apoptósicos ICE y CPP32. Sin embargo, no se pudo demostrar, por un número insuficiente de pacientes en el estudio, que el retardo en la muerte celular programada en los neutrófilos de los pacientes críticamente enfermos contribuya al desarrollo del síndrome de disfunción multiorgánica.
Con el fin de establecer el mediador responsable del aumento de la sobrevida de apoptosis de los PMNs de pacientes con procesos inflamatorios, Simms HH. y cols., estudiaron el plasma de pacientes con SDRA. Encontraron un aumento significativo de la sobrevida de los PMNs provenientes de voluntarios sanos cuando se incubaban con el plasma de dichos pacientes. Este efecto era neutralizado si se colocaba un anticuerpo contra el receptor del factor estimulador de colonias de granulocitos (GM-CSF, por sus siglas en inglés), cosa que no ocurría en el plasma normal. Concluyeron que el efecto anti-apoptósico parece estar mediado por GM-CSF, aun en presencia de niveles bajos de éste o de sus receptores de superficie. El bloqueo del efecto antiapoptósico del GM-CSF por su anticuerpo específico podría convertirse, por lo tanto, en una estrategia terapéutica novedosa en el tratamiento del SDRA.
Investigación Futura
El estudio de la apoptosis busca entender las bases bioquímicas de los cambios morfológicos y determinar los mecanismos que definen su iniciación y regulación. A partir de este entendimiento, podremos conocer la biología molecular de las enfermedades y crear nuevas alternativas terapéuticas en áreas tan diversas como el cáncer, los trasplantes, las enfermedades autoinmunes y los procesos inflamatorios sistémicos.
Abstract
Apoptosis, or programmed cellular death, results from the expression o an endogenous genetic program that leads to the death of the cell without inflammatory reaction. Apoptosis is part of the normal process of embryonic development of multicellular organisms and of the tissues of mature organisms in order to insure proper function. Its clinical significance derives from the probability that this mechanism of cell suicide, both from lack or from excess, could contribute to the development of entities such as cancer, Alzheimer’s disease, rheumatoid arthritis or even multiple organ dysfunction. Distinctive morphologic and physiologic characteristics differentiate apoptosis from necrosis, a more familiar form of cellular death. An apoptotic cell can morphologically be identified by the presence of a condensation of nuclear chromatin, apoptic bodies, and the recognition of the apoptotic cell by the macrophage for phagocytosis. Understanding the regulatory mechanisms of molecular biology may lead to new therapeutic options for the resolution of systemic inflammatory processes.
Referencias
1. Richard C. Duke, David M Ojcius, John Ding-E Young: Cell Suicide in Health and Disease. Sci Am 1996 Dec: 80-7
2. John F R Kerr: Definition of Apoptosis and Overview of its Incidence. Programmed Cell Death. Harwood academic publishers, 1993
3. María F. .Iiménez. R. William. G Watson. .lean Pamdo. David Evans. Debra Fostcr. Marilyn Sleinberg. Ori D. Rolslein . .John Marshall.: Dysregulatcd Exprcssion for Ncutrophil Apoptosis in lhe Syslemil’
lnflammalory Response Syndmmc. Arl’h Surg 1997: 132: 1263-70.
Correspondencia:
Doctora María Fernanda jiménez, Transv. 26 # 114A-06. Bogotá, Colombia.
Doctora María F. Jiménez, R. William, G Watson, Jean Parodo, David Evans, Debra Foster, Marilyn Steinberg, Ori D. Rotstein, John Marshall.: Dysregulated Expression of Neutrophil Apoptosis in the Systemic Inflammatory Response Syndrome. Arch Surg 1997; 132: 1263-70.Doctora: María Fernanda Jiménez Ayala, Docente en Cir. Gral.,Clínica del Puente del Común, Univ. de La Sabana, Bogotá (Chía), Colombia.

