La pancreatitis aguda es una entidad que puede variar de lo trivial a lo fatal; muchos aspectos de la entidad, son pobremente comprendidos y a menudo son objeto de controversia. No hay un pleno conocimiento con relación a sus factores etiológicos y sobre el mecanismo mediante el cual se inicia el proceso fisiopatológico que caracteriza la entidad.
Es una emergencia abdominal grave que tiene una mortalidad que oscila entre 9 y 23%, y cuyo diagnóstico y tratamiento requiere de una comprensión de sus mecanismos patogénicos para racionalizar el uso de los elementos terapéuticos que hoy se encuentran a nuestro alcance. De igual importancia es la identificación temprana de sus complicaciones ya que ello orienta hacia un tratamiento óptimo que tiende a disminuir la morbilidad y mortalidad.
Fisiopatología de la Pancreatitis Aguda
Una revisión de los aspectos fisiopatológicos ya fue presentada en una publicación anterior (22); incluye fenómenos de activación enzimática a nivel celular, en los que la colocalización, la exocitosis y el escape de enzimas a través de la membrana al intersticio de la glándula, juegan papel predominante (23 – 25), desencadenando la activación en cascada de las proteasas con liberación de mediadores químicos, radicales libres de oxígeno y óxido nítrico (26), péptidos con acción vasoactiva como son la histamina, las kalicreínas, el plasminógeno y otras sustancias como quininas y prostaglandinas.
Hay alteración del fibrinógeno con tendencia a la coagulación intravascular diseminada; asimismo, la liberación de lipasas y fosfolipasas a la circulación o al intersticio glandular pueden a su vez actuar sobre los triglicéridos circulantes, lo que lleva a la formación de ácidos grasos libres que son tóxicos para las membranas celulares pancreáticas, para el tejido peripancreático y para otros órganos distantes, como son el capilar alveolar pulmonar, el cerebro, el miocardio, las glándulas adrenales, etc. (27).
No se sabe si los mecanismos celulares de la pancreatitis que se han enunciado actúan todos en cada caso de pancreatitis, o si representan fenómenos alternativos y variables dependientes de la condición primaria que desencadena el episodio de pancreatitis.
La mayoría de los casos de pancreatitis aguda se asocian a patología biliar o ingesta excesiva de alcohol, con porcentajes que varían según las características y hábitos de vida de cada país (26). En el caso de la pancreatitis biliar puede oscilar entre 8 y 75%; en nuestro medio puede variar entre 8% en la serie de García (28) y 52.4% en las series publicadas por Reyes (29) y Nieto (30) en el Hospital Militar Central de Bogotá.
En el caso de las pancreatitis asociadas a litiasis biliar ampliamente demostrada luego de los estudios de Acosta y Ledesma, se presentan tres teorías al respecto. La del «Canal Común» propuesta por Opie en 1901; presencia de «Reflujo Duodenal» (31); y la tercera basada en el concepto de la «Obstrucción del canal pancreático».
Quienes la defienden (32, 33) proponen que el cálculo al obstruir, o el edema ocasionado por su migración al través del esfínter, causan obstrucción de los canales pancreáticos. Al continuar la secreción dentro del canal obstruido de acuerdo a esta teoría se establecería una hipertensión dentro del sistema ductal, que podría iniciar el episodio de pancreatitis.
Esta teoría es muy atractiva pues concilia por el momento, en el aspecto de la pancreatitis de origen biliar, los fenómenos mecánicos que se derivan de la presencia del cálculo biliar en el sistema ductal con las alteraciones que se presentan a nivel celular, en donde interrumpe la exocitosis y se altera el tráfico intracelular de las enzimas que normalmente se desplazan desde la base de la célula, permitiendo que las enzimas secretoras que van a los gránulos de zimógeno y las enzimas lisosómicas que se acumulan en los lisosomas, hagan coalescencia en vacuolas intracitoplasmáticas en el proceso llamado colocalización.
En la Nomenclatura 1 se resumen las condiciones patológicas que más a menudo se asocian a la pancreatitis (34).
Clasificación de la Pancreatitis Aguda
Se han realizado muchos encuentros para clasificar la entidad, Marsella 1965, Cambridge 1983, Marsella 1984, hasta llegar a la de Atlanta en 1992 (35) que puede resumirse así:
a. Pancreatitis aguda severa se encuentra asociada con falla multiorgánica y/o con complicaciones tales como necrosis, absceso o pseudoquiste.
b. Pancreatitis aguda leve asociada con mínimo compromiso sistémico y sin las complicaciones descritas para la pancreatitis severa.
c. Pancreatitis con colecciones líquidas; se presentan temprano durante el episodio de pancreatitis aguda, se localizan dentro o fuera del páncreas y carecen siempre de una pared fibrosa.
d. Pseudoquiste agudo, es una colección de líquido pancreático rodeada por una pared sin epitelio.
e. Absceso pancreático: colección purulenta, generalmente localizada en la vecindad del páncreas, contiene por lo general una mínima cantidad de tejido necrótico.
Nomenclatura 1. Procesos patológicos que se asocian a la pancreatitis.
a. Obstrucción del conducto pancreático. Litiasis biliar, tumores de los conductos pancreáticos o de la ampolla de Vater, cuerpos extraños, parásitos, páncreas divisum, coledococele, divertículos duodenales periampulares, estenosis o espasmo del esfínter de Oddi.
b. Toxinas. Etanol, alcohol metílico, veneno del escorpión, insecticidas orgánicos fosforados. Drogas: azatioprina, 6- mercapto-purina, ácido valproico, estrógenos, tetraciclinas, metronidazol, nitrofurantoína, pentamidina, furosemida, sulfas, metildopa, antagonistas H2 de la histamina, didanosina, eritromicina, salicilatos, etc.
c. Traumas. Quirúrgicos, accidentales, colangiopan-creatografia endoscópica.
d. Alteraciones metabólicas. Hiperlipidemia, posiblemente hipercalcemia.
e. Infecciones. Por parásitos (áscaris), virus (paperas, rubéola, hepatitis, adenovirus, coxsackie,etc.), bacterias (micoplasma, campilobacter yeyuni, micoplasma tuberculosis, M. avium intracellulare, legionella, etc.).
f. Isquemia. hipoperfusión (shock hipovolémico), embolias arterioescleróticas, vasculitis.
Cuadro clínico y complicaciones de la Pancreatitis Aguda
En la mayoría de los pacientes la pancreatitis se presenta con dolor abdominal y elevación de los niveles plasmáticos de amilasa y lipasa. En una minoría de los casos el cuadro es silencioso y sólo se hace el diagnóstico en presencia de alteraciones de las enzimas plasmáticas luego de un episodio de shock o sepsis. Es importante para el tratamiento adecuado la detección y diagnóstico precoz de las complicaciones de la pancreatitis que pueden ser locales o sistémicas.
Las complicaciones tempranas se desarrollan dentro de las primeras horas a la primera semana de la enfermedad. Estas complicaciones incluyen shock, asociado con el secuestro masivo de fluidos, con acidosis metabólica severa, alteraciones hidroelectrolíticas e insuficiencia renal.
Las complicaciones pulmonares son la principal causa de muerte dentro de los primeros 7 días del curso de la enfermedad; hay alteraciones en la capacidad de difusión, disminución de la elasticidad pulmonar, aumento en las resistencias ventilatorias y disminución de la capacidad vital (36).
En la siguiente semana las complicaciones que se desarrollan en el curso de la pancreatitis son casi todas secundarias a infección pancreática. Esta infección pueden clasificarse como:
1) Necrosis pancreática infectada, que hace referencia a una infección focal o difusa del parénquima pancreático no viable.
2) Absceso pancreático, definido como una colección purulenta localizada en la celda pancreática. Por lo general, este material contiene muy poca necrosis pancreática. )span>La infección secundaria del páncreas habitualmente por gérmenes Gram negativos, con mayor frecuencia Escherichia coli derivados del intestino por translocación bacteriana (37); durante el episodio de pancreatitis es la responsable del 80% de las muertes tardías en pacientes con pancreatitis aguda. La infección de la necrosis pancreática se presenta entre el 8 y el 12% de la pancreatitis aguda y en el 30 al 40% de los pacientes con pancreatitis necrotizante.
Estratificación de la severidad de la pancreatitis
Desde 1974 Ranson (38) describió sus once criterios que todavía se siguen aplicando y tomando como punto de referencia para evaluar la severidad de la pancreatitis (Tabla 1). Con mayor frecuencia se aplica en los centros hospitalarios el APACHE II (Acute Physiology Health Evaluation) (39).

De acuerdo con la clasificación de Atlanta (35) se considera una pancreatitis como severa cuando tiene 3 o más criterios de Ranson u 8 o más criterios del APACHE II. Se considera que existe falla multiorgánica cuando aparecen las siguientes alteraciones:
Diagnóstico de la Pancreatitis Aguda
Hay dos reglas de oro para el diagnóstico de la pancreatitis aguda: pensar en ella para establecer el diagnóstico y, habiéndolo realizado, definir el factor desencadenante del episodio (40). La primera es de importancia inmediata en el momento del ingreso del paciente; una vez establecido el diagnóstico las medidas de monitoreo y soporte del paciente pueden iniciarse; posteriormente deben realizarse los estudios tendientes a aclarar la etiología que inició el proceso de la enfermedad.
Una gran cantidad de posibles marcadores plasmáticos de la severidad de la pancreatitis han sido estudiados, pero sus procesos de evaluación no han sido lo suficientemente rigurosos para que permitan su aplicación de manera fácil y rutinaria en la práctica clínica; dentro de ellos los más estudiados se enumeran en la Tabla 2 (41).
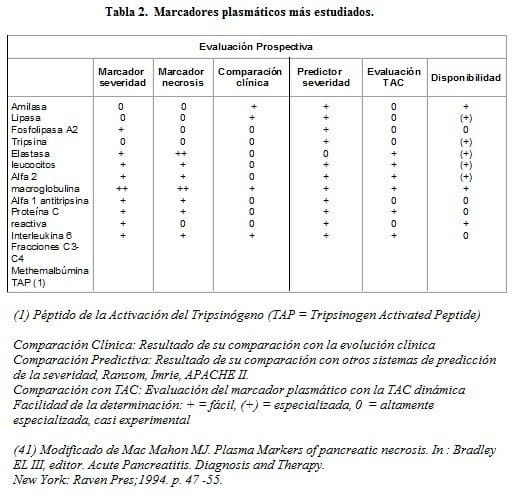
Con la excepción del informe de Buchler (42) y col, hay muy poca evidencia de que alguno de los marcadores plasmáticos citados, pueda compararse con la Proteína C reactiva como marcador de severidad de la pancreatitis, principalmente en aquellos centros hospitalarios que no cuentan con el recurso de la tomografía axial computadorizada.
Una nueva prueba de l aboratorio que consiste en la medición del péptido de la activación del tripsinógeno (TAP = tripsinogen activated peptide) parece ser promisorio en este sentido. Este péptido que resulta habitualmente de la activación intraduodenal del tripsinógeno por la enteroquinasa, normalmente se pierde en el contenido intestinal. Sin embargo, cuando hay activación intrapancreática, como ocurre en la pancreatitis aguda, este péptido se puede determinar en sangre, líquido ascítico u orina. La medición del TAP en la orina durante las primeras 48 h de admisión revela que tomando valores de 10 mmol\L como límite se observó una sensibilidad del 100% con especificidad del 88% en la detección de pancreatitis severas. Por otra parte, el valor predictivo negativo para pancreatitis moderadas fue de 100% (43).
Evaluación de la pancreatitis. Valor de la tomografía axial computadorizada (TAC)
En las pancreatitis que no tienen obvios signos de severidad la tomografía axial computadorizada no está indicada, con lo cual se disminuye el costo del tratamiento. Si existen dudas en las primeras horas de evolución, hay indicación de realizarla y la severidad de las alteraciones del páncreas y tejidos vecinos observados en la TAC tienen valor pronóstico (44) comparable según muchos autores con los criterios clínicos de Ranson y cols. (Tabla 3).

En las pancreatitis severas con alteraciones importantes la tomografía dinámica con inyección rápida de medio de contraste intravenoso, permite detectar áreas de necrosis e hipoperfusión, que no captan o captan menos el medio de contraste (45).
La extensión de la necrosis pancreática guarda proporción con la morbilidad y la mortalidad; necrosis menores del 30% de la superficie del páncreas no tienen mortalidad y presentan una morbilidad del 40%. Necrosis extensas, mayores del 50% se asocian con una alta mortalidad y morbilidad. (46).
En 1987 Gersof (47) describe la punción y aspiración con aguja fina de las necrosis, dirigida por tomografía con el fin de establecer la presencia de infección en estas áreas mediante coloración de Gram y cultivo del aspirado lo que ha servido para demostrar infección muy precozmente e iniciar terapia antibiótica (48). No es una técnica que necesariamente deba usarse en todos los casos de pancreatitis aguda, pero ciertamente es de utilidad en casos que muestran síntomas y signos de compromiso sistémico.
Infección de la necrosis pancreática
La infección de la pancreatitis se presenta en 5 a 10% de los casos, y la Escherichia coli y otros gérmenes de tipo coliforme son los principales microorganismos encontrados, lo que sugiere que el colon es la principal fuente de estos patógenos (49). Sin embargo, la misma flora es saprofita en algunos órganos y patógena en otros.
En el modelo experimental se pudo demostrar que hay translocación y colonización por vía hematógena de gérmenes del tipo coliforme a partir de la vesícula biliar, tracto urinario y colon, encontrando que la colonización del páncreas fue menor en los modelos experimentales empleados como control, sin pancreatitis, que en aquellos en los que se indujo. Esto sugiere que los microorganismos pueden translocar al órgano normal, pero son depuradas de manera más eficiente que en el páncreas inflamado (50).
Gran parte de los organismos que penetran en la circulación durante una bacteremia son rápidamente depurados de la circulación por los fagocitos del sistema retículo endotelial; una buena cantidad de gérmenes colonizan órganos que no son infectados si las defensas del huésped se encuentran normales. Sin embargo, si hay isquemia o necrosis la infección se desarrolla.
Esto puede ocurrir, porque la inflamación facilita la propagación bacteriana al páncreas, o hay alteración en los mecanismos sistémicos de defensa, o por una combinación de las dos; los fagocitos son fundamentales para el control de la infección por vía hemática como parte de la respuesta a la invasión bacteriana de los tejidos, no sólo fagocitan bacterias, sino que regulan la actividad linfocítica produciendo antígenos que son fundamentales para su activación (51).
En situaciones de normalidad, las bacterias son rápidamente depuradas de la sangre por los fagocitos; sin embargo, su capacidad para remover partículas, incluidas las bacterias, es saturable. Experimentalmente no se ha podido demostrar, pues los modelos experimentales mueren de septicemia, antes de que esta capacidad de fagocitosis se sature (52).
De otra parte el complejo proteasa-antiproteasa que se forma durante la pancreatitis aguda es tratado de igual manera por el sistema fagocítico, siendo eliminado rápidamente de la circulación. Se plantea que la liberación exagerada de proteasas a la circulación, que ocurre durante el proceso de pancreatitis aguda, al ser captado por el sistema fagocítico, puede interferir, compitiendo con la depuración bacteriana por parte de las células fagocíticas, disminuyendo su actividad en el proceso de control de la invasión por microorganismos. De hecho en los tejidos pancreático y peripancreático, en donde la concentración esperada de proteasas es mayor, su susceptibilidad a la colonización y subsecuente infección es mayor (53).
Absceso pancreático
En la evolución de un cuadro de contaminación peritoneal hay que tener en cuenta que esta entidad suele ser una infección polimicrobiana y que ciertos datos inducen a creer que algunas bacterias interactúan con el huésped con el fin de sobrevivir en la cavidad peritoneal, más aún cuando se ha demostrado que la combinación de gérmenes aerobios y anaerobios lleva con facilidad a la formación de abscesos intraabdominales (54 – 56).
Esta naturaleza polimicrobiana de la infección intraabdominal representa un verdadero sinergismo entre los gérmenes responsables de la infección, manifestado entre otros aspectos por el tipo bifásico que presentan las peritonitis.
En una primera etapa que se extiende por lo general del primero al séptimo día de evolución, predominan los fenómenos de sepsis provocados en gran medida por las endotoxinas bacterianas de los gérmenes Gram negativos, específicamente la Escherichia coli; en la medida en que los mecanismos de defensa del peritoneo consumen oxígeno, la concentración de este gas dentro de la cavidad abdominal disminuye, permitiendo la proliferación de gérmenes anaerobios, estableciéndose la fase de formación de abscesos del quinto al séptimo día en adelante (57).
Estudios realizados en el modelo animal de experimentación demostraron que la introducción de Bacteroides fragilis o Fusobacterias como germen único dentro de la cavidad peritoneal (56) o por infusión intravascular directa (58, 59) no demostraron ninguna secuela infecciosa, sin que se establecieran fenómenos de sepsis o de formación de abscesos y con 0% de mortalidad.
Si el germen inoculado fue el Enterococo, grampositivo aeróbico, los resultados fueron similares. Si el inóculo bacteriano fue de Escherichia coli como germen único, se obtuvo la reproducción de la fase séptica con una mortalidad de 30% de los especímenes de laboratorio (56).
Los mismos investigadores demostraron claramente un sinergismo y exacerbación de la infección con reproducción de la fase séptica y de formación de abscesos si se combinaban E. coli y B. fragilis dentro de la cavidad peritoneal (56). Varios estudios controlados realizados en animales han demostrado que el empleo de antibióticos sistemicos contra estos dos microorganismos determina un incremento en las ratas de supervivencia y una disminución en las de formación de abscesos (60,61).
Tratamiento antibiótico
Aunque su utilidad es debatida, el empleo de antibióticos aparece predominantemente en el listado de medicamentos ordenados para el tratamiento de la pancreatitis aguda. Es bien conocido que 80% de las muertes por pancreatitis aguda se debe a la infección, que se incrementa en la medida en que el porcentaje de tejido pancreático necrótico aumenta, generado por microorganismos de tipo entérico por translocación bacteriana (23). Por lo tanto, al indicar el antibiótico se deben tener en cuenta varios aspectos:
Espectro que cubra la flora entérica, principalmente del grupo coliforme solo o asociado con otras enterobacterias, del género Klebsiella, Pseudomona, Enterococcus y Bacteroides.
Penetración del antibiótico en el páncreas, en este aspecto la lipo-solubilidad parece ser de fundamental importancia para el paso a través de la estructura lipídica de la membrana celular. Dentro de estos aparecen con mejor liposolubilidad las fluoroquinolonas (62), el cefoxitin (63), la clindamicina (64), el metronidazol (65) y el imipenem (62,66). Los aminoglucósidos llegan al fluido pancreático en concentraciones adecuadas luego de 6 a 8 horas de administrados (63).
Penetración del antibiótico en el tejido necrótico de la pancreatitis aguda: en este aspecto el metronidazol, la pefloxacina y el imipenem aparecen como los antibióticos que mejor penetran en el tejido necrótico del páncreas (67).
Papel de la cirugía
A la luz del conocimiento actual y de la universalización de la medicina, el paciente con pancreatitis aguda requiere para su tratamiento un equipo multidisciplinario en el que participen el especialista en cuidado intensivo, un gastroenterólogo intervencionista, el grupo de soporte nutricional, el infectólogo y el cirujano. La decisión quirúrgica se debe tomar luego de un análisis concienzudo de este equipo, cuando no hay respuesta a la terapia médica, hay evidencias claras de infección o deterioro progresivo del paciente a pesar de las medidas de soporte adecuadas.
La intervención se encuentra orientada al tipo de complicación infecciosa de la pancreatitis aguda ya definidas anteriormente, absceso pancreático o necrosis pancreática, que son dos entidades completamente diferentes, aspecto en el que ya hemos insistido con anterioridad (30, 40). Es factible drenar un absceso pancreático por laparoscopia, pero no es posible que mediante este procedimiento se logre la evacuación adecuada de una necrosis pancreática, y fundamentalmente, a este tipo de complicación de la pancreatitis quiero referirme a continuación.
Se acepta universalmente que existen cuatro indicaciones absolutas para la intervención quirúrgica en la pancreatitis necrotizante:
1. Si se encuentra asociada a falla multiorgánica
2. Si es una necrosis extensa
3. Si se encuentra infectada
4. Si se encuentra asociada a patología biliar.
Surge la inquietud de si se deben intervenir las necrosis pancreáticas estériles; en el pasado esa pudo ser la conducta y posiblemente muchas de las pancreatitis necróticas que intervinimos hace unos años se encontraban en este estado; posteriormente una serie de estudios retrospectivos sugirieron que algunos casos con necrosis estériles se beneficiaron del manejo conservativo (68, 69), y con el recurso de la aspiración de la necrosis mediante punción dirigida por tomografía para definir si se encuentran o no infectadas (47) se puede en el momento contemporizar con estos pacientes, siempre y cuando no cursen con falla multiorgánica.
Beger (69) recomienda intervenir las pancreatitis necróticas estériles cuando el paciente se encuentre en shock, con masa abdominal palpable por más de 8 días o cuando presente falla orgánica persistente a pesar de soporte adecuado en la unidad de cuidado intensivo.
Por el contrario, no existe ninguna duda en intervenir un paciente con pancreatitis necrótica infectada; el procedimiento que conviene seguir ya se ha depurado, se han abandonado las pancreatectomías totales que en algún momento se propusieron, se mantienen con resultados similares la técnica del lavado del fondo de saco menor propuesta por Beger (69) y aplicada por Larvin (70) mediante una necrosectomía inicial y colocación de catéteres para irrigación y drenaje continuos y la laparostomía con empaquetamiento (71) propuesta por los dos procedimientos con mortalidades que oscilan entre 15 y 25%.
El absceso pancreático se puede considerar una complicación tardía de la pancreatitis aguda, sus características ya fueron definidas en la Clasificación de Atlanta, y la mortalidad derivada de esta complicación es sensiblemente menor que la de la necrosis infectada. Su tratamiento oscila entre el drenaje percutáneo dirigido por tomografía, con control periódico mediante la realización de abscesografías (72) o mediante el drenaje quirúrgico abierto marsupializando la colección a través del fondo de saco menor (73).
Abstract
In spite of the availability of wide therapeutic options in the management of biliopancreatic sepsis, morbidity and mortality rates remain high. Therapeutic conduct differs wether the septic focus in located in the biliary tree or in the pancreatic region, and includes, in the former situation, obstruction of the bile conduit. In the case of pancreatic sepsis, drainage and debridement are warranted. In both situations, adequate antibiotic management and measures of systemic support, such as good oxygenation, maintenance of intravascular volume, and hemodynamic, renal and ventilatory support are mandatory. Antibiotic therapy must be oriented against enteric organisms, such as Escherichia coli and anaerobic organisms, such as Bacteroides fragilis.
Referencias
1. Chock E, Wolfe BM, Matolo NM: Acute Suppurative Cholangitis. Surg Clin North Am 1981 Aug; 61 (4): 885 B 92
2. Hinchey EJ, Couper CE: Acute obstructive suppurative cholangitis. Am J Surg 1969 Jan; 117(1): 62 – 8
3. Hinshaw DB: Acute obstructive suppurative cholangitis. Surg Clin North Am 1973 Oct; 1089 – 94
4. Raraty MG, Finch M, Neoptolemos JP: Acute cholangitis and pancreatitis secondary to common duct stones: management update. World J Surg 1998 Nov; 22 (11):1155-61
5. Kappoor VK, Pradeep K, Haribhakti SP, et al: Intrahepatic segment III cholangiojejunostomy in advanced carcinoma of the gallbladder. Br J Surg 1996 Dec; 83 (12): 1709-11
6. Molés JR, Hoyos García M, Ramírez Palanca JJ, et al: Surgery of benign obstruction of the bile tract. Current opinion status. Rev Esp Enferm Dig 1996 Dec; 88 (12):847-50
7. Yamaoka K, Tazawa J, Koizumi K, Asahina Y, et al: Choledochocele with obstructive jaundice: a case report and a review of the japanese literature. J Gastroenterol 1994 Oct; 29 (5): 661- 4
8. Chaudary A, Dhar P, Sachdev A, et al: Choledochal cysts – differences in children and adults. Br J Surg 1996 Feb; 83 (2) 186-8
9. Sandouk F, Haffar S, Zada MM, Graham DY, Anand BS: Pancreatic-biliary ascariasis: experience of 300 cases. Am J Gastroenterol 1997 Dec; 92 (12):2264-7
10. Jordan PH Jr: Physiology of bile secretion. Am J Surg 1984 Oct; 107: 367B70
11. Raper SE, Barker ME, Jones AL, Way LW: Anatomic correlates of bacterial cholangiovenous reflux. Surgery 1989 Mar; 105 (3):352-9
12. Stewart L, Pellegrini CA,.Way LW: Cholangiovenous reflux pathways as defined by corrosion casting and scanning electron microscopy. Am J Surg 1988 Jan; 155 (1):23- 8
13. Wetter LA, Hamadeh RM, Griffiss JM, Oesterle A, Aagaard B, Way LW: Differences in outer membrane characteristics between gallstone-associated bacteria and normal bacterial flora. Lancet 1994 Feb; 19, 343(8895):444-8
14. Rintoul R, O=riordain GO, I . F, Laurenson IF, et al: Changing management of pyogenic liver abscess. B J Surg 1996 Dec; 83 (12) 1215-8
15. Lau JYW, Ip SM, Chung CS, et al: Endoscopic drainage aborts endotoxaemia in acute cholangitis. Br J Surg 1996 Feb; 83 (2): 181. 4
16. O=Connor MJ, Schwartz ML, McQuarrie DG: Cholangitis due to malignat obstruction. Ann Surg 1981 Jan; 193: 341 B 5
17. Thompson JE, Pitt HA, Doty JE: Broad spectrum penicillin as adequate therapy for acute cholangitis. Surg Gynecol Obstet 1990 Oct; 171: 275 B 80
18. Lipsett PA: Acute cholangitis. Surg Clin North Am 1990 Dec; 70(6): 1297-312
19. Gigot JF, Leese T, Dereme T, et al: Acute cholangitis. Multivariate analysis of risk factors. Ann Surg 1989 Apr; 209 (4):435-88
20. Pessa ME, Hawkins IF, Vogel SB: The treatment of acute cholangitis. Percutaneous transhepatic biliary drainage before definitive therapy. Ann Surg 1987 Apr; 205(4):389-92
21. Lai EC, Lo CM, Choi TK, et al: Urgent biliary decompression after endoscopic retrograde cholangiopancreatography. Am J Surg 1989 Jan; 157 (1):121-5
22. Nieto JA: Pancreatitis Aguda – En vísperas del Siglo XXI. Rev Colomb Cir 1999; 14 (3): 174 – 84
23. Steer ML, Meldolesi J: The cell biology of experimental pancreatitis. N Engl J Med 1987 Jan; 316:144-50
24. Figarella C, Amouric M, Guy Crotte O: Enzyme activation and liberation: intracellular and extracellular events. In: Beger HG, Buchler M, editors. Acute pancreatitis: research and clinical management. Berlin, Germany: Springer-Verlag; 1987. p. 53-60
25. Quon M, Wisner JR, Chandrasoma P, Valenzuela JE: Chronic ethanol comsumption intensifies caerulein-induced pancreatitis in the rat. Inter J Pancreatol 1992; 12: 31- 9
26. Banerjee AK, Steele RJC: Current views on the pathophysiology of acute biliary pancreatitis. Gut 1995 May; 36:803-5
27. Havel RJ: Pathogenesis, differentiation and management of hypertrigliceridemic. Adv Med Int 1969 Jan; 15: 117 – 20
28. García F, Méndez CG, Arteta DS: Pancreatitis aguda en el Hospital Universitario de Cartagena. Estudio de 224 casos. 1976 – 1989. Rev Colomb Gastroenterol 1991: 6 (3): 163- 71
29. Reyes R, Gómez M: Pancreatitis aguda, revisión de 48 casos de 1968 a 1973. Temas Escogidos de Gastroenterología 1975; 18: 185 -95
30. Nieto JA, Castelblanco J, Pimiento H: Pancreatitis aguda. Casuística del Hospital Militar Central de Bogotá. Rev Colomb Cir 1989; 4 (2): 102 – 10
31. McCutcheon Ad: Reflux of duodenal contents in the pathogenesis of pancreatitis. Gut 1964: 5: 260 -5
32. Cavuoti PO, Moody FG, Martínez G: Role of pancreatic duct occlusion with prolamine (Ethibloc) in necrotizing pancreatitis. Surgery 1988 Mar; 103: 261. 6
33. Senninger N, Moody FG, Van Buren DH, Coelho JCU, Li YF: Effect of biliary obstrucction on pancreatic exocrine in conscious opossum. Surg Forum 1984; 35: 226 – 8
34. Steinberg W, Tenner S: Acute pancreatitis. N Engl J Med 1994 Nov; 330:1198-210
35. Bradley EL III: A clinically based classification system for acute pancreatitis: summary of the international symposium on acute pancreatitis, Atlanta 1992. Arch Surg 1993; 128:586-90
36. Nath BJ, Warshaw Al: Pulmonary insuficiency. In: Bradley EL, editors Complications of pancreatitis. Medical and surgical management. 1 ed. Philadelphia: W.B.Saunders; 1982. p. 51. 71
37. Moody F.G., Haley D., Muncy D.M: Intestinal transit and bacterial translocation in obstructive pancreatitis. Dig Dis Sci 1995; 40: 1798 – 804
38. Ranson JHC, Pasternack BS: Statistical methods for quantifying the severity of clinical pancreatitis. J Surg Res 1977 Feb; 22:79-91
39. Wilson C, Heath DI, Imrie CW: Prediction of outcome in acute pancreatitis : a comparative study of APACHE II, clinical assessment and multiple factor scoring systems. Br J Surg 1990 Nov; 19: 849-61
40. Nieto JA: Pancreatitis Aguda. Cirugía y Hospital. Schering Plough 1992; 1: 17 B 20
41. Mac Mahon MJ: Plasma Markers of pancreatic necrosis. In : Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres ; 1994. p. 47 -55
42. Buchler M, Malfertheiner P, Schoetensack C, et al: Sensitive of antiproteases, complement factors and C-reactive protein in detecting pancreatic necrosis: results of a prospective clinical study. Int J Pancreatol 1986 Oct; 1: 227- 35
43. Tenner S, Fernández-del Castillo C, Warshaw A, et al: Urinary trypsinogen activation peptide (TAP) predicts severity in acute pancreatitis. Int J Pancreatol 1997 Apr; 21 (2):105-10
44. Balthazar EJ: CT diagnosis and staging of acute pancreatitis. Radiol Clin North Am 1989 Jan; 27:19-37
45. Kivisaari L, Somer K, Standetskjold-nordenstam C-G, et al: Early detection of acute fulminant pancreatitis by contrast-enhanced computed tomography. Scan J Gastroenterol 1983 Jan; 18:39-41
46. Balthazar EJ: Contrast- Enhanced Computed Tomography in severe acute pancreatitis. In : Bradley EL III, editor Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres; 1994. p. 57 – 68
47. Gersof S, Banks PA, Robbins AH, et al: Early diagnosis of pancreatic infection by computed tomography-guided aspiration. Gastroenterology 1987 Dec; 93: 1315 – 20
48. Banks PA, Gerzof SG, Chong FK, Worthington MC, Doss WG, Sullivan JG, Johnson WS: Bacteriologic status of necrotic tissue in necrotizing pancreatitis. Pancreas 1990 May; 5:330-3
49. Meyer P, Robert J, Clavien PA: Conservative treatment of acute pancreatitis. Hepatogastroenterology 1991: 38; 124 – 8
50. Reber HA, Widdison AL: Patogenesis of Infected Pancreatic Necrosis. In : Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres; 1994. p. 85 – 92
51. Christou NV, Meakins JI: Neutrophils function in surgical patient: in vitro correction of abnormal neutrophil chemotaxis by levamisole. Surgery 1979: 85; 543 – 8
52. Border JR: Hypothesis: sepsis, multple organ failure, and the macrophage. Arch Surg 1988: 123; 285 – 6
53. Sjolund B, Lasson A, Ohlsson K: The elimination of trypsin – macroglobulin complex from de bloodcirculation in pigs during acute pancreatitis and after massive intravenous trypsin infusion. Scand J Clin Lab Invest 1987: 47; 131 – 41
54. Mosdell DM, Morris DM, Voltura A, et al: Antibiotic treatment for surgical peri-tonitis. Ann Surg 1991 Nov; 214 (5):543-9
55. Onderdonk AB, Weinstein WM, Sullivan NM, et al: Experimental intraabdominal abscesses in rats: Quantitative bacteriology of infected animals. Infect Immun 1974 Dec; 10 (6): 1256 – 61
56. Onderdonk AB, Bartlett JC, Louie T, et al: Microbial synergy in experimental intraabdominal abscess. Infect Immun 1976 Jan; 13 (1): 22-6
57. Maddaus MA, Arenholz D, Simmons RL: The Biology of Peritonitis and Implication for Treatment. Surg Clin North Am 1988 Nov;(68): 641 – 3
58. Fry DE, Kaelin CR, Rink RD: Oxidative metabolism in experimental Bacteroides fragilis bacteremia. J Surg Res 1980 Jun; 28:501-6
59. O’Donnell TF Jr, Connolly RA, Gorbach SL, et al. The circulatory effects of an acute infusion of anaerobes in a rabbit model. Surg Gynecol Obstet 1980 Dec; 151(6) :735-9
60. Weinstein WM, Onderdonk AB, Bartlett JG, et al: Antimicrobial treatment of experimental intraabdominal sepsis. J Infect Dis 1975 Sep;132 (3): 282-6
61. Nichols RL, Smith JW, Fossedal EW, et al: Efficacy of parenteral antibiotics in the treatment of experimentally induced intraabdominal sepsis. Rev Infect Dis 1979 Mar; 1:302-9
62. Büchler M, Malfertheiner P, Friess H, et al: Human pancreatic tissue concentration of bactericidal antibiotics. Gastroen-terology 1992 Dec; 103 (6): 1902-8
63. Tyden G, Malmorg AS: Penetration of antibiotics into pancreatic juice. Lancet 1985 May; 1:1046 B 7
64. Hershey SD, Sugawa C, Cushing R, et al: The value of prophylactic antibiotic theraphy during endoscopic retrograde cholangiopancreatography. Surg Gynecol Obstet 1982 Dec; 155: 801 – 3
65. Wallace JR, Johnson J, Lucas CE: Assessment of pancreatic ductal penetration of antibiotics. Am J Surg 1984 Dec; 50: 66-7
66. Brastrom C, Malmborg AS, Tyden G: Penetration of imipenem in human pancreatic juice following single intravenous administration. Chemo-therapy 1989 Jan; 35: 83- 7
67. Bassi C, Pederzoli P: Antibiotics in necrotizing pancreatitis. In: Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres ;1994. p. 93-9
68. Neoptolemos JP, Hall AW, Finlay DF, et al: The urgent diagnosis of gallstones in acute pancreatitis: a prospective study of three methods. Br J Surg 1984 Mar; 71:230-3
69. Beger HG, BüchlerM, Bittner R: Necrosectomy and postoperative local lavage in patientes with necrotizing pancreatitis. World J Surg 1988 Apr; 12:255- 62
70. Larvin M, Chalmers AG, Robinson PJ: Debridment and closed cavity irrigation for the treatment of pancreatic necrosis. Br J Surg 1989 May; 76: 465 – 71
71. Bradley EL III: Management of infected pancreatic necrosis by open drainage. Ann Surg 1987 Oct; 206; 542-50
72. Van Sonnenberg E: Percutaneous therapy for pancreatic abscess. In: Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres; 1994. p. 161 – 4
73. Frey CF: Surgical management of pancreatic abscess. In: Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres ; 1994; 165 – 71.
Correspondencia:
Doctor Julio Alberto Nieto Silva. Dirección Científica, “Clínica Nueva”. Bogotá, D.C.
