DE LA HOZ J., MD, SCC (Hon).
Palabras clave: Diabetes, Insulina, Páncreas, Glucosa, Metabolismo, Cuerpo cetónico.
Diabetes y Complicaciones del Sistema Gastrointestinal
Los desórdenes gastrointestinales son comunes en pacientes con diabetes mellitus. Se estima que más del 65% de los diabéticos pueden tener síntomas digestivos directamente relacionados con los efectos de la neuropatía diabética (82).
El cuadro se acompaña de un espectro de manifestaciones severas a moderadas. Los trastornos pueden consistir en disfagia, ardor retroesternal, náuseas, vómitos, dolor abdominal, constipación, diarrea e incontinencia fecal.
Muchos presentan alteraciones pasajeras en su función gastrointestinal durante períodos de desarreglos metabólicos o durante la cetoacidosis diabética; la dilatación del estómago es posible que ocurra en forma aguda en el transcurso de esta última, y se resuelve completamente con el paso de una sonda nasogástrica y la corrección de la acidosis. En algunos casos de insuficiencia renal, la hipermagnesemia es causa de parálisis intestinal. Las complicaciones gastrointestinales no deben adscribirse a la diabetes, hasta cuando hayan sido excluidas otras causas (77).
Las anormalidades gastrointestinales pueden ser debidas a trastornos motores o sensitivos, secundarios a neuropatía o a desarreglos metabólicos por los niveles elevados de glucosa en el suero. Es probable, que otros factores, como irregularidades en la secreción y absorción intestinal, así como en la función exocrina pancreática, desempeñen un componente de importancia.
La motilidad alterada en la diabetes parece ser el resultado de una disfunción simpática y denervación colinérgica o «autovagotomía». El daño parece ser prevaleciente en el simpático posganglionar, en el ganglio simpático y en los plexos adrenérgicos intramurales. Esta lesión probablemente contribuye a la incontinencia fecal nocturna, debido a la pérdida del tono del esfínter anal interno. La disfunción vagal es crítica en la estasis gástrica, pero aún no está claro si el tránsito intestinal rápido y la diarrea, resultan de la vagotomía o de la pérdida del «freno» simpático (50). Parece ser, que los síntomas clínicos de la disfunción autónoma se ven más frecuentes en los diabéticos tipo 1, en los que tienen un pobre control de sus niveles de glucosa, en los más viejos y en los que tienen evidencia de neuropatía periférica.
La falta de control de los niveles sanguíneos de glucosa, también pueden alterar las hormonas contrarreguladoras, algunas de las cuales, afectan directamente la motilidad gastrointestinal incluyendo glucagón, epinefrina, somatostatina, hormona del crecimiento y cortisol. Los efectos del daño de los nervios autónomos en la liberación de estos y otros neurotrasmisores, también pueden contribuir a la disfunción motora.
Todos los diabéticos pueden ser cuidadosamente seleccionados para administrarles determinadas drogas y sus posibles efectos colaterales. Los antiácidos que contienen aluminio o magnesio, son usados con frecuencia por los diabéticos, lo que les puede ocasionar diarrea, mientras que los que contienen carbonato de calcio, se asocian a constipación intestinal. Aquellos con función renal deteriorada son, en ocasiones, incapaces de excretar el aluminio o el magnesio, lo que ocasiona hipermagnesemia e intoxicación por aluminio, por el uso crónico de dichos antiácidos. El uso de los antagonistas de los receptores H2, necesitan ser ajustados en los urémicos. Se prefiere la Ranitidina porque es metabolizada y excretada por el hígado.
Disfunciones esofágicas
Las disfunciones del esófago son frecuentemente descritas en los diabéticos con neuropatías periféricas y coexisten con gastroparesia (89). Son debidas a disfunción autónoma y no a irregularidades en la función de la musculatura lisa. Los estudios señalan daños en el nervio vago. Cuando, a pesar de esta lesión, los síntomas no se manifiestan, lo más probable es que exista también una sensibilidad aferente alterada por la neuropatía (24). Cuando los síntomas están presentes, típicamente son, disfagia, ardor retroesternal y dolor torácico.
Los hallazgos manométricos descritos con más frecuencia son, hipotonicidad del esfínter esofágico inferior, amplitud disminuida de las contracciones, aperistalsis y demora del tránsito en el cuerpo del esófago. Las alteraciones orofaríngeas son raras; si existen síntomas de disfagia a este nivel, se debe investigar enfermedad cerebrovascular, miastenia gravis o esclerosis lateral amiotrófica.
El reflujo gastroesofágico está presente en el diabético con neuropatía, debido a la incompetencia del esfínter esofágico inferior. La odinofagia en esta población debe ser cuidadosamente evaluada; debe investigarse esofagitis por cándida, hasta probar lo contrario. La endoscopia con biopsia y cepillado, es la prueba diagnóstica disponible más sensible y específica. El tratamiento de elección se adelanta con fluconasol. El ketoconasol puede no ser efectivo por mala absorción si existe aclorhidria por terapia ácido-supresiva concurrente.
Disfunciones gástricas
La gastroparesia es uno de los desórdenes más comunes de la motilidad observados en la diabetes, y afecta el 55% de los diabéticos (38). La retención gástrica es una de sus complicaciones. Los síntomas como saciedad temprana, pérdida de peso, anorexia, náuseas, vómitos y molestias epigástricas se desarrollan en forma insidiosa.
La escintigrafía con radiotrazador, después de la ingestión de una comida sólida, documenta la evacuación gástrica y cuantifica la respuesta a los agentes proquinéticos (65). Para su evaluación se hace indispensable una gastroduodenoscopia para descartar otras entidades gástricas.
La gastroparesia diabética, parece ser el resultado directo de una enfermedad crónica, asociada a neuropatía periférica y autónoma, a retinopatía y nefropatía (18). Un desequilibrio hormonal también juega un papel en la gastroparesia diabética. Existen niveles basales elevados de motilina, los cuales disminuyen con la administración de insulina (27). Estos niveles elevados son compensatorios de la frecuente disminución de los complejos motores migratorios. Cuando la gastroparesia es tratada con la metoclopramida, se estimula la actividad de esos complejos motores y se observa la disminución de los niveles de motilina (1).
Las contracciones antrales posprandiales pueden estar disminuidas en número y amplitud. Con la disfunción antral se presenta espasmo pilórico, que explica las náuseas y el vómito recurrente.
La terapia de la gastroparesia es compleja; quizá una etapa importante en ella, sea el control rígido de los niveles sanguíneos de azúcar. Los antieméticos han sido ensayados con beneficios limitados. El tratamiento debe contemplar modificaciones en la dieta, como comidas pequeñas frecuentes y el uso de suplementos líquidos. Se aconseja una dieta baja en residuos, para evitar la formación de bezoares.
La metoclopramida fue uno de los primeros agentes usados en la gastroparesia diabética. Dada en dosis de 10 mg 30 minutos antes de cada comida, es efectiva porque tiene propiedades antieméticas, estimula la liberación de acetilcolina en el plejo mientérico y es un antagonista dopaminérgico. Actúa coordinando la relajación pilórica, el peristaltismo duodenal y la contracción del músculo liso gástrico, acelerando así su evacuación (16). Por sus efectos colaterales sobre el sistema nervioso central, su uso se limita a corto tiempo.
La cisaprida es el más nuevo agente proquinético para ser usado en la gastroparesia, debido a que incrementa la motilidad gastrointestinal al estimular la liberación de acetilcolina en las neuronas posganglionares mientéricas. Normaliza la actividad antral tanto en ayuno como con el alimento. Acentúa la coordinación antroduodenal y activa la motilidad del intestino delgado (42).
La eritromicina es un antibiótico que tiene un potente efecto estimulador sobre los receptores gastrointestinales del motilín. Ha demostrado ser efectiva al acelerar la evacuación gástrica (41). Puede usarse si el cuadro es agudo, por vía intravenosa (250 mg durante 20 minutos cada 8 horas). Hay pacientes que presentan taquifilaxis, que obliga al retiro de la droga por un tiempo hasta cuando la acción estimulante retorne. En la diabetes de vieja data, la gastritis atrófica autoinmune, también se ha observado y se asocia a altos niveles de anticuerpos antitiroideos y anticélulas parietales. Esta condición puede llevar a una elevada incidencia de hipotiroidismo y anemia perniciosa.
Con frecuencia en los diabéticos existe reducida secreción de ácidos. Su patogénesis es multifactorial y en ella participan, un efecto inhibitorio de la hiperglicemia sobre la producción ácida; disminución del tono vagal secundario a la neuropatía autónoma; disminución de la sensibilidad a la estimulación de la gastrina, y la gastritis crónica.
Disfunciones intestinales
La motilidad intestinal también se altera en la diabetes. La amplitud y frecuencia de las contracciones, están disminuidas; el complejo motor migratorio es anormal o ausente; prolongación de la fase II del estado de ayuno.
Diarrea. Es uno de los síntomas gastrointestinales más comunes que ocurren en el diabético. Su causa, posiblemente es plurifactorial. Es crónica, puede ser severa y es propia de pacientes con larga historia de la enfermedad y tratamiento insulínico. Se presenta en cualquier momento, pero con frecuencia es nocturna y se asocia con incompetencia anal, lo que indica disfunción del esfínter interno anal. Los ataques pueden ser episódicos, con períodos de movimientos intestinales normales o de constipación, dificultando así el diagnóstico diferencial con otros síndromes diarreicos. Ciertamente todos los diabéticos necesitan una tamización o “tamizaje” para patógenos entéricos (virus, parásitos, bacterias), enfermedades inflamatorias del intestino o de tipo maligno, antes de diagnosticar diarrea de etiología diabética.
Varios mecanismos son responsables de esta diarrea crónica diabética (Figura 7). La neuropatía autónoma, como ya se ha anotado, produce trastornos en la motilidad. Normalmente, los nervios adrenérgicos estimulan la absorción de líquidos y electrolitos. Si estos nervios están lesionados en la diabetes, dicha absorción puede estar significantivamente deteriorada y, en esa forma, se produce la diarrea. Existen informes de mala absorción de sales biliares, secundaria a un tránsito acelerado como consecuencia de la neuropatía autónoma (88). Concentraciones elevadas de ácidos biliares desconjugados en el colon, inducen a secreción de líquidos en él. Los pacientes diabéticos con incontinencia poseen una sensación anorrectal disminuida, y la presión del esfínter anal interno en reposo está significativamente reducida, función que depende de la inervación simpática, ya que la del esfínter externo, depende del nervio pudendo (84).
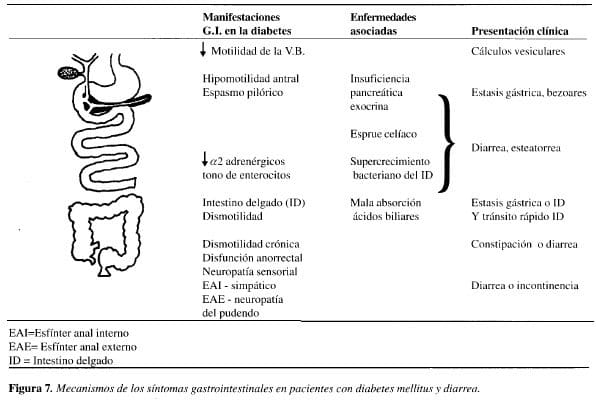
Otro mecanismo de diarrea en el diabético, es el deterioro de la función pancreática exocrina, la cual puede ser consecuencia de una atrofia pancreática o disrupción de reflejos colinérgicos enteropancreáticos o niveles hormonales séricos elevados de glucagón, somatostatina y polipéptido pancreático con reducción de las enzimas pancreáticas.
El tratamiento de la diarrea pancreática es un desafío para el clínico. Muchos agentes han sido exitosos. Es fundamental el control de los niveles sanguíneos de glucosa. Los siguientes agentes son ampliamente usados: dieta libre de lactosa, antidiarreicos (codeína, loperamida, difenoxilato), Psillium muciloide (Metamucil), antibióticos, clonidina (0.1 a 0.5 mg, dos veces al día).
Constipación. La constipación es probablemente el síntoma más común en el paciente diabético. Es típicamente intermitente y suele alternar con episodios de diarrea. Se ha creído que es debida a neuropatía autónoma, más que a cambios miopáticos (8).
Su tratamiento contempla un buen control del azúcar sanguíneo, dieta rica en fibras (20 a 30 gm por día), y a veces, en combinación con laxantes osmóticos y agentes proquinéticos.
Anomalías del árbol biliar.
La diabetes mellitus con frecuencia se asocia a una incidencia aumentada de colelitiasis y colecistitis. También se ha observado que los episodios de colangitis ascendente son de una ocurrencia mayor. La patogenia está relacionada con disminución de la motilidad vesicular y con la composición de una bilis litogénica. El cuadro se asocia a complicaciones como perforación o colecistitis enfisematosa, muchas veces sin estado sintomático de colelitiasis.
Anomalías pancreáticas
Dentro de las alteraciones de la función pancreática en la diabetes mellitus, existen dos aspectos en los cuales son observadas. El primero, es el del paciente con pancreatitis crónica de vieja evolución, que desarrolla diabetes más tarde en el curso de su enfermedad. En este caso, hay una insuficiencia pancreática exocrina, que puede progresar al páncreas endocrino. En esta situación existe el antecedente de alto consumo de alcohol. También se ha notado que estos pacientes tienen aumentada de dos a cuatro veces la incidencia de adenocarcinoma pancreático (21).
El segundo aspecto, es el diabético con largos años de enfermedad, que cursa con deterioro de la secreción pancreática, sin verdadera insuficiencia del órgano. En su patogenia se consignan los efectos inhibitorios del exceso de glucagón, el agotamiento nutricional por el pobre control de la glucosa, la carencia de efectos estimulatorios de la insulina sobre el páncreas y la neuropatía autónoma, que lesiona el vago.
En el hígado, la anormalidad observada con más frecuencia en la diabetes, es la esteatosis no alcohólica, que parece estar relacionada con niveles elevados de triglicéridos, pobre control de la glucosa o ambos. También puede observarse hepatomegalia, muy probablemente debida a infiltración grasa. El carcinoma hepatocelular es dos veces más frecuente en el diabético.
Doctor Jaime De la Hoz, Profesor Emérito y Honorario de la Fac. de Medicina de la Univ. Nal. de Colombia, Hosp. de San Juan de Dios; ex presidente de la Sociedad Colombiana de Cirugía. Santafé de Bogotá, Colombia.
