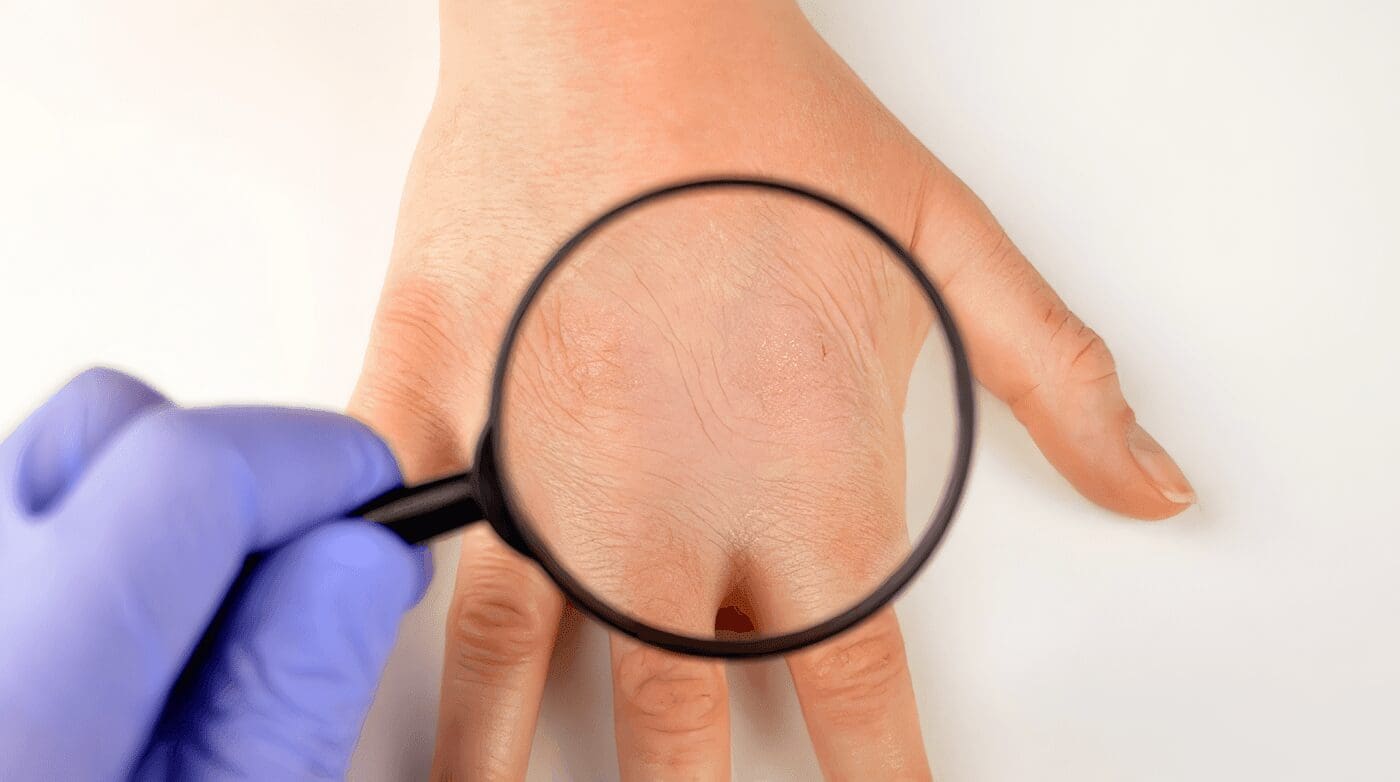
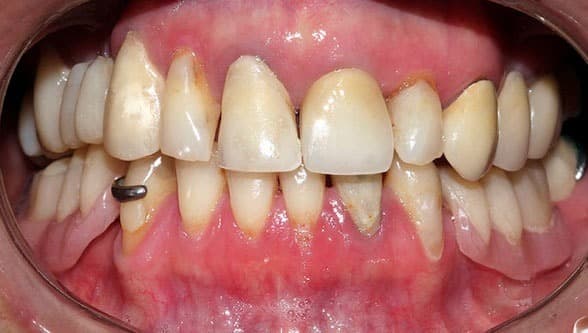
La aparición de efectos secundarios es más frecuente en los seis primeros meses, pero puede ocurrir en cualquier momento del tratamiento. La mayoría son reversibles y moderados, aunque en el 30% obligan a la suspensión del medicamento en el primer año; los más frecuentes son:
Gastrointestinales: anorexia, diarrea, náuseas, dolor abdominal y pérdida de peso. Pueden ser leves y desaparecen disminuyendo la dosis, espaciando la toma o administrando la droga en forma parenteral y agregando ácido fólico o folínico.
Las úlceras orales de gravedad variable son también frecuentes; mejoran con ácido fólico 1 mg/día.
Dérmicos: pueden aparecer diversas erupciones cutáneas, generalmente de tipo alérgico. Con frecuencia se presenta alopecia que mejora con la administración de folatos.
Nodulosis reumatoidea: ocasionalmente produce aumento del numero y tamaño de los nódulos reumatoideos, incluso con vasculitis, y a veces con distribución muy extensa que puede comprometer el corazón, pulmón y meninges.
Hepáticos:
la experiencia ha demostrado que el MTX raras veces causa daño hepático significativo (fibrosis o cirrosis); son factores de riesgo para su presentación: ingesta de alcohol, obesidad, enfermedad hepática previa, hepatitis B o C, insuficiencia renal o diabetes. La biopsia solo debe hacerse en personas con alteración persistente de las pruebas hepáticas. Cuando las enzimas hepáticas aumentan más de 3 veces se debe suspender temporalmente el medicamento.
Hematológicos:
la leucopenia o trombocitopenia se ha encontrado con una frecuencia entre el 1 al 11 %; más frecuente es la neutropenia. La mielosupresión severa es rara y los factores de riesgo son: uso de antifolatos como trimetropin, o sulfasalazina, deficiencia de folatos e insuficiencia renal, edad avanzada, infecciones virales y déficit de folatos; los casos leves ceden con la supresión de la droga. No se ha demostrado inducción de neoplasias por MTX. En un 5% se presenta anemia megaloblástica.
Toxicidad pulmonar:
no se conocen los factores de riesgo ni la incidencia o prevalencia de ésta complicación. Debe evitarse su uso en pacientes con reserva pulmonar disminuida. Puede aparecer una neumonitis que se debe posiblemente a una reacción de hipersensibilidad; clínicamente se caracteriza por disnea, tos seca, fiebre e infiltrados intersticiales bilaterales. Es deber de todas formas descartar la presencia de infección. Cede con la supresión del medicamento y el uso de esteroides.
Otros:
puede aumentar la incidencia de infecciones, por lo cual se recomienda suspender una semana antes y otra después de las cirugías.
Interacciones
El trimetropim-sulfa aumenta la toxicidad por su acción antifólica, lo mismo que el probenecid por su acción competitiva en la secreción tubular.
Control
Se recomienda la realización basal de serologías para identificar la presencia de hepatitis B o C, niveles de creatinina, transaminasas, fosfatasas alcalinas, albúmina, hemoleucograma, plaquetas y placa de tórax. Se hacen controles mensuales inicialmente los primeros 6 meses y luego cada 3 meses.
Azatioprina
Las purinas, junto con las pirimidinas, constituye las bases del DNA, están involucradas en las señales de transcripción, transducción y síntesis de proteínas, juegan un papel importante en la producción de ATP y son las bases de varias coenzimas. Las células requieren una balanceada provisión de purinas para su crecimiento y desarrollo; la Azatioprina actúa como un antagonista de las purinas.
Farmacocinética
La Azatioprina (AZA) es un nitro-imidazol; después de su absorción es transformada, primero en 6- mercaptopurina (6-MP) que es un análogo de la hipoxantina, y luego a ácido inosínico que es el principal metabolito activo. La 6-MP inhibe la síntesis de ácidos nucleicos.
Puede administrarse por vía oral, con una absorción de solo el 50%, originando picos sanguíneos de 0.1 a 2 microgramos/ ml; tras la administración intravenosa se consiguen concentraciones tan altas como 25 microgramos/ ml.
Una vez absorbida, pasa al interior de la célula donde puede oxidarse o metilarse; por acción de la xantinoxidasa se convierte en ácido tioúrico. Si se administra concomitantemente un inhibidor de la xantinoxidasa como es el alopurinol, debe reducirse la dosis en un 50% a 75%. Por la tiopurinometiltransferasa se convierte en 6-metilmercaptopurina y 6-tioguanina. La tiopurinometiltransferasa es una enzima con gran polimorfismo genético; en uno de cada 300 individuos la concentración de ésta enzima metiladora es muy baja, lo cual los hace más susceptibles a la toxicidad.
Se excreta por el riñón; a las 24 horas se encuentra el 50% del fármaco en la orina.
Mecanismo de acción
El mecanismo de acción de la AZA en las enfermedades autoinmunes aún no ha sido clarificado; varios efectos inmunológicos se han descrito:
- Inhibe la inmunidad celular y humoral, disminuyendo las cifras de linfocitos T, principalmente los supresores.
- Disminuye los niveles circulantes de linfocitos B, su proliferación y la producción de inmunoglobulinas.
- Disminuye la producción de monocitos.
- Sobre los niveles de factor reumatoideo, es motivo de controversia ya que hay informes de aumento, disminución o ningún cambio.
- Disminuye la secreción de IL-.
- Disminuye las células NK.
Indicaciones
Es de amplio uso en una variedad de enfermedades autoinmunes como enfermedad de Crohn, neumonitis intersticial, miastenia gravis, LES, vasculitis, pénfigo, AR refractaria y en procesos neoplásicos.
Dosificación
Inicialmente debe administrarse una dosis de 25 a 50 mg/ día durante una semana, y aumentar 0.5 mg/ Kg/ día cada mes hasta alcanzar máximo 2 a 3 mg/ Kg/ día, hasta obtener respuesta siempre que no haya compromiso medular.
Efectos secundarios
Hematológicos: el principal efecto secundario es la supresión medular con leucopenia, trombocitopenia y anemia. Ocasionalmente aparece en la primera semana neutropenia aguda como una respuesta idiosincrásica.
Gastrointestinales: náuseas, vómito y con menor frecuencia diarrea; obligan a la suspensión del fármaco en el 10% de los casos. En un 3 a 4% se presenta pancreatitis.
Aumento del riesgo de infecciones: principalmente infecciones por virus como el Herpes Zoster y el papilomavirus humano. Puede presentarse aumento de las infecciones aún con cifras de neutrófilos normales, lo que indica una alteración funcional de éstos y de los monocitos y linfocitos T.
Aumento del riesgo de neoplasias: tumores sólidos y enfermedades linfoproliferativas.
Reacción de hipersensibilidad: con fiebre, exantema maculopapular, urticaria, vasculitis, eritema multiforme, eritema nodoso, reacciones gastrointestinales y hepatotoxicidad.
Otros: fiebre, rash y hepatitis.
Contraindicaciones
Embarazo y lactancia. Produce retraso en el crecimiento y prematurez en el feto, e inmunosupresión en el neonato.
Interacciones
La administración conjunta de alupurinol obliga a reducir la dosis de AZA en un 50 a 75%; los IECA también aumentan el riesgo de toxicidad medular.
Control
El objetivo principal es disminuir la incidencia y gravedad de la mielosupresión y sus complicaciones; debe vigilarse la hepatotoxicidad y la aparición de enfermedades mieloproliferativas.
Se aconseja la evaluación basal con hemoleucograma, plaquetas, creatinina, transaminasas, luego cada 8 días hasta ajustar la dosis y después mensualmente.
Referencias bibliográficas
- Fauci A S y Young KR. Immunoregulatory agents. In: Kelley, Harris ED, Ruddy S y Sleedge CB, eds. Textbook of Rheumatology. 4 ed. Philadelphia WB Saunders,1993:797-821.
- Gordon DA. Gold compounds in the rheumatic diseases. In: Kelley, Harris ED, Ruddy S y Sleedge CB, eds. Textbook of Rheumatology 4 ed. Philadelphia, WB Saunders, 1993; 743-759.
- Hanly JG, Hassan J, Bresnihan B. Effects of the gold therapy on the synthesis and quantity of serum and synovial fluid IgM, IgG and IgA rheumatoid factors in rheumatoid arthritis patients. 1986;29:480-487.
- Lipsky PE, Ziff M. Inhibition of antigen and mitogen induced human lymphocyte proliferation by gold compounds. J Clin Invest 1977; 59:455-466.
- Rae KJ, MacKay CNN et al. Early and late changes in sulphydryl groups and cupper protein concentrations and activities during drug treatment with aurothiomalate and auronofin. Ann Rheum Dis 1986; 45:839-846.
- Cash JM, Klippel JH. Second line Drug Therapy for Rheumatoid Arthritis. N. Engl J Med 1994;330:1368-75.
- American College of Rheumatology Ad Hoc Committee on Clinical Guidelines. Guidelines for the management of Rheumatoid Arthritis. Arthritis Rheum 1996:39:713-22.
- Machold KP, Eberl G, and cols. Early arthritis therapy. J Rheumatol 1998; 25 (suppl.53) 13-19.
- Pincus TH. Aggressive Treatment of early RA to prevent joint damage. Bull Rheum Dis 1998: 47; 2-7.
- American College of Rheumatology Ad Hoc Committee on Clinical Guidelines. Guidelines for monitoring drug therapy in Rheumatoid Arthritis. Arthritis Rheum 1996:39:723-31.
- Li. E, Brooks P, Conaghan PG. Disease-modifying antirheumatic drugs. Curr Opin Rheumatol 1998; 10:159-68.
- Laroche M, Tack Y. Efficacy of folinic acid in reducing MTX toxicity in JRA. Clin Exp Rheumatol.1999 Vol 17 No. 5.
- Cash J, Wilder R. Treatment of resistant Rheumatic Disease. Clin of North America 1995.
- Irigoyen MV, Oyarzabal BP. Fármacos antirreumáticos de acción lenta. Manual SER de las enfermedades reumáticas, Sociedad Española de Reumatología, 2000 pp 197-210.
- Kertens PJSM, StolkJN, Boerbooms RA. Purine enzymes in RA. Clin and Exp Rheum. 1995 Vol 13 No 1:107-111.
- Choy E, Panayi G. Mechanism of actinon of second-line agents and choice in combination therapy. Clin and Exp Rheum 1999: Vol17 No 6, S20.
- Danning CL, Boumpas DT. Commonly used disease modifiying antirheumatic drugs in AR. An update on mechanisms of action. 1998 Vol 16 No 5.
- van Ede AE, Laan RFJM, Blom HJ and cols. Methrotexatein R A. An Update with focus on mechanisms involves in toxicity. Semin Arthritis Rheum 1998;27:277-92.
- Kertens PSJM, eurissen el als. Accelerated noduñodid during low
- Cronstein BN, Naimade D, Ostad E. The inflammatory mechanism of MTX. Increased adenosine release at inflamed sites diminishes leukocyte accumulation in vivo model of inflammation. J. Clin Invest. 1997;92:2675.
- Kremer JM, Davis JM, Rynes IR et al. Every other week MTX in patients with RA. Arthritis and Rheum 1995;5:601-608.
- American College of Rheumatology Ad Hoc Committee on Clinical Guidelines for Monitoring Drugs. Therapy in RA. Arthritis Rheum 1996: 39(5):723-731.
- Goodman TA, Polisson RA. MTX, adverse reactions and major toxicities. Rhem Dis Clin of NA 1994; 20(2):513-528.
- Kremer JM, Alarcoon BS, et al. MTX for RA. Suggested guidelines for monitoring liver toxicity. Arthritis Rheum 1994; 37 (3):316-328.
- 25. Wanghe PV, Dequeker J. Compliance and long term effect of azathioprine in 65 rheumatoid arthritis cases. Ann Rheum Dis 1982; 48 (suppl):40-42.
- Fauci AS, Joung KR. Immunoregulatory agents. In Kelly et al. Textbook of Rheumatology. Saunders Co.1989, pp862-888.
- Anaya JM, Ramírez LA. Artritis Reumatoide. Asociación Colombiana de Reumatología.1998;199-216.