La EicH aguda comienza con mayor frecuencia entre los días +7 a +21 después de la toma del injerto; la toma del injerto se define por la presencia de un recuento de neutrófilos igual o mayor de 500/ul en sangre periférica.
Compromiso cutáneo
El compromiso cutáneo es el más común y se manifiesta por prurito o sensación de dolor cutáneo y erupción maculopapular. La aparición de pápulas perifoliculares, eritema palmar y plantar y coloración violácea en los pabellones auriculares y cuello, son cambios clínicos altamente sugestivos de EicH aguda.
Otras formas son: la escarlatiniforme con placas descamativas extensas, y las formas hiperagudas severas con eritrodermia, fiebre y necrólisis epidérmica que se manifiesta por ampollas y severo compromiso del estado general.
La mucositis es frecuente y se manifiesta con úlceras dolorosas que pueden ser muy extensas e impedir la alimentación.
Es difícil de diferenciar clínicamente de la mucositis inducida por la quimioterapia. La cual aparece tempranamente en el curso del trasplante mientras que la mucositis por EicH aguda se presenta en la mayoría de los casos después del primer mes.
Compromiso hepático
Es el segundo en frecuencia y se manifiesta por hepatomegalia, ictericia e incremento en los niveles de las transaminasas y la bilirrubina conjugada. La ictericia colestásica es común. Pero la falla hepática y la encefalopatía debidas únicamente a la EicH aguda es rara.
El diagnóstico diferencial incluye hepatotoxicidad por drogas, infecciones y enfermedad venooclusiva hepática. La biopsia hepática podría ser útil para el diagnóstico de EicH aguda porque el daño de los conductos biliares es característico. sin embargo, en la práctica se realiza poco debido a que la piel y el tracto gastrointestinal son de más fácil acceso por los métodos diagnósticos complementarios.
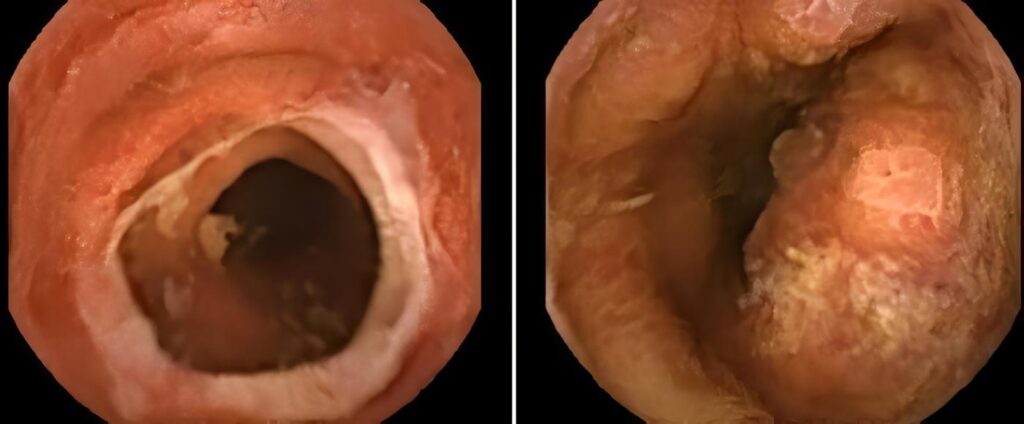
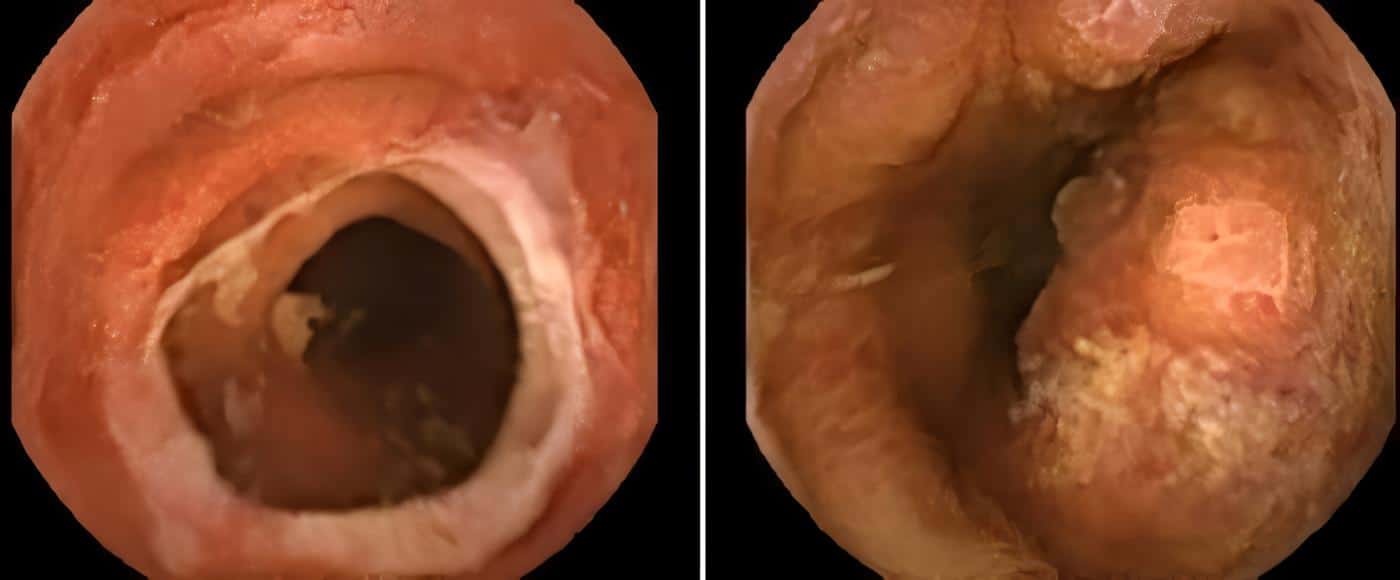
Compromiso del tracto gastrointestinal
La EicH aguda afecta principalmente la porción distal del intestino delgado y colon, comprometiendo en menor frecuencia el estómago y el duodeno. Se manifiesta por diarrea, sangrado, dolor, íleo, náuseas, vómito, anorexia, dolor abdominal, ascitis y malabsorción.
La diarrea es verdosa, mucoide, acuosa y mezclada con restos de mucosa intestinal, que puede llevar a la necesidad de suspender la ingesta alimentaria para disminuir el volumen de las heces. En algunos casos esto no es suficiente y persiste una diarrea secretoria severa, de altos volúmenes y gran severidad, que hacen necesario el tratamiento inmunosupresor intenso.
Las radiografías del tracto gastrointestinal demuestran edema mucoso y submucoso, tránsito rápido del medio baritado y pérdida de las haustras intestinales. El diagnóstico diferencial incluye efectos residuales de la quimioterapia y radioterapia, e infección intestinal. La endoscopia digestiva con biopsia y el tránsito intestinal baritado son importantes herramientas diagnósticas para esta entidad.
Otros compromisos
La EicH puede comprometer los ojos y producir fotofobia, conjuntivitis hemorrágica, seudomembranas y lagoftalmos. Otras manifestaciones son neumonía, derrame pleural estéril, cistitis hemorrágica, trombocitopenia, anemia y síndrome hemolítico urémico, entre otras.
(Lea También: Compromiso de la Piel)
Estadios clínicos
Esta enfermedad se ha dividido en grados y estadios según la severidad del compromiso de la piel, el hígado y el tracto gastrointestinal.
| Estadio | Piel | Hígado | TGI |
| + ++ +++ ++++ |
Rash < 25% SC Rash 25-50% SC Eritrodermia Descamación y ampollas |
Bb 2-3 mg/dl Bb 3-6 mg/dl Bb 6-15 mg/dl Bb >15 mg/dl |
Diarrea 500 -+-1000 ml/ día Diarrea 1000-1500 ml/ día Diarrea >1500 ml/ día Dolor – Ileus |
SC: superficie corporal; Bb: bilirrubina
| Grados | Piel | Hígado | TGI | Alteración funcional |
|
0 |
0 + a ++ + a +++ ++ a +++ ++ a ++++ |
0 0 + ++ a +++ ++ a ++++ |
0 0 + ++ a +++ ++ a ++++ |
0 0 + ++ +++ (Compromete la vida) |
Mecanismos de patogénesis
Las células T transfundidas son las responsables de la inducción de la EicH aguda, pues presentan una actividad citolítica y/o ayudadora frente a las células del receptor que expresan antígenos diferentes. Las células efectoras de la respuesta inmunológica son los linfocitos T, principalmente CD4+, CD8+ y, en modelos animales, los linfocitos NK. En la piel y el tracto gastrointestinal estas células efectoras producen daño celular promoviendo la apoptosis.
Existe una estrecha relación entre infección y EicH aguda. La fisiopatología de esta enfermedad se fundamenta en la distorsión de la respuesta celular contra infecciones por virus y bacterias gram negativas en los principales órganos blanco, especialmente en el tracto gastrointestinal. Donde estimulan la liberación de citoquinas y mediadores inflamatorios. La piel, el hígado y el tracto gastrointestinal están expuestos a una gran cantidad de endotoxinas que disparan y amplifican la respuesta inflamatoria en los pacientes con EicH aguda.
La fisiopatología de la EicH aguda se divide en tres fases: el régimen condicionante, la activación de células T y la fase efectora.
Primera fase: régimen condicionante
La EicH aguda comienza desde la fase de preparación pre trasplante. Es decir, antes de la infusión de las células del donante; durante este período, se producen daños en la mucosa intestinal. El hígado y otros tejidos por la quimioterapia y la radioterapia. Las células activadas secretan citoquinas proinflamatorias como el TNF-a, la IL-1 y factores de crecimiento como el GM-CSF, promoviendo el aumento en la expresión de moléculas de adhesión y complejos mayores de histocompatibilidad.
Segunda fase: activación de las células T del donante
Esta fase incluye la presentación antigénica, la activación de los linfocitos T del injerto y la proliferación y diferenciación de estas células activadas. Cuando las células CD4+ y CD8+ ingresan al torrente sanguíneo, interactúan con las células presentadoras de antígeno; si existen diferencias en el complejo mayor de histocompatibilidad. Las células del injerto desencadenan una reacción injerto contra hospedero.
Cuando el donante y el receptor son HLA idénticos, puede presentarse EicH por diferencias en los complejos menores de histocompatibilidad. Se han caracterizado cuatro antígenos menores, HA-1, -2, -4, -5, cuya disparidad entre donante y receptor se relaciona con la aparición de EicH; la disparidad entre un receptor HA-A1 positivo que además presenta antígenos mayores HLA-A1 o HLA-A2 y un donante HA-1 negativo. Se asocia con la aparición de EicH aguda grado II-IV en cerca del 100% de los casos.
En el lecho capilar, las células T del injerto interactúan con las células endoteliales y se exponen a nuevos aloantígenos. En un proceso dinámico. El endotelio es activado y participa a su vez en la activación de las células T.
El aumento de la E- Selectina, una molécula de adhesión endotelial, y diferencias en las isoformas de PECAM (Molécula de Adhesión Endotelial Plaquetaria) entre donante y receptor, incrementan el riesgo de EicH aguda. Estas moléculas permiten la adhesión de linfocitos circulantes provenientes del donante a diferentes antígenos endoteliales del huésped, facilitando el paso de las células a los diferentes tejidos.
En la activación de las células T se requiere de dos señales.
La interacción del TCR con péptidos unidos al HLA y las señales coestimulatorias con las células presentadoras de antígeno. Las señales coestimulatorias principales en este proceso son las interacciones del B7 (CD80 ó CD86) que se une al CD28 (efecto estimulatorio) y al CTLA-4 (efecto inhibitorio).
Otra señal coestimulatoria importante es la interacción entre CD40 y CD40L. Que promueve el incremento de ICAM-1, VCAM-1 y E-Selectina en el endotelio. Estas interacciones sugieren que las células T CD4+ pueden incrementar su propia respuesta inmune al promover la expresión de moléculas de adhesión en las células endoteliales.
Citoquinas y EicH aguda
Las células T activadas secretan citoquinas tipo Th1. Especialmente IL-2 e IFN-g. La IL-2 es producida por las células CD4+ del injerto en los primeros días pos TMO, y posteriormente por las células del hospedero. El IFN-g es muy importante en la patogénesis de la EicH porque estimula la producción de múltiples citoquinas en los macrófagos, amplificando de esta manera la cascada de eventos inmunológicos.
El balance entre citoquinas Th1 y Th2 es crítico para la presentación de la EicH aguda; el incremento de citoquinas Th2 como la IL-4 se relaciona con baja frecuencia y prevención de esta entidad. El uso de G-CSF disminuye el riesgo de EicH y mejora la toma del injerto al cambiar el perfil de citoquinas por aumento de las tipo Th2.
Altos niveles de citoquinas inmunosupresoras como la IL-10, o el pretratamiento de las células CD4+ con esta citoquina. Se relacionan con modulación y regulación de la respuesta inmune en la EicH.
Tercera fase: fase efectora de la inflamación
En esta fase, los linfocitos grandes granulares (células NK) son responsables de los efectos citolíticos que se incrementan por los mediadores inflamatorios y las citoquinas. La respuesta inflamatoria amplifica el daño celular al estimular la síntesis de TNF-a, IL-1a e incrementar las moléculas HLA clase II y de adhesión ICAM-1, en la piel y el tracto digestivo.
Durante la fase del régimen condicionante, pueden producirse grandes cantidades de LPS (endotoxina) en la piel y el tracto gastrointestinal; en la fase efectora. El LPS estimula en la piel a los queratinocitos y en la dermis y el tracto gastrointestinal a los fagocitos mononucleares para la producción de TNF-a, que produce daño directo del tejido al inducir la muerte celular por apoptosis.
Los agentes virales también agravan la EicH y son factores predisponentes para su presentación; entre estos se destaca la infección por citomegalovirus. El cual estimula el fenómeno inflamatorio y la producción de citoquinas tipo Th1.
La citotoxicidad es mediada por las células NK y depende de las vías de Fas-L, perforinas y granzimas, asociándose al daño celular en los órganos blanco.
Enfermedad injerto contra huésped crónica
La EicH crónica es una enfermedad multisistémica con grados variables de queratoconjuntivitis sicca, enfermedad hepática similar a la cirrosis biliar primaria, diarrea con o sin malabsorción, bronquiolitis obliterante, polimiositis y neuropatía periférica. Aparece después de 100 días pos trasplante. Pero en algunos casos pueden observarse manifestaciones tempranas, en los primeros 40 días pos trasplante.