Como se mencionó, el adipocito marrón no acumula energía, por tanto no genera los efectos indeseables de obesidad que tiene el adipocito blanco; por tanto, si el problema de la obesidad proviene precisamente de la acumulación de energía en el adipocito, un promisorio tratamiento sería mejorar la eficiencia en el gasto energético, lo que puede ser logrado a través de la activación de la termogénesis. Precisamente la acumulación de triglicéridos suministraría el combustible para activar la señalización que desencadenaría en la activación de UCP1 para generar el desacoplamiento de la cadena transportadora de electrones y la liberación de calor (35).
Este mecanismo puede ser logrado a través de la proliferación de tejido graso pardo en el adulto o vía activación de proteínas como UCP1 en el adipocito blanco. Hay además otras investigaciones clínicas que reportan la presencia de grasa marrón en las personas adultas. Incluso se menciona que la activación de un máximo de 50g de tejido pardo podría relacionar un 20% del gasto energético, lo que correspondería a una disminución de 20kg de peso por año (36,37). 1.
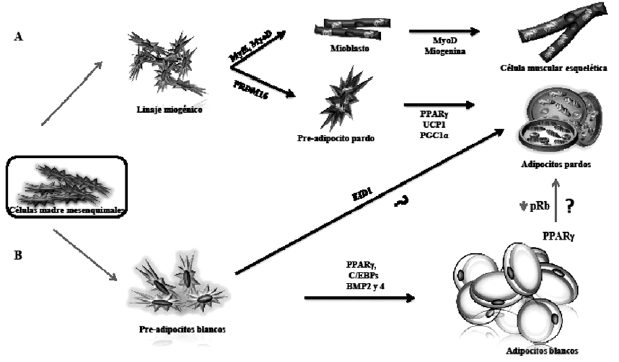
Figura 1
Entre las moléculas que pueden modular el gasto energético vía activación de UCP1 se encuentra la proteína del retinoblastoma (pRb). La supresión de la expresión de este gen en células fibroblásticas embrionarias de ratón presenta una activación de genes de grasa marrón, incluso en condiciones en las que los ratones son sometidos a dieta rica en calorías que los hace resistentes a la obesidad (37-39). La pRb no se expresa en células precursoras del adipocito marrón; en el pre-adipocito blanco se une a los promotores de PGC1α (peroxisome proliferator activated receptor g activator), cuya función es generar biogénesis mitocondrial en las células pardas para aumentar la eficiencia del gasto calórico (37).
Las investigaciones de nuestro grupo se han enfocado en el estudio del adipocito y de la acción de proteínas que puedan tener la posibilidad de influir en la expresión de genes involucrados en la eficiencia del gasto energético. Tanto nosotros como otros grupos, clonamos la proteína reconocida como EID1 (E1A-like inhibitor of differentiation), descrita como una molécula que inhibiría la diferenciación de células musculares y que podría tener un papel relevante en la diferenciación celular por su asociación a pRb (40-41). El EID1 reduce la actividad de los co-activadores p300 y mediante este mecanismo puede bloquear la activación transcripcional.
Hemos observado que el EID1 reduce la activación de algunos receptores nucleares en presencia del ligando (42). Esta acción es efectivamente ejercida por una disminución de la capacidad del coactivador p300 de ayudar en la activación trascripcional de los receptores de hormonas tiroideas (TR), estrógenos (ER) y el activador del peroxisoma (PPAR) (43). Teniendo en cuenta su efecto en las células musculares que son originarias de la misma línea germinal del adipocito, nos propusimos estudiar el papel de esta proteína sobre la diferenciación de células adiposas (44).
Algunas observaciones iniciales en un modelo de células de preadipocito unipotente 3T3-L1 originados de ratón mostraron que el EID1 reduce la acumulación de grasa en el proceso de diferenciación de estas células, lo que en principio fue atribuído a una reducción de la actividad del receptor nuclear PPARg (45).
No obstante, dado que esta reducción no demostraba cuál era la causa específica de la acumulación de triglicéridos, evaluamos la posibilidad de una posible transdiferenciación del adipocito blanco hacia el adipocito marrón (o pardo). De esta forma, el aumento de la eficiencia en el gasto energético generada por EID1 podría corresponder a genes que participan en la termogénesis, eliminando la energía acumulada en forma de calor y que son característicos de la grasa marrón, como el PGC1a y la UCP1. Esta acción no podría ser explicada por una acción exclusiva sobre PPARg; por tal motivo evaluamos si el EID1 podría reducir la actividad de pRb, hecho que podría explicar la formación de inductores de grasa marrón en estos pre-adipocitos de linaje blanco (46).
Nuestras observaciones confirmaron esta acción del EID1 en estas líneas celulares, con los que esta proteína puede aumentar la termogénesis aumentando la expresión de genes que inducen mayor disipación de calor. No obstante, es necesaria la profundización en estudios que conduzcan a una alta comprensión de la acción de esta y otras proteínas, para avanzar en las diferentes fases de investigación como ensayos en modelos animales. Se ha comprobado que tanto las células pardas como las blancas provienen de distintos orígenes; incluso el adipocito pardo se reconoce como adipomiocito por su relación cercana a las células musculares, donde la supresión del gen PRDM16 (PRD1-BF- 1-RIZ1 homologues domain-containing protein -16) caracterizado como un determinante crítico del linaje adipocítico pardo, induce marcadores de células musculares (47-51). Entonces, es posible que a través de la manipulación del tejido adiposo, se logre la activación de proteínas como UCP1 y PGC1α que activen el gasto de esa energía acumulada de manera similar al adipocito pardo, aún cuando estas células no expresen los marcadores característicos de las células adipocíticas pardas clásicas (52).
Referencias
1. Pasman WJ, Saris WH, Westerterp-Plantenga MS. Predictors of weight maintenance. Obes. Res. 2006; 7: 43-50.
2. Bermúdez-Silva FJ, Viveros MP, McPartland JM, Rodriguez de Fonseca F. The endocannabinoid system, eating behavior and energy homeostasis: the end or a new beginning?. Pharmacol Biochem Behav. 2010; 95:375-82.
3. Warren C, Cooper PJ. Psychological effects of dieting. Br J Clin Psychol 1988; 27: 269-70.
4. Halford JC. Clinical pharmacotherapy for obesity: current drugs and those in advanced development. Curr Drug Targets. 2004; 5: 637-46.
5. Lee JS, Sheer JL, Lopez N, Rosenbaum S. Coverage of obesity treatment: a state-by-state analysis of Medicaid and state insurance laws. Public Health Rep. 2010; 125:596-04.
6. Halford JCG, Boyland EJ, Blundell JE, Kirkhan TC, Harrold JA. Pharmacological management of appetite expression in obesity. Nature Rev. Endo. 2010; 6:255-69.
7. Rogovik AL, Chanoine JP, Goldman RD. Pharmacotherapy and weight-loss supplements for treatment of paediatric obesity. Drugs. 2010; 70:335-46.
8. National Institute for Clinical Excellence. Obesity: the prevention, identification, assessment and management of overweight and obesity and obesity in adults and children (online), http: //guidance.nice. org.uk/CG43(2006).
9. Elfhag K, Rossner S. Who succeeds in maintaining weight loss? A conceptual review of factors associated with weight loss maintenance and weight regain. Obes Rev 2005; 6: 67-85.
10. O´ Rahilly S, Farooqi IS. Genetics of obesity. Philos Trans R Soc Lond B Biol Sci. 2006; 361:1095-1105.
11. Llewellyn CH, van Jaarveld CH, Boniface D, Carnell S, Wardle J. Eating rate is a heritable phenotype related to weight in children. Am J Clin Nutr. 2008; 88: 1560-66.
12. Rankinen T, Zuberi A, Chagnon YC, Weisnagel SJ, Argyropoulos G, Walts B. The human obesity gene map: The 2005 update. Obesity 2006; 14: 529-644.
13. Finlayson G, King N, Blundell JE. Liking vs wanting food: importance for human appetite control and weight regulation. Neurosci Biobehav Rev 2007; 31: 987-02.
14. Grucza RA, Przybeck TR, Cloninger CR. Prevalence and correlates of binge eating disorder in a community sample. Compr Psychiatr. 2007; 48: 124-31.
15. Brown WJ, Williams L, Ford JH, Ball K, Dobson AJ. Identifying the energy gap: magnitude and determinants of 5-year weight gain in mid-age women. Obes Res. 2005; 13: 1431-41.
16. Valezi AC, Junior JM, de Menezes MA, de Brito EM, de Souza SA. Weight Loss Outcome After Silastic Ring Roux-en-Y Gastric Bypass: 8 Years of Followup. Obes Surg. 2010 Sep 2. PMID: 20811958.
17. Ciangura C, Nocca D, Lindecker V. Guidelines for clinical practice for bariatric surgery. Presse Med. 2010 Aug 30. PMID: 20810234.
18. Alverdy JC, Prachand V, Flanagan B, Thistlethwaite WA, Siegler M, Garfinkel M, et al. Bariatric Surgery. A history of empiricism, a future in science. J Gastrointest Surg. 2009;13:465-77.
19. Cypess AM, Lehman S, Williams G, et al. Identification and Importance of Brown Adipose Tissue in Adult Humans. N Engl J Med. 2009; 360:1500-08.
20. Lichtenbelt W, Vanhommerig JW, Smulders NM, Drossaerts J, Kemerink GJ, Bouvy ND, et al. Cold- Activated Brown Adipose Tissue in Healthy Men. N Engl J Med. 2009; 360:1509-17.
21. Whitmore C. Type 2 diabetes and obesity in adults. Br J Nurs. 2010; 880: 882-6.
22. Symonds ME, Sebert Sp, Hyatt MA, Budge H. Nutritional programming of the metabolic syndrome. Nat Rev Endocrinol. 2009; 5: 604-10.
23. Enerbäck S. The origins of brown adipose tissue. N Engl J Med. 2009; 360:2021-23.
24. Lidell ME, Enerbäck S. Brown adipose tissue, a new role in humans? Nat Rev Endocrinol. 2010; 6: 319-325.
25. Kawai M, Sousa KM, MacDougald OA, Rosen CJ. The many facets of PPARgamma: novel insights for the skeleton. Am J Physiol Endocrinol Metab. 2010: 299:E3-9.
26. Kean S. Drug safety. Planned study of Avandia in doubt after FDA review. Science. 2010;329:75
27. Enerbäck S. Human brown adipose tissue. Cell Metab. 2010: 11; 248-52.
28. Frontini A, Cinti S. Distribution and development of brown adipocytes in the murine and human adipose organ. Cell Metab. 2010; 11: 253-56.
29. Kajimura S, Seale P, Spiegelman BM. Transcriptional control of brown fat development. Cell Metab. 2010; 11: 257-62.
30. Fruhbeck G, Becerril S, Sainz N, Garrastachu P, Garcia-Velloso MJ. BAT: a new target for human obesity ? Tren Pharmacol Sci 2009; 30:387-96.
31. Cannon B, Nedergaard J. Brown adipose tissue: function and physiological significance. Physiol Rev. 2004; 84:277-359.
32. Spiegelman BM. PPAR-gamma: adipogenic regulator and thiazolidinedione receptor. Diabetes 1998; 47: 507-14.
33. Nielsen R Pedersen TA, Hagenbeek D, Moulos P, Siersbaek R, Megens E, Denissov S, et al. Genomewide profiling of PPARγ:RXR and RNA polymerase II occupancy reveals temporal activation of distinct metabolic pathways and changes in RXR dimmer composition during adipogenesis. Genes & Dev 2008; 22: 2953-67.
34. Rosen CJ. Revising the Rosiglitazone story- Lessons Learned. N Engl J Med 2010; 363:803-06.
35. Celi FS. Brown Adipose Tissue – When it pays to be inefficient. N Engl J Med 2009; 360:1553-56.
36. Hallenborg P, Feddersen S , Madsen L, Kristiansen K. The tumor suppressors pRB and p53 as regulators of adipocyte differentiation and function. Expert Opin. Ther. Targets. 2009; 13: 235-245.
37. Dali-Youcef N, Mataki C, Coste A, Messaddeq N, Giroud S, Blanc S, et al. Adipose tissue-specific inactivation of the retinoblastoma protein protects against diabesity because of increased energy expenditure. Proc Natl Acad Sci U S A. 2007;104:10703-08.
38. Mercader J, Ribot J, Murano I, Feddersen S, Cinti S, Madsen L, et al. Haploinsufficiency of the retinoblastoma protein gene reduces diet-induced obesity, insulin resistance, and hepatosteatosis in mice. Am J Physiol Endocrinol Metab. 2009; 297: E184-93.
39. Calo E, Quintero-Estades JA. Danielian PS, Nedelcu S, Berman SD, Lees JA. Rb regulates fate choice and lineage commitment in vivo. Nature 2010; 466: 1110-15.
40. MacLellan WR, Xiao G, Abdellatif M, Schneider MD. A novel Rb- and p300-binding protein inhibits transactivation by MyoD. Mol Cell Biol 2000; 20: 8903-8915.
41. Miyake S, Sellers WR, Safran M, et al. Cells degrade a novel inhibitor of differentiation with E1A-like properties upon exiting the cell cycle. Mol Cell Biol 2000; 20: 8889-902.
42. Vargas D, Celis L, Romero C, Lizcano F. Modulation of thyroid hormone receptor transactivation by the early region 1A (E1A)-like inhibitor of differentiation 1 (EID1). Genet Mol Biol, 2008; 31: 4009-415.
43. EID3 is a novel EID family member and an inhibitor of CBP-dependent co-activation. Bavner A, Matthews J, Sanyal S, Gustafsson JA, Treuter E. Nucleic Acid Res 2005; 33: 3561-9.
44. Uezumi A, Fukada S, Yamamoto N, Takeda S, Tsuchida K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 2010;12:143-52.
45. Vargas D, Lizcano F. Modulation of PPARg activity by CRI-1 (EID1) and the effects of partial agonism. In ENDO 06. The Endocrine Society Press. MD. USA. Boston 2006.
46. Lizcano F, Vargas D. EID1-induces brown-like adipocyte traits in white 3T3-L1 pre-adipocytes. Biophy Biochem Res Commun. 2010; 398:160-165.
47. Arner P, Spalding KL. Fat cell turnover in humans. Biochem Biophys Res Commun. 2010;396:101-4.
48. Almind K, Manieri M, Sivitz WI, Cinti S, Kahn CR. Ectopic brown adipose tissue in muscle providesa mechanism for differences in risk of metabolic syndrome in mice. Proc. Natl. Acad. Sci. U. S. A. 2007; 104: 2366-71.
49. Kajimura S, Seale P, Spiegelman BM. Transcriptional control of brown fat development. Cell Metab 2010; 11: 961-67.
50. Tseng YH, Kokkotou E, Schulz TJ, Huang TL, Winnay JN, Taniguchi CM. et al. New role of bone morphogenetic protein 7 in brown adipogenesis and energy expenditure. Nature 2008; 454: 1000-04.
51. Fruhbeck G, Sesma P, Burrell MA. PRDM16, the interconvertible adipo-myocyte switch. Trends Cell Biol. 2009; 19: 141–6.
52. Yamamoto K, Sakaguchi M, Medina RJ, Niida A, Sakaguchi Y, Miyazaki M. Transcriptional regulation of a brown adipocyte-specific gene UCP-1, by KLF11 and KLF15. Biochem Biophys Res Commun. 2010;400:175-80.
