Las cepas aisladas a partir de las biopsias depositadas en medio de cultivo líquido descrito anteriormente, se obtuvieron al sembrarlas en agar Columbia, adicionado con 7% de sangre desfibrinada de cordero, suplemento selectivo DENT (vancomicina, trimetoprim, anfotericina B y cefsulodin) e Isovitalex al 1%.
Se incubaron en microaerofilia entre 2 a 7 días hasta observar colonias características en un ambiente: 5-10% O2; 5-10% CO2; 80-90% N2, humedad de 95% y temperatura de 37 °C.
A las colonias crecidas en el medio se le practicaron las pruebas básicas de identificación, consistentes en coloración de Gram, producción de ureasa, citocromo-oxidasa y catalasa.
Después de realizadas las pruebas bioquímicas, las muestras se cubrieron con un tapón de gasa y algodón para permitir el intercambio gaseoso; posteriormente se depositaron en bolsas especiales (Gaspak® pouch BBL) más el dispositivo de microaerofilia.
Se llevaron a incubación durante 4 días a 37°C. El dispositivo mantuvo las siguientes condiciones: CO2 5-10%; O2 5-10%; N2 80-90%, humedad de 95% (18).
Extracción de ADN. A partir de las muestras sembradas en medio líquido y tras 3-4 días de incubación, se tomaron 5 ml del cultivo y se realizó extracción del ADN genómico empleando el kit de extracción Ultra Clean microbial DNA isolation de MoBio®. El ADN obtenido fue verificado por electroforesis en gel de agarosa al 0,8% en TAE y cuantificado en el equipo Qubit®.
PCR. Para la amplificación del gen DNAr16S de H. pylori se utilizaron un par de cebadores previamente reportados en la literatura, derecho (5’- TCGTGTCGTGAGATGTTGGG -3’) y reverso (5’- CCGTGGGCAGTAGCCAATTT-3’).
Las reacciones de amplificación fueron realizadas en tubos de 100 μL utilizando volúmenes finales de 20 μL con las siguientes concentraciones: Iniciadores (Sintetizados por BIONEER® 0,5 μM c/uno; Taq polimerasa (Biolase®, Bioline®) 0,07 U/ μL; MgCl2, 2.0 mM; dNTPs 250 μM c/uno, buffer de reacción 1X; DNA cromosomal ~30ng.
Las condiciones de amplificación son las siguientes una denaturación inicial a 94°C por 4 minutos, seguida de 30 ciclos de denaturación, anillaje y elongación a 94°, 56°C y 72°C respectivamente; un tiempo final de extensión de 10 minutos a 72°C. Se amplifica un segmentó del gen DNAr 16s de aproximadamente 395 pb.
En cada ensayo de PCR se utilizó ADN de la cepa de H. pylori NCTC 11638 donada por el laboratorio de microbiología de la Pontificia Universidad Javeriana como control positivo, además de ADN extraído a partir de E. coli DH5α. La calidad del ADN extraído fue verificada mediante la amplificación del gen 16S procariota con el par de iniciadores 8UA: 5’-AGAGTTTGATCMTGGCTCAG- 3’ y 1485B: 5’-TACGGTTACCTTGTTACGAC-3’.
Aspectos Éticos. El presente estudio se clasificó como un estudio de Investigación con riesgo mínimo dado por la clasificación de proyectos de investigación de la Comisión de Ética e Investigación (CEI).
Resultados
Las muestras obtenidas en las dos institucio- nes de salud se clasifi caron según el diagnóstico endoscópico, según se muestra en la Figura 1. Se obtuvieron resultados bioquímicos consis- tentes con la presencia de H. pylori en 50 de las muestras procesadas, correspondientes al 72,46%, las 19 muestras restantes se interpretaron como biopsias negativas para la bacteria.
Se logró aislar ADN genómico de las 69 mues- tras gástricas en buena concentración y pureza, se obtuvieron ampliaciones del tamaño esperado para H. pylori en 23 de las 69 muestras (33.33%), frente a las 50 biopsias (72,46%) que mostraron positividad en las pruebas bioquímicas de H. pylori (Figura 2). Todas las muestras positivas por PCR fueron positivas en los test bioquímicos.
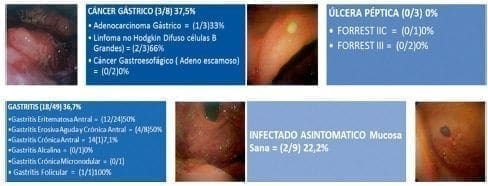 Figura 1. Frecuencia H. pylori por PCR según la patología endoscópica. En cada recuadro se describe la entidad endoscópica (número casos positivos por PCR/ número de casos totales) Porcentaje %. Fotos tomadas por Oliveros, R.
Figura 1. Frecuencia H. pylori por PCR según la patología endoscópica. En cada recuadro se describe la entidad endoscópica (número casos positivos por PCR/ número de casos totales) Porcentaje %. Fotos tomadas por Oliveros, R.
 Figura 2. Electroforesis uen gel de agarosa TAE al 2%. Muestras 058 a la 061. Marcador de tamaño molecular Hiperladder II®. CtrlRxn agua ultrapura. Se identifi can como positivas muestras Bx 58 y Bx 59, en las cuales se observa amplicón de aproximadamente 400 pb.
Figura 2. Electroforesis uen gel de agarosa TAE al 2%. Muestras 058 a la 061. Marcador de tamaño molecular Hiperladder II®. CtrlRxn agua ultrapura. Se identifi can como positivas muestras Bx 58 y Bx 59, en las cuales se observa amplicón de aproximadamente 400 pb.
En ninguna de las pruebas realizadas se obtuvo amplificación con el ADN de Escherichia coli y se verificó la calidad del ADN extraído al obtener amplificación del gen 16S procariótico en todas las biopsias con resultado negativo para H. pylori.
Discusión
La presencia de H. pylori en biopsias gástricas fue evaluada por PCR de un fragmento del gen 16S, con la cual se obtuvo un índice de detección de 33,33%, inferior frente al índice de detección estimado con las pruebas bioquímicas que correspondió a 72,46%.
Esta diferencia puede ser debida al aislamiento de otros microorganismos, entre otros relacionados con especies diferentes a pylori que se encuentran en el estómago y pueden arrojar resultados similares a H. pylori, mediante las pruebas bioquímicas evaluadas.
El diagnóstico microbiológico puede llegar a ser dispendioso ya que se necesitan alrededor de 6 a 10 días para crecimiento e identificación de la bacteria, tiempo que en muchos casos no se dispone para iniciar un tratamiento eficaz y precoz contra el patógeno (19).
Además, algunas de estas pruebas identifican características bioquímicas del microorganismo, las cuales pueden ser positivas para otras bacterias con características similares inicialmente, como lo observamos en la práctica y en las cuales se encontraron microorganismos como Bacteroides spp, especies de Helicobacter cepa “flexispira” y Arcobacter spp aumentando la probabilidad de falsos positivos.
Las técnicas moleculares como la PCR son de gran utilidad y eficacia en el análisis de la presencia específica de la infección. La sensibilidad de la reacción para la detección de H. pylori puede alcanzar el 100%, y su especificidad podría ser mayor que las pruebas serológicas (20). Por esta razón en algunos laboratorios es la forma de diagnóstico rápida de infección de la bacteria.
En Colombia y algunos países de Latinoamérica existen diversos métodos de diagnóstico del microorganismo. En su mayoría toman como principio la actividad microbiológica, lo cual puede conllevar a una identificación incorrecta. (Lea también: Artículo de Investigación: Detección de Helicobacter Pylori por PCR del Gen 16s)
De igual manera, se ha visto limitada la identificación mediante pruebas microbiológicas como es cáncer tipo maltoma (MALT) y úlcera péptica donde existen cambios a nivel de la mucosa gástrica que falsean las pruebas dando una positividad errónea (19).
Existen estudios que soportan la función diagnóstica de la PCR 16s ADNr frente a pruebas de referencia para la detección específica de H. pylori, reflejando que representa una prueba robusta y rápida que abre puertas y posibilidades diagnósticas (20,21). Otros estudios corroboran las ventajas de las técnicas moleculares, como en el caso de la detección utilizando PCR multiplex (25) o por Q-PCR (16,22,23,27).
Existen varios genes blanco de amplificación por PCR que pueden evaluarse, dentro de los que están los genes de ureasa ureA, ureB y ureC; también diferentes regiones del gen ARNr 16S y 23S, que también muestran una alta sensibilidad en comparación con las pruebas de referencia (24).
En el presente estudio se obtuvieron resultados positivos en un tiempo promedio de 36 horas, teniendo en cuenta que en la metodología propuesta, las biopsias fueron incubadas para la obtención de una buena concentración de ADN que permitiera una adecuada amplificación por PCR.
Sin embargo, también pueden evaluarse protocolos de detección directamente a partir del ADN de biopsias maceradas (28). De esta forma la PCR podría llevar a resultados concluyentes en menos tiempo. De igual manera, este resultado se obtiene en un tiempo menor al que se emplearía realizando el diagnóstico microbiológico (18).
Los resultados obtenidos por PCR para la detección de H. pylori muestran la practicidad y rapidez en la detección de este microorganismo (29), y representan una opción primaria para la detección temprana de la infección ya que de acuerdo con los resultados obtenidos, el diagnóstico coincide con los resultados arrojados en el examen histológico.
Como estudio preliminar se ha demostrado la practicidad que ofrece para la detección rápida de H. pylori, pero se deben realizar otros estudios comparativos frente a las pruebas comúnmente utilizadas con el fin de estimar valores predictivos para esta prueba.
Conclusion
Los resultados obtenidos en este estudio demuestran que la PCR 16S ADNr es un método de identificación de H. pylori que se puede contemplar como técnica más eficiente y rápida para la detección de la bacteria, con respecto a las pruebas microbiológicas.
La PCR 16S ADNr es un método diagnóstico alternativo, se caracteriza por su alta sensibilidad y especificidad. Tiene como ventaja que es un método rápido, fácil, sencillo y relativamente económico, el cual debe utilizarse en laboratorios y centros hospitalarios para la detección de infecciones por H. pylori.
Referencias
1. Marshall B.; Warren, J. Unidentifed curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet.1984; 1: 1311-5.
2. Ishihara, S.; Fukuda, R.; Fukumoto, S. Cytokine gene expression in gastric mucosa: its role in chronic gastritis. J Gastroenterol.1996; 31:485-90.
3. WHO, International Agency for research on cancer. IARC monographs on the evaluation of the carcino¬genic risks to humans: Schistosomes, liver flukes and Helicobacterpylori. In: WHO, International Agency for research on cancer. Infection with Helicobacter pylori. Lyon: International Agency for Research on cancer; 1994. p. 177-241.
4. International Agency for research on Cancer.Schis¬tosomes, liver flukes and Helicobacter pylori.IARC Monographs on the Evaluation of carcinogenics risks to humans. Vol. 61. Lyon: IARC 1994.
5. Arismendi, G.; Hernández, I.; Mengual, E.; Abreu, N.; Molero, N.; Fuenmayor, A.; Lizarzábal, M. Esti-mación de riesgo de cáncer gástrico en pacientes con gastritis crónica asociada a la infección por Helicobacter pylori en un escenario clínico. Rev Gastroenterol Mex. 2013: 78(03): 135-43.
6. Ortega, J.; Espinosa, A.; Calvo, A.; Verdugo, P.; Pruyas, M.; Nilsen, E.;Villarroel, L.; Pandilla, O.; Riquelme, A.; Rollan, A. Helicobacter pylori infection in symptomatic patients with benign gastroduodenal diseases. Analysis of 5.664 cases. Rev Med Chile: 2010; 138: 529-535.
7. Coelho, L.; Leon, R.; Quigley, E. Latin-American con¬sensus conference on Helicobacter pylori infection. Am J Gastroenterology. 2000; 95:2688-91.
8. Cisneros, S. Mecanismos de resistencia de Helico¬bacter pylori a los antibióticos amoxicilina, claritromicina, levofloxacina y metronidazol. [Trabajo de grado]. Bogotá D.C: Facultad de Ciencias, Pontificia Universidad Javeriana; 2009.
9. Figueroa, M.; Cortés, A.; Pazos, Á. & Bravo, L. Susceptibilidad in vitro de Helicobacter pylori a amoxicilina y claritromicina obtenido a partir de biopsias gástricas de pacientes de zona de bajo riesgo para cáncer gástrico. Biomédica.2012; 32(1) Recuperado de https://www.redalyc.org/articulo.oa?id=84322454004
10. Bravo, L.; Cortés, A.; Carrascal, E.; Jaramillo, R., García, L.; Bravo, P.; Badel, A.; Bravo, P. Helicobacter pylori: patología y prevalencia en biopsias gástricas en Colombia. Corporación Editora Médica del Valle: Revista Colombia Médica.2003; 34(3).
11. Martínez, J.; Henao, S.; Granados, C. (2007). La gastritis crónica atrófica corporal y la edad. Rev Col Gastroenterol [serial on the Internet]. [Ci¬ted 2014 Oct 06]; 22(1): 17-22. Available from: https://www.scielo.org.co/scielo.php?script=sci_ arttext&pid=S0120-99572007000100005&lng=en.
12. Li, Z.;Zou, D.; Ma, X.; Chen, J.; Shi, X.; He, J. et al. Epidemiology of peptic ulcer disease: endoscopic results of the systematic investigation of gastroin¬testinal disease in China. The American Journal of Gastroenterology [serial on the Internet]. (2010, Dec), [cited August 20, 2012]; 105(12): 2570-2577. Available from: MEDLINE Complete.
13. McColl, Kenneth EL. “Helicobacter pylori infection.” New England Journal of Medicine 362.17 (2010): 1597-1604.
14. Rodicio, M.; Mendoza, M. Identification of bacteria through 16S rRNA sequencing: Principles, methods and applications in clinical microbiology. Departa¬mento de Biología Funcional. Área de Microbiología. Universidad de Oviedo. España, EnfermInfeccMicro¬biolClin 2004; 22(4):238-45.
15. Chen, T., Meng, X., Zhang, H., Tsang, R. W., & Tsang, T. K. Comparing multiplex PCR and rapid urease test in the detection of H. pylori in patients on proton pump inhibitors. Gastroenterology research and practice, 2012.
16. He, Q.; Wang, J.; Osato, M.; Lachman, L. Real-time quantitative PCR for detection of Helicobacter pylori. J ClinMicrobiol. 2002; 40(10): 3720-3728.
17. Yantiss, R.;Odze, R. Optimal Approach to Obtaining Mucosal Biopsies for Assessment of Inflammatory Disorders of the Gastrointestinal Tract.AJG. 2009; 104:774–783.
18. Bayona, M. Condiciones microbiológicas para el cultivo de Helicobacter pylori. Rev Col Gastroenterol. 2013; 28 (2).
19. Duś, I.;Dobosz, T.; Manzin, A.; Loi, G.; Serra, C., & Radwan-Oczko, M. Role of PCR in Helicobacter pylori diagnostics and research–new approaches for study of coccoid and spiral forms of the bacteria. PostepyHig Med Dosw (Online).2013; 67: 261-268.
20. Vinette, K.; Gibney, K.; Proujansky, R.; Fawcett P. Comparison of PCR and clinical laboratory tests for diagnosing Helicobacter pylori infection in pediatric patients. BMC Microbiology, 2004; 4:5.Published online Jan 27,2004. doi: 10.1186/1471-2180-4-5
21. Monstein, H.; Nikpour, B.; Jonasson, J. Rapid molecu¬lar identification and subtyping of Helicobacter pylori by pyrosequencing of the 16S rDNA variable V1 and V3 regions. FEMS Microbiology Letters.2001; 199: 103– 107. doi: 10.1111/j.1574-6968.2001.tb10658.x
22. Scaletsky, I.; Aranda, K.;García, G.; Goncalves, M.; Cardoso, S.; Iriya, K. & Silva, N. Application of Real-Time PCR Stool Assay for Helicobacter pylori Detection and Clarithromycin Susceptibility Testing in Brazilian Children. Helicobacter. 2011; 16(4):311-315.
23. Ramírez, M.; Lario, S.; Casalots, A.; Sanfeliu, E.; Boix, L., Garcia, P.; Sánchez, J.; Monserrat, A. et al.Real-time PCR improves Helicobacter pylori detec¬tion in patients with peptic ulcer bleeding. PloSone. 2011; 6(5):1-7.
24. Moncayo, J.; Santacruz, J.; Álvarez, A.; Franco, B.; López, M.; Ángel, A., & Serrano, H. Comparación de métodos diagnósticos en la infección por Helicobacter pylori en Quindío, Colombia.2013.
25. Lehours, P.; Siffré, E.;Mégraud, F. DPO multiplex PCR as analternativeto culture and susceptibilitytes-tingtodetectHelicobacter pylori and its resistance to clarithromycin. BMC Gastroenterology.2011; 11(112).
26. Chattopadhyay, S.; Patra, R.; Ramamurthy, T.; Chowd¬hury, A.; Santra, A.; Dahli,G.; Bhattacharya, S.; Berg, D.; Nair, G.; Mukhopadhyay AK. Multiplex PCR assay for rapid detection and genotyping of Helicobacter pylori directly from biopsy specimens. J ClinMicrobiol. 2004; 42(6):2821- 2824.
27. Belda, S.; Sáez, J.; Santibáñez, M.; Rodríguez, J.; Galiana, A.; Sola-Vera,ggJ.; Montserrat Ruiz-García, M.et al. Quantification of Helicobacter pylori in gastric mucosa by real-time polymerase chain reaction: comparison with traditional diagnostic methods.” Diagnostic microbiology and infectious disease. 2012; 74(3): 248-252.
28. Smith, S.; Fowora, M.; Otegbayo, J.; Abdulkareem, F.; Omonigbehin, E.; Adegboyega, A.; Contreras, M.; Haas, R. Comparison of PCR with other diagnostic techniques for the detection of Helicobacter pylori infection in patients presenting with gastroduodenal symptons in Nigeria. Int J MolEpidemiol Genet 2011; 2(2):178-184.
29. Patel, S. K., Pratap, C. B., Jain, A. K., Gulati, A. K., & Nath, G. Diagnosis of Helicobacter pylori: What should be the gold standard? World journal of gas¬troenterology: WJG 2014, 20(36), 12847.
Recibido: mayo 28, 2015
Aceptado: julio 23, 2015
Correspondencia:
Andrès Gutiérrez
andresgutierrez@colombia.com


