1. Tratamiento
Concomitantemente con la aparición de todas las nuevas sustancias hormonales ya antes descritas la observación de sus respectivas patologías y la creciente búsqueda de mejores ayudas diagnósticas, ha surgido siempre la preocupación terapéutica, tanto desde el punto de vista médico como quirúrgico. A este respecto en la mayoría de ocasiones se presenta polémica y cada grupo respalda sus tesis con estadísticas. Por consiguiente, es nuestro interés mostrar las posibilidades de manejo, si nos es posible haciendo énfasis en la que se considere la más adecuada en estos momentos.
A. Insulinoma
1. Manejo médico
En algunos casos en que siendo tumor maligno a la vez presenta metástasis, o si falla la localización del insulinoma o en general cualquier condición del paciente que haga peligrosa o poco exitosa una intervención quirúrgica se piensa en la posibilidad del tratamiento farmacológico. Muchas han sido las drogas utilizadas.
La droga más utilizada ha sido el diazóxido tomado por vía oraL el diazóxido es una sulfonamida con un efecto hiperglicemiante; su mecanismo de acción no está bien definido, aunque parece que su acción la ejerce fuera del páncreas (57), y otros hablan de su acción dependiente de la liberación de epinefrina (58). Básicamente el diazóxido es una droga que ha sido usada para el tratamiento de la hipoglicemia, la cual se presenta en los insulinomas. El efecto es, en general, transitorio (8 horas), la dosis habitualmente usada es de 3 a 8mg/kg, algunos de sus efectos adversos pueden ser náuseas o hirsutismo, cuando se administran a dosis hiperglicemiantes. Es útil su uso simultáneo con triclormetiazida. La difenilhidantoína ha sido utilizada en insulinomas como droga hiperglicemiante, inhibiendo la secreción de insulina, probablemente al disminuir el sodio intracelular. Los resultados han sido variables aunque lo más probable es su poca utilidad (59). Más infrecuentemente se ha utilizado la clorpromazIna.
Para los casos no resecables se ha utilizado la estreptozotocina; este es un antibiótico antitumoral derivado del “Streptomyces achromogenes”; se ha documentado un caso con metástasis hepáticas que después de 6 meses’ de tratamiento presentó una completa regresión del tumor (60). Parece ser que la dosis no debe exceder de 1.5 a 2.0 g/m2 por infusión intravenosa, por intervalos de al menos 2 meses, con mayor razón si hay daño renal, presentándose, después de cada infusión, náusea y vómito por un día y anorexia por tres (61).
También se informa el uso exitoso de la mitramicina, un inhibidor de la síntesis de RNA en pacientes con hipoglicemia intratable, debido a insulinoma con metástasis (62).
Un control satisfactorio, aunque no ideal de la hipoglicemia refractaria producida por insulinomas se ha realizado con inyecciones de glucagón, zinc, dieta y corticosteroides (63).
2. Manejo quirúrgico
Cuando un insulinoma es encontrado, el procedimiento quirúrgico de elección se basa en el lugar, número, volumen, naturaleza y enucleabilidad del tumor. Se debe realizar una observación y palpación intraoperatoria cuidadosa del páncreas, las cirugías de primera elección son, en primer lugar, la enucleación del tumor y, en segundo lugar, la resección pancreática distal (64). (Fig.10).
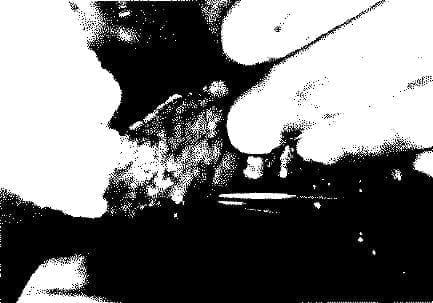 Sólo en alrededor del 10% de los casos se puede hacer necesaria una pancreatoduodenoectomía, una resección total o subtotal o una laparatomía exploradora. Si la lesión no ha sido localizada preoperatoriamente, el páncreas debe ser palpado en toda su extensión, lo que puede efectuarse por liberación del borde inferior del peritoneo, así como de la cabeza del órgano mediante movilización del duodeno (41).
Sólo en alrededor del 10% de los casos se puede hacer necesaria una pancreatoduodenoectomía, una resección total o subtotal o una laparatomía exploradora. Si la lesión no ha sido localizada preoperatoriamente, el páncreas debe ser palpado en toda su extensión, lo que puede efectuarse por liberación del borde inferior del peritoneo, así como de la cabeza del órgano mediante movilización del duodeno (41).
La distribución de los tumores es bastante igual a lo largo del páncreas, de modo que existen, cuando menos, 50% de probabilidades de resecar el tumor con la hemipancreatectomía distal. Durante el acto operatorio es necesario medir el nivel de la glicemia, ya que la resección de un insulinoma se reflejará en hiperglicemia.
Las conductas bastante discutidas para el manejo de la enfermedad cuando no se encuentra el tumor han ido, desde resección distal a ciegas, hasta observación por uno a dos años cuando el tumor haya aumentado de tamaño; en ocasiones no se trata de un tumor sino de una hiperplasia insular difusa. Se han utilizado técnicas intraoperatorias para localización como la pancreatografía, colangiografía, inyección de toluidina azul (65) en las arterias esplénica y gastroduodenal y glicemias seriadas en el acto operatorio, siendo esta la más útil como ya se había dicho. En términos generales nunca se debe efectuar una pancreatectomía total en una primera intervención.
Definitivamente el tratamiento curativo de esta entidad es quirúrgico, y nos remitimos a los hallazgos de una serie en la Clínica Mayo. Cuarenta y siete pacientes con insulinomas benignos fueron curados quirúrgicamente, treinta y tres por enucleación del tumor y catorce por pancreatectomía parcial. Cuatro de seis pacientes con tumores múltiples tuvieron curación después de pancreatectomía parcial y en algunos casos excisión de los tumores remanentes. Un paciente con metástasis mejoró totalmente la sintomatología después de pancreatectomía y remoción de los ganglios regionales comprometidos (66). Causas de mortalidad post-operatoria pueden ser el absceso subfrénico, bronconeumonía, embolias, fístules y pseudoquistes pancreáticos; la hiperglicemia posoperatoria no se considera una complicación.
Como alternativa al tratamiento quirúrgico se puede utilizar la embolización del tumor, con colágeno microfibrilar disuelto en solución salina (67). Cuando se realiza una pancreatectomía distal sin haber podido localizar el tumor, esta se debe hacer desde la vena porta hasta el bazo, pues la mayor parte de los tumores ectópicos se halla en el hilio esplénico.
En cuanto a la pancreatectomía distal se recomienda la esplenectomía para movilizar mejor la cabeza del páncreas. Primero se escinde el omento gastrocólico para exponer el páncreas. En la esplenectomía se ligan proximalmente las arterias y vena esplénicas antes de movilizar el bazo y la cola del páncreas. Si no se reseca el bazo se eleva la cola y se continúa la disección. Las venas que desembocan en la esplénica se ligan con seda fina. El cuello glandular, donde generalmente se incide, está casi siempre estrechamente relacionado con la unión de las venas mesentéricas superior y esplénica; en esta zona hay que ser cautelosos para evitar hemorragias molestas. El extremo abierto del páncreas escindido se cierra con suturas de seda fina si el extremo es bicelado. Hay mayor seguridad si se asegura un catéter de tamaño conveniente en el conducto distal y se le saca a través de la pared abdominal por medio de una sonda. En el extremo distal del páncreas se coloca un dren de penrose.
Para la excisión local de un tumor no se indica una disección roma por el peligro de una ruptura ductal y posterior fistulización. Si una ruptura ocurre el conducto deberá arreglarse inmediatamente con sutura de seda fina. Cuando se realiza una enucleación, previamente a esto debe realizarse una cuidadosa identificación por medio de inspección y palpación del páncreas completo, como mínimo. (Tabla 4).
(Modificado de Aldrete JS et al: Artcriography with simultaneous gastric distention to detect insulin-secrcting tumors 01′ the pancreas. South Med. }our 76 ISl2X, ISlX3) (32). eo-autor de este artículo es el doctor Francisco Hcnao, del Hospital San Ignacio. de Bogotá.
B. Glucagonoma
1. Manejo médico
La terapia farmacológica ha sido utilizada con variables resultados en los casos de síndrome de glucagonoma intratables o metastásicos. La estreptozotocina ha sido administrada por períodos hasta de dos años, con respuestas diversas en pacientes con metástasis hepáticas; esta droga también se ha utilizado en eombinación con el 5-fluorouraci!o.
La dacarbazina (Diaminotriazenoimidazol carboximida), se ha usado obteniendo resultados aún menos efectivos y efectos tóxicos. También se ha utilizado la L-Asparaginasa.
El eritema necrolítico manejado con la administración de zinc o la hiperalimentación parenteral puede traducirse en beneficios para el paciente. Hace más o menos un lustro se ha venido trabajando con un análogo de larga acción de la somatostatina (SMS 201-995) el cual puede ser administrado por inyección subcutánea (17); se administran 50 ug 2 veces al día mezclado con insulina; aún falta una mayor casuística para determinar adecuadamente los hasta ahora satisfactorios resultados a corto plazo.
2. Manejo quirúrgico
Si el diagnóstico se hace cuando el tumor aún estálocalizado, la resección quirúrgica puede ser curativa; en menos del 3WYr de los casos esto se logra y más o menos un 2W,1 de los pacientes operados presenta recidiva del tumor. La cirugía a utilizar es la enucleación del tumor abarcando parte del tejido circundante y la resección de todas las metástasis en la medida de lo posible.
Como medidas paliativas se puede utilizar la embolización de la arteria hepática.
C. Somatostatinoma
El primer caso informado fue observado durante una colecistectomía en la cabeza del páncreas; se encontraron metástasis hepáticas, pancreáticas y duodenales, las cuales fueron resecadas; no obstante la paciente se deterioró y murió (6S). Debido a la rarísima aparición de esta patología, describiremos el manejo de un caso al cual se le demostró una masa vascular en la arcada pancreaticoduodenal por arteriografía. Su manejo previo con dieta, tolbutamida, fenformín e insulina NPH, había sido insatisfactorio.
En la laparotomía practicada se observó una masa en la cabeza del páncreas sin metástasis aparentes; el tumor se resecó completamente junto con la cabeza del páncreas, el duodeno entero, alrededor del 50% del estómago, el colédoco distal y los ganglios regionales. Veinte meses después la paciente permanecía asintomática y sin ¡ecurrencias del tumor (35).
Se menciona el uso de la estreptozotocina, 5-fluorouracilo, decarbazina y doxorubicina (22). En un paciente con somatostatinoma se utilizó interferón lográndose la suspensión
de la terapia con insulina (69).
D. Vipoma
Como en los anteriores casos el tratamiento básicamente es quirúrgico. En general se realiza enucleación del adenoma pancreático y sus metástasis; en algunas instituciones la pancreatectomía subtotal es la cirugía de elección, debido a que posiblemente la hiperplasia es responsable de algunos casos (33), aunque para la misma situación esta técnica no ha sido muy efectiva en otras instituciones (70). En un estudio, analizando la utilidad del interferón, se obtuvieron respuestas objetivas (remisión de la diarrea y la congestión facial) en el 10OC.!dce) los pacientes con Vipoma (69); para el manejo de la diarrea se ha utilizado somatostatina-14 (8 mg/kg/hora en 24 horas), inhibidores de las prostaglandinas (indometacina) o esteroides como la prednisona, al igual que en otros casos la estreptozotocina fue utilizada en el tratamiento de las metástasis (71 ).
E. Gastrinoma
Los conceptos con respecto al tratamiento de esta entidad han variado radicalmente los últimos años en comparación de lo que se realizaba en un principio. Desde la descripción del síndrome hasta ya entrados los años 70 se decía que las únicas cirugías factibles eran la gastrectomía total o la escisión del gastrinoma pancreático y pancreatectomía, lo cual llevaba a una altísima mortalidad postoperatoria debido a complicaciones principalmentc nutricionales: los pacientes respondían pobremente al tratamiento con antiácidos, drogas anticolinérgicas y radioterapia (48).
La diferencia terapéutica la marcó la apanc\on de los ntihistamínicos tipo H2; de este tipo de drogas se dijo eran curativas al ponerse en boga su uso: aún más, se habló de la gastrectomía química (22). Sin embargo, un análisis más exhausti vo llevó a conductas más apropiadas dos años después que los laboratorios Smith Kline & French pusieron a la disposición del público el Tagamet; se informó sobre una experiencia de esta droga para el Z-E, encontrándose que en dos tercios de los pacientes tratados con 300 mg cada 6 horas por vía oral, había respuesta; sólo unos muy pocos pacientes presentaron ginecomastia o disfunción hepática como efectos secundarios, los cuales fueron controlados adecuadamente (72). Sin embargo, el mismo doctor Zollinger, 25 años después de haber descrito el síndrome, diría que la cimetidina solamente sería de utilidad en el control de las manifestaciones del gastrinoma que comprometían la vida, léase úlcera péptica y sus complicaciones y que definitivamente no alteraba el crecimiento progresivo del tumor. Por otro lado, lo que sí se modificó totalmente fue la utilización de las antiguas cirugías (73). Los doctores Zollinger y Ellison decían también que el manejo quirúrgico debería dirigirse a la resección agresiva del tumor y vagotonía, con cimetidina postoperatoria y la gastrectomía total debería reservarse para las fallas con la cimetidina o aquellos que no quisieran tomar la droga toda la vida. Otros opinan que esta cirugía está indicada en pacientes cuyos tumores no son susceptibles de resección o que se resisten o no pueden seguir un tratamiento médico rígido (74). La gastrectomía total es aún la cirugía de elección en definitivas cuentas; si el tumor es localizado automáticamente, su resección puede ser una buena medida paliativa, si no curativa (72). Las metástasis también deben resecarse en la medida de lo posible. En caso de no localizarse se prefiere la denervación (vaguectomía), un proceso de derivación y manejo médico. La gastrectomía total se realiza cuando se localiza el tumor y hay indicación, descartándose hoy en día de plano su asociación con pancreatectomía total
.
La tubercidina, un antibiótico que actúa como una purina falsa, al ser incorporado al DNA o RNA, ha sido informada como un agente útil en la remisión de esta entidad aunque hoy en día es muy discutido (75). También se ha utilizado la estreptozotocina. AntiH2 tipo ranitidina o famotidina se utilizan en dosis más altas que las de su indicación corriente. El interferón ha mostrado resultados variables al respecto; y cuando el Z-E se presente acompañado de MEA 1 se hará el tratamiento respectivo, por ejemplo, tratamiento quirúrgico del hiperparatiroidismo e hipercalcemia (22).
El objetivo de la gastrectomía total simple es la remoción total del estómago, esófago adyacente; ligamentos y fascia contiguos; también la primera porción del duodeno.
F. Otros
Apudomas que secreten PP, ACTH, GRF y otras sustancias hormonales, ya sea en forma aislada o simultánea, se presentan muy esporádicamente y se reflejan en una bajísima casuística; por ende la aproximación terapéutica hacia estas entidades debe ser individualizada ya que no se han establecido esquemas prácticos.
Si la producción hormonal se presenta con alguno de los tumores descritos en las páginas anteriores se enfocará el manejo hacia dichas patologías.
Los PPOMAS, exclusivamente productores de PP, generalmente son asintomáticos requiriendo únicamente controles periódicos.
Al no haber esquemas se utilizarán cuando sea del caso drogas del armamentarium antitumoral ya descrito y cirugías si están indicadas y tienen relación con el caso particular del paciente.
Si se encuentra un tumor productor de GHRH o ACTH se practicará extirpación quirúrgica. (76, 77, 78, 79, 80, 81,82,83,84).
Aunque según habíamos mencionado, se habla de que el 78% de los ACTH-omas (o síndrome de secreción ectópica de ACTH) son de origen pancreático (53), el único caso que hemos visto se originó en un carcinoma de células en avena del pulmón. Esta paciente de 48 años ingresó al Hospital de San Ignacio por una posible compresión medular a nivel de TIa. Por la fascies cushingoide, una diabetes mellitus de comienzo reciente y el antecedente de un tumor de mediastino anterior resecado, un año antes se sospechó un síndrome de secreción ectópica de ACTH, (SSEA) que se confirmó al demostrar niveles de cortisol superiores a 1.500 nmollL, aún bajo supresión con 8 mg de dexametasona (Tabla No. 5). Falleció 10 días más tarde en shock hipovolémico e insuficiencia respiratoria, habiendo presentado hipokalemia pertinaz con niveles de potasio que bajaron hasta 1.6 mEq/L. En la autopsia se encontró un tumor pequeño de células en avena en el lóbulo medio del pulmón, con metástasis a pleura, pericardio, diafragma, hipófisis y suprarrenales que, además, estaban francamente hiperplásicas. A nivel medular se encontró una hidromielia. La hiperpigmentación, uno de los signos cardinales del SSEA, no fue muy notoria en esta paciente, como sí lo fue la hipokalemia y también (a la autopsia) la marcada osteoporosis de cuerpos vertebrales y la hipertrofia e hiperfunción de las glándulas suprarrenalcs (85).

Bibliografía
(Continuación de la Parte 1)
21. STEI’ANINl P, CARBüNI M, PATRASSI No BASOLI A. Beta islet cell tumors of the pancreas: results of a study on 1067 cases. Surgery. 1974;75:597-609.
22. WEIL C. Gastroenteropancreatic endocrine tumors. K/inische Wochenschrift, 1985;63:433-459.
23. KAVLIE H, WHITE TT. Pancreatic islet beta cell tumors and hyperplasia, experience in 14 Seattle Hospitals. Ann Surg, 1972;175:326-335.
24. JACOME A. Insulinomas. Medicina, 1986;13:6-15.
25. STEINKF 1, SüELDNER JS. Response of serum insulin to intravenous tolbutamide in patients with hipoglycemia. In BUTTERFIFLDWJH, VAN WESTERING W. To/hutamide … afier ten years. Excerpta Medica Foundation, New York 1967; 145-146.
26. KUMAT D, MEHTAUA SD, MILLER LV. Diagnostic use of glucagon induced insulin response: studies in patients with insulinoma or other hypoglycemic conditions. In SCHWARTS TB, RYAN WG, BECKER FO: The vearhook of endocrin%gy. Year Book medical publisherS: Chicago, 1975;270-271
27. TURNER Re. HARRIS E. Diagnosis of insulinomas by suppression tests. In SCHWARTZTB oRy ANWG, BECKER FO. The year hook ofendoerin%gv. Year book medicalpublisherso Chicago, 1975;266-267.
28. TURNFR RC, HARRIS E, MORRISPJ, LEE ECG. Localization of insulinomas. Lancet, Marcho 1978;515-518.
29. RFICHARDT W, INGEMANSSON S. Selective vein catheterization for hormone assay in endocrine tumors 01’the pancreas. Acta Rad Dia¡,;, 1980;21:177-187.
30. SIGEL B, COELHO JCU, et al. Detection of pancreatic tumors by ultrasound during surgery. Arch Surg, 1982;117:1058-1061.
31. STEFANINI P. CARBONI M, DE BERNARDINIS G et al. Value of arteriography in diagnosis and treatment of insulinomas. In SCHWARTS TB, RYAN WG: The year hook of endocrin%gy. Year book medical publishers, Chicago, 1977;221-222.
32. ALDRETE JS, HAN SY, HENAO F. Arteriography with simultaneous gastric distention detect insulin secreting tumors ofthe pancreas. South Med J, 1983;76: 1524-1529.
33. CARO A. Cirugía de/ páncreas. Fundación OFA, Bogotá 1984; 195-224.
34. JACOME A, ARANGO G. Insulinoma, análisis de cinco casos. Rev Soc Col Endocrino/, 1982;13:106-118.
35. GANDA OP, WEIR, SOELDNER JS, et al. “Somatostatinoma”, a somatostatin- containing tumor of the endocrine pancrea~. New Eng J Med, 1977;296:963-967.
36. DUNNINcK NR, DOPPMAN JL, MILLS SR, Mc CARTHY DM. Computed tomographic detection of non beta pancreatic islet cell tumors. Radi%gy, 1980; 135: 117-120.
37. AXELROD L, BUSH MA, HIRSCHHJ, Loo SWH. Malignant somatostatinoma: Clinical features and metabolic studies. /n The year hook o{endocrin%gy, Year book medical publishers, Chicago, 1982; 193-194.
38. Mc GAVRAN MH, MH, RECANT L, POLK HC et al. Glucagon Secreting alpha-cell carcinoma of pancreas. In SCHWARTZ TB: The Year Book of Endocrinology, Year book medical publishers, Chicago, 1966-1967;274-276.
39. HIGGINS GA, RECANT L, FISCHMAN AB. The Glucagonoma syndrome, surgically curable diabetes. AmJ Surg, 1979;137:142-147.
40. NORTON JA, KAHN CR et al. Aminoacid deficiency and the skin rash associated with glucagonoma. Ann Int Med,1979;91:213-215.
41. HIGGINS GA. Tumores de células de los islotes pancreáticos: Insulinoma, gastrinoma y glucagonoma. Clin Quir Norteam: 133- 143.
42. STACPOOLE PN, JASPAN J, KASELBERG AG. Familial glucagonoma syndrome: genetic, clinical and biochemical features. In SCHWARTZ TB, Ry AN WG: The year hook of endocrinology, Year book medical publishers, Chicago 1982;251-252.
43. VERNER JV, MORRISON AB. lslct cell tumor and syndrome of refractory watery diarrhea and hypokalemia. In GORDAN GS: The year hook of endocrinology; the year book medical publishers, Chicago, 1958-1959; 196-197.
44. LOEHRY CA, KINGHAM JGC, WHORWELL PJ. Watery diarrhea and hypokalemia associated with pheochromocytoma. In SCHWARTZ TB, RYAN WG: The year book of endoerinology,
45. JAFFE BM, CONDON S. Prostaglandins. E and F in endocrinediarrheagenic syndromes. AnnSurg, 1976;184:516-522.
46. ADRIAN TE, UTTENTHAL LO, WILI.lAMS RJ, BLOM SR. Secretion of pancreatic polypeptide in patients with pancreatic endocrine tumors. New Eng J Med, 1986;315:287 -291.
47. ZOLLlNGER RM, ELLlSON EH. Primary peptic ulcerations of the jejunum associated with islet cell tumors of the pancreas. Ann surg, 1955;142:709-723.
48. ISENBERG JI. WALSH JH, GROSSMAN MI. Zollinger-Ellison syndrome. Castroenterologv, 1973;65:140-165.
49. MATON PN, GARNER JO, JENSEN RT. Cushing’s syndrome in patients with the Zollinger Ellison Syndrome. New Eng J Med, 1986;315:1-5.
50. Mc GUIGAN JE, TRUDEAU WL. lnmunochemical measurement of elevated Icvels of gastrin in the serum of patients with pancreatic tumors of the Zollinger-Ellison variety. New Eng J Med, 1968;278:1308-1313.
51. CHERNER JA, DOPPMAN JL, NORTON JA et al. Selective venous sampling for gastrin to localyze gastrinomas, prospecti ve assessment. Ann Int Med, 1986; 105:841-847.
52. VINIK Al, THOMPSON N. Controversies in the management of Zollinger Ellison syndrome. Ann Int Med,1986; 105:956-959.
53. IMuRA H, MATsuKuRA S, YAMAMOTO H. et al. Studies on ectopic ACTH- producing tumors: 11. Clinical and Biochemical Features of 30 cases. In, SCHWARTS TB, RYAN WG: The year book of endocrinology. Year book medicalpublishers, 1976;362-363.
54. HOFELDT FD, DIPPE SE, LEVIN SR. Effects of diphenylhydantoine upon glucose – induced insulin secretion in three patients with insulinoma. Diabetes, 1974;23: 192-197.
55. THORNER MO, PERRYMAN RL, CRONIN MJ et al. Somatotroph hyperplasia: successful treatment of acromegaly by removal of pancreatic islet tumor secreting growth horrnone releasing factor. In SCHWARTZTB, Ry AN WG, The year book of endocrinology,year book medical publishers, Chicago, 1984;49-50.
56. ALLlSON MC, RENFREW CC, WEEB WJS, CHAPPELL ME, POUNDER RE. Neuroendocrine islet cell tumor
roducing gastrin and ACTH in a patient with calcifying chronic pancreatitis. Cut, 1985;26:426-428.
57. THERVET F, PATRI B, CRUS A et al. Langerhans adenoma and intravenous diazoxide test. In SCHWARTZ TB. The year hook of endoerinology. Year book medical publishers,Chicago, 1970;231.
58. DRAsH A, WOLFF F, LANGS H, BLlZZARD R. Diazoxide induced diabetes Mellitus in hypopituitary dwarf. In SCHWARTZ TB; The year book of endocrinology, Year book medica1 publishers, 1966-1967;259-260.
59. HOFELDT FD, DIPPE SE, LEVIN SR. Effects of diphenylhydantoine upon glucose – induced insulin secretion in three patients with insulinoma. Diabetes, 1974;23: 192-197.
60. SONREIBMAN PH, DE COLIREN L, ARKY RA. Metastatic insulinoma treated with streptozotocin, Ann Int Med, 1971 ;74:399-403.
61. TAYLOR III SG, SCHEARTS TB, RYAN MG, ZANNINI 11. Streptozotocin therapy for metastatic insulinoma. In SCHWARTS TB: The year book of endocrinology. yearbook medical publishers, Chicago 1971;234-235.
62. KIANG DT, FRENNING DH, BAVER GE. Mithramycin for hipoglycemia in malignant insulinoma. In SCHWARTZTB,RYAN WG: Year book of endocrinology. Year bookmedical publishers, 1979;223-224.
63. ROTH H, THIER S. SEGAL S. Zinc glucagon in the management of refractory hypoglycemia due to insulin producing tumors. New Eng J Med. 1966;274:493-497.
64. SAD01’1′ L, GORDON 1, GOLDMAN S. Amelioration of hypoglycemia in a patient with malignant insulinoma during development of ectopic ACTH syndrome. In SCHWARTZ TB, RYAN WG: The Year book of endocrinology. Year book medical publishers, Chicago,1976. 363-364.
65. KEAVENY TV, TAWES R, BELZER FO. New Method for intraoperative identification of insulinomas. In SCHWARTZ TB, RYAN WG, BECKER FO: The year book 01″ endocrinology. Year book medical publishers, 1982; 193- 194.
66. SERVICE Fl, DALE Al. Insulinoma, clinical and diagnostic features of 60 consecutive cases. Mayo Clinic proc.1976;417-429.
67. MOORE Tl PETERSON LM, SMITH Rl, HARRINGTONDP. Successfull arterial embolization of an insulinoma. In SCHWARTZ TB, Ry AN WG: The year book 01″ endocrinology. Year book medical publishers, Chicago, 1983;271- 272.
68. LARSSON LI, HOLST 11, HIRSCH MA et al. Pancreatic somatostatinoma, clinical features and physiological implications.Lancet. March, 1977;666-668.
69. ERIKSSON B, OBERG K, ALM G et al. Treatment of malignant endocrine pancreatic tumors with human leukocyteinterferon Lanc’et, 1986;2: 1.307-1.308.
70. SAlO SI, FALOONAGR. Elevayed plasma and tissue levels of vasoactive intestinal polypeptide in the watery-diarrhea syndrome due to pancreatic bronchogenic and other tumors. New Eng J Med, 1975;293-155-160.
71. BLOOM SR, LEE YC, LACRONTE1M, ABBASS A, SONDAG D. BAUMANN RS WEILL lP: Two patients with pancreatic apudomas secreting neurotensin and VIP. In Year book ofendocrinology. Year book medical publishers, Chicago, 1984;328-330.
72. Mc CARTHY DM. Report of the United States experience with cimetidine in Zollinger-Ellison syndrome and other hypersecretory states. Gastroenterology. 1978;74:453-458.
73. ZOLUNGER RM, ELUSON EC, FABRI Pl, 10HNsoN 1, SPARKS 1, KEREY L. Primary peptic ulcerations of thejejunum associated with islet cell tumors. Ann surg. 1980; 192:422-427.
74. BONFILS S, LANDOR lH, MIGNON M, HERVOIR P. Results of surgical management in 92 consecutive patients with Zollinger-Ellison Syndrome- Ann Surg. 1981; 194:692-697.
75. SCHEIN P, DE LELLlNS R et al. Management of islet cell tumors. Ann Int Med. 1973;79:239-257.
76. CATLAND S. Tumores funcionales de las células de los islotes pancreáticos y síndromes asociados. En MAZZAFERRI EL. Endocrinología, un análisis de endocrinología clínica. Fondo Educativo Interamericano. 1978;73-83.
77. KUHN PP, el. al. Ultrasonic demostration of small pancreatic islet cell tumors J Clin Ultrasond, 1982: 10: 173-175.
78. KUKORA lS. Gastrointestinal hormones. In HARDY 10.Surgery. Lippincott Company. Philadelphia, 1983;437- 444.
79. NARDI G. Neoplastic diseases of pancreas. In NORA PF (ed). Operative surgerv. principies and techniques. 2nd ed. Lea & Febiger, Philadelphia, 1980;418,611-615.
80. PATIÑO lF. Apudomas, Parte 1. La nueva endocrinología y el sistema endocrino gastroenteropancreático. Acta Med Col. 1984;9:65-72.
81. PEARSE AGE, POLAK 1M. Neural crest origin of endocrine polipeptide (APUD) cells of gastrointestinal tract and pancreas. In SCHWARTZ TB, RYAN WG, BECKER FO. The year book oi endocrinology, Year book medical publishers, Chicago, 1972;334-335.
82. SAMOLS E, MARKS V. Evaluation of the intravenous tolbutamide test in the recognition and differential diagnosis of spontaneous hypoglycemia. In BUTTERFlELD W1H, VAN WESTERING W. Tolbutamide … after ten years. Excerpta Medica Foundation, New York, 1967;147-154.
83. STACHURA 1, TARNAWKI A et al. Effect of glucagon on human gastric mucosa. Histochemical studies. In SCHWARTZTB, Ry AN WG. The year hook on endocrinology. year book medical publishers. Chicago, 1982;255-256.
84. WILLIAMS TH. Gastrointestinal hormones. In WILLlAMS RH. (ed) Texthook ol”endocrinology.6th ed. WB Saunders Company, Philadelphia 1981 ;690-707.
85. ASCHNER P, lACOME A, lIMENEZ L. ANZOLA MI. Síndrome de secreción ectópica de ACTH por un carcinoma de células en avena del pulmón. Acta Médica Col, 1985; IO: 259- 262.