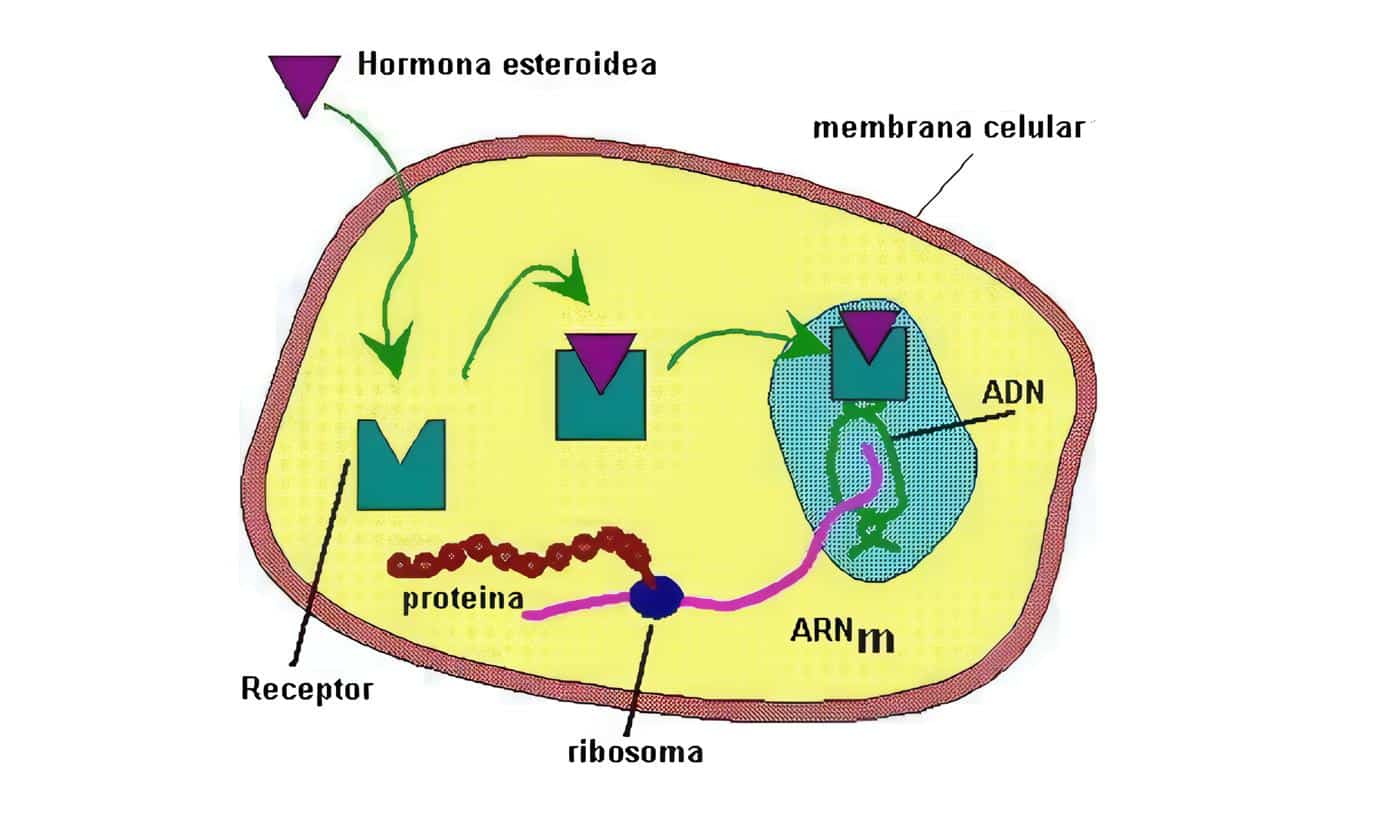
Localizados en el citosol, son los utilizados por las hormonas esteroides (estrógenos, glucocorticoides, progesterona, minerlocorticoides, andrógenos), vitamina D, oxisteroles, ácidos biliares, ácidos retinoicos (todas las isoformas trans y 9-cis), hormonas tiroideas, ácidos grasos, leucotrienos y prostaglandinas, que alcanzan el citoplasma celular mediante difusión pasiva.
Tras su unión se trasladan al núcleo-translocación (hormonas esteroides) o bien se forman en el propio núcleo (hormonas tiroideas), uniéndose a secuencias específicas reguladores de DNA, controlando así la tasa de trascripción de RNA a partir de los genes controlados por estos elementos reguladores, y así la síntesis de ARNm aumenta o disminuye y la síntesis de proteínas citoplasmáticas que median los efectos de la hormona se incrementa o reduce.
Los esteroides del tipo hormonas sexuales, los calciferoles, los retinoides y tambièn las hormonas tiroideas ejercen efectos de largo plazo sobre las células blanco estimulando su crecimiento y diferenciación, regulando la síntesis de proteínas específicas. Son hormonas hidrofòbicas y lipofìlicas que son transportadas por proteínas sèricas (Vg. TBG, CBG), atraviesan la membrana celular (¿por difusión pasiva?)y se ligan a unos receptores que se encuentran en el citosol (Figura 3).
Dichos receptores intracelulares (proteicos):
Están fijados a una clase de proteínas de choque por calor, las Hsp 90 (proteínas que juegan un papel protector especial ante diferentes clases de estrés, entre ellos el calor, y que son responsables de los cambios evolutivos que sufren los organismos a través de millones de años).
Tienen dos dominios, uno fijador de los esteroides (LBD) que está al lado de una región variable N-terminal en su parte interna, comprometido con la activación del complejo hormona-receptor; otro dominio fijador del DNA (DBD) cercano al terminal C variable que en la activación de la trascripción, señalará cuál gen será activado por el receptor; para evitar que se fije a regiones específicas del DNA, este terminal COOH se liga a una proteína inhibitoria cuandoquiera que no hay un ligando presente.
Además hay una región “bisagra” variable, situada entre los dos dominios mencionados y que señala el movimiento del receptor hacia el núcleo. El esteroide se fija al LBD (lo que logra un cambio conformacional que hace que se disocie de la Hsp 90), formando un complejo que se fija al DNA nuclear a través de su DBD y estimula la trascripción genética; en este proceso, el DBD reconoce una secuencia específica del DNA de gran afinidad, conocida como “Elementos de respuesta hormonal” (HRE), elementos aumentadores que al igual que los genes promotores están localizados antes del sitio de trascripción (por esta razón también se usa el nombre de receptores nucleares).
El HRE está dividido:
En dos sitios hexaméricos de consenso (6 pares de bases del DNA), cada uno de los cuales se liga a un monómero del DBD que es un dímero (figura 2). La secuencia de los pares de bases en cada mitad del HRE, su número y la orientación relativa determinan la afinidad al DBD del complejo.
Los dos subdominios del DBD tienen un iòn zinc coordinado por cuatro residuos de cisteína (dedos de zinc), seguidos por una hélice alfa que lee (hace los contactos con las secuencias específicas en el HRE). (Figura, del Grupo Teórico y Computacional de Biofísica, Universidad de Illinois en Urbana-Champaign/ Instituto Beckman)
 Figura 3. Receptores intracelulares
Figura 3. Receptores intracelulares
De esta manera el receptor nuclear regula la homeostasis, reproducción, desarrollo y metabolismo y actúa como interruptor que controla el desarrollo y diferenciación de la piel, hueso, centros de la conducta en el cerebro y la regulación continua del tejido reproductivo.
Se produce entonces mRNA que actúa sobre los ribosomas, produciendo proteínas específicas. Generalmente cada gen codifica un receptor, pero en algunos casos (estrógenos y progestágenos) existen al menos dos receptores (A y B); una célula que responde a esteroides puede tener alrededor de 10.000 receptores de alta afinidad, que al igual que los receptores que ligan hormonas en las membranas tienen un terminal COOH en la parte externa mientras que la parte interna tiene un terminal N.
En el núcleo hay también receptores metabólicos que actúan como sensores también toxicológicos, y son de varias clases, con siglas como PPAR, LXR, SXR, etc. El grupo de Vincent Laudet en Lyon, Francia (www.ens-lyon.fr) ha identificado cuarenta y ocho receptores nucleares en el genoma, incluidos en siete grupos (ver tabla 3).
(Lea También: Fisiología de la Adenohipófisis)
Tabla 3. Nomenclatura de los receptores nucleares
| Grupos y Subfamilias | Genes | Siglas de los receptores |
| 1A | NR1A1 | TRa, c-erbA-1, THRA |
| NR1A2 | TRb, c-erbA-2, THRB | |
| 1B | NR1B1 | RARa |
| NR1B2 | RARb, HAP | |
| NR1B3 | RARg, RARD | |
| NR1B4 | RAR | |
| 1C | NR1C1 | PPARa |
| NR1C2 | PPARb, NUC1, PPARd, FAAR | |
| NR1C3 | PPARg | |
| 1D | NR1D1 | REVERBa, EAR1, EAR1A |
| NR1D2 | REVERBb, EAR1b, BD73, RVR, HZF2 | |
| NR1D3 | E75 | |
| 1E | NR1E1 | E78, DR-78 |
| 1F | NR1F1 | RORa, RZRa |
| NR1F2 | RORb, RZRb | |
| NR1F3 | RORg, TOR | |
| NR1F4 | HR3, DHR3, MHR3, GHR3 | |
| CNR3, CHR3 | ||
| 1G | NR1G1 | CNR14 |
| 1H | NR1H1 | ECR |
| NR1H2 | UR, OR-1, NER1, RIP15, LXRb | |
| NR1H3 | RLD1, LXR, LXRa | |
| NR1H4 | FXR, RIP14, HRR1 | |
| NR1H5 | FXRB | |
| 1I | NR1I1 | VDR |
| NR1I2 | ONR1, PXR, SXR, BXR | |
| NR1I3 | MB67, CAR1, CARa | |
| NR1I4 | CAR2, CARb | |
| 1J | NR1J1 | DHR96 |
| 1K | NR1K1 | NHR1 |
| 2A | NR2A1 | HNF4 |
| NR2A2 | HNF4G | |
| NR2A3 | HNF4B | |
| NR2A4 | DHNF4, HNF4D | |
| 2B | NR2B1 | RXRA |
| NR2B2 | RXRB, H-2RIIBP, RCoR-1 | |
| NR2B3 | RXRG | |
| NR2B4 | USP, Ultraspiracle, 2C1, CF1, RXR1, RXR2 | |
| 2C | NR2C1 | TR2, TR2-11 |
| NR2C2 | TR4, TAK1 | |
| NR2C3 | TR2-4 | |
| 2D | NR2D1 | DHR78 |
| 2E | NR2E1 | TLL, TLX, XTLL |
| NR2E2 | TLL, Tailless | |
| NR2E3 | PNR | |
| NR2E4 | dissatisfaction | |
| NR2E5 | fax-1 | |
| 2F | NR2F1 | COUP-TFI, COUPTFA, EAR3, SVP44 |
| NR2F2 | COUP-TFII, COUPTFB, ARP1, SVP40 | |
| NR2F3 | SVP, COUP-TF | |
| NR2F4 | COUP-TFIII, COUPTFG | |
| NR2F5 | SVP46 | |
| NR2F6 | EAR2 | |
| NR2F7 | AmNR7 | |
| 2G | NR2G1 | HNF, RXR |
| 2H | NR2H1 | AmNR4, AmNR8 |
| 3A | NR3A1 | ERa |
| NR3A2 | ERb | |
| 3B | NR3B1 | ERR1, ERRa |
| NR3B2 | ERR2, ERRb | |
| NR3B3 | ERR3, ERRg | |
| NR3B4 | Drosophila ERR | |
| 3C | NR3C1 | GR |
| NR3C2 | MR | |
| NR3C3 | PR | |
| NR3C4 | AR | |
| 4A | NR4A1 | NGFIB, TR3, N10, NUR77, NAK1 |
| NR4A2 | NURR1, NOT, RNR1, HZF-3, TINOR | |
| NR4A3 | NOR1, MINOR | |
| NR4A4 | DHR38, NGFIB | |
| CNR8, C48D5 | ||
| 5A | NR5A1 | SF1, ELP, FTZ-F1, AD4BP |
| NR5A2 | LRH1, xFF1rA, xFF1rB, FFLR, PHR, FTF | |
| NR5A3 | FTZ-F1 | |
| NR5A4 | FF1b | |
| 5B | NR5B1 | DHR39, FTZF1B |
| 6A | NR6A1 | GCNF1, RTR |
| NR6A2 | HR4, THR4, GRF | |
| 0A | NR0A1 | KNI, Knirps |
| NR0A2 | KNRL, Knirps related | |
| NR0A3 | EGON, Embryonic gonad, EAGLE | |
| NR0A4 | ODR7 | |
| NR0A5 | Trithorax | |
| 0B | NR0B1 | DAX1, AHCH |
| NR0B2 | SHP |
* a, b y g corresponden a las letras griegas alfa, beta y gama, respectivamente. Algunas siglas. TR: receptor tiroideo. GR: receptor gluco-corticoide. MR: receptor mineralo-corticoide. PR: receptor de progesterona. AR: receptor de andrógenos. PPAR: receptor activado del proliferador de peroxisomas.
Receptores nucleares huérfanos
Entre estos se encuentran los receptores nucleares huérfanos (aquellos identificados por homología, pero a los que aún no se les ha encontrado el ligando, pero que puede ser un medicamento que especialmente se diseñe para ello, por lo que tienen mucho futuro en la farmacología, para el desarrollo de drogas revolucionarias.
Hay dos grupos de receptores huérfanos, unos relacionados con los receptores estrogénicos y otros –los Rev-erbs- que exiben varias peculiaridades en su secuencia y que probablemente son verdaderos receptores huérfanos. Sobre estos receptores actúan unos co-activadores y otros co-represores, encargados de ayudar en la activación o en la represión de los receptores nucleares, que de esta manera actúan como interruptores de prendido y apagado (on/off). (Ver figura 4, del Grupo de Receptores Nucleares y Co-Represores del Instituto Karolinska, www.biosci.ki.se).
La maquinaria de transcripción celular actúa sobre el ADN empaquetado en la cromatina nuclear, regulando los genes. Por ejemplo, los complejos de acetil-transferasa de histona (complejos HAT) modifican las colas de la histona y aflojan la estructura cromatínica -ejerciendo una función co-activadora- siendo reclutados por los activadores transcripcionales hacia la región promotora, produciendo una acetilación de la histona y disminuyendo la represión mediada por la cromatina.
 Figura 4. Co-activadores y co-represores de la trascripción celular.
Figura 4. Co-activadores y co-represores de la trascripción celular.
Como se puede ver las respuestas fisiológicas son complejas, ya que hay múltiples tipos de receptores que se expresan de manera diferente en varios tejidos y células ante la acción de agonistas.
Los glucocorticoides y las hormonas tiroideas regulan la expresión en la membrana de algunos de estos tipos de receptores, los que también pueden regularse por la acción desensibilizadora de los agonistas, además de que la exposición persistente del agonista puede ocasionar una pérdida real de receptores (regulación hacia abajo o “down-regulation”).
Historia
 En 2002 se cumplió el primer siglo del descubrimiento de la secretina, hecho por Bayliss y Starling en 1902. Estos fisiólogos, conocidos en investigación cardiovascular y digestiva, observaron –mientras estudiaban la digestión y absorción en un asa aislada de duodeno- que si el contenido duodenal era ácido, entonces el páncreas empezaba a segregar grandes volúmenes de jugo rico en bicarbonato.
En 2002 se cumplió el primer siglo del descubrimiento de la secretina, hecho por Bayliss y Starling en 1902. Estos fisiólogos, conocidos en investigación cardiovascular y digestiva, observaron –mientras estudiaban la digestión y absorción en un asa aislada de duodeno- que si el contenido duodenal era ácido, entonces el páncreas empezaba a segregar grandes volúmenes de jugo rico en bicarbonato.
Ya que dicha asa tenía irrigación más no inervación, ellos concluyeron que el estímulo se debía a una sustancia presente en la sangre, la que llamaron “secretina” y acuñaron el término “hormona”. Sorprende pensar que la secretina, de limitada utilidad en diagnóstico de la función pancreática, ahora esté de moda como una alternativa de tratamiento para ciertos casos de autismo, una enfermedad muy frecuente e incapacitante.
La teoría hormonal que siguió al descubrimiento de la secretina puso en jaque a la teoría neural, en boga en aquellos momentos. I.P. Pavlov –el de los reflejos condicionados, por lo que ganó el Nóbel de fisiología en 1904- postulaba que el funcionamiento de los órganos era debido al control nervioso. Pero ahora aparecía el concepto de hormona, el de los químicos que actuaban como reguladores biológicos a distancia.
Aunque por lo general las hormonas se refieren a la secreción de lo que los antiguos llamaban “órganos sin conducto (excretor)” –en contraposición a las glándulas exocrinas- curiosamente la secretina es producida por células que pertenecen al sistema neuroendocrino difuso.
Este concepto comenzó por la descripción en 1938 de unas células más bien pálidas, diseminadas en tejidos no endocrinos, hecha por Friedrich Feyrter. En 1969 A.G.Everson Pearse la histoquímica y ultra estructura de estas células productoras de pèptidos, las que denominó APUD.
Los primeros descubrimientos en la endocrinología fueron clínicos:
La descripción por Addison de la Insuficiencia Suprarrenal, la diabetes –conocida desde la antigüedad- la Enfermedad de Basedow o el hipotiroidismo de Gull, el cretinismo, o incluso el “experimento” de Carlos Eduardo Brown-Sequard en 1879, quien se “rejuveneció” –al igual que su esposa- con la inyección de extracto testicular, generando gran interés en este campo.
Sólo en el siglo XX se inició el estudio químico y fisiológico de las secreciones internas. La existencia del “medio interno” postulada en la centuria anterior por Claude Bernard obedeció sin embargo a la práctica de métodos experimentales.
En el campo de las hormonas, de los neurotransmisores y de los receptores se han premiado con el Nóbel a muchos investigadores, los que mencionaremos a lo largo de este libro. En este capítulo queremos especialmente mencionar a G.B. Elion, G.H. Hitchings y J. Black en cuanto a los receptores (1988); a R.A. Granit, H.K. Hartline, G. Wald (1969), D.H. Hubel, T.N. Wissel y R.W.
Sperry en el campo de la fisiología y la bioquímica de la visión. A E.W. Sutherland (1971), quien descubrió el adenosìn-monofosfato cíclico (AMPc) como segundo mensajero en la transducción del mensaje hormonal, y a Martín Rodbell y Alfred G. Gilman (1994) que identificaron y purificaron la proteína G y que encontraron que era el transductor que ligaba el receptor hormonal con la amplificación de su respuesta.
Esta lista es bastante completa, pero no exhaustivas.
Con frecuencia se descubren nuevos péptidos y se conocen mejor sus genes de origen, por lo que se esperan muchas nuevas sustancias al dilucidarse por completo el genoma humano en el año 2003. La lista de citoquinas es también cada vez más larga.
Hay nuevos péptidos hormonales como el péptido liberador de prolactina, la adiponectina, otros factores de crecimiento como el IGF-2, etc. que se mencionarán más adelante.
Referencias seleccionadas
- Amaro-Méndez S. Breve historia de la endocrinología. Editorial Científico-Técnica, Instituto Cubano del Libro. La Habana, 1975.
- Augsten AL, Bowen RA, Rouge M. Pathophysiology of the endocrine system. Colorado State University, Fort Collins, CO, 1999. www.arbl.cvmbs.colostate.edu/hbooks/pathphys/endocrine/indexl
- Banks D. Endocrinology and nutrition. 1996. United Medical and Dental Schools, Guy’s and St. Thomas. hospitals, London. www.umcls.ac.uk/physiology/banks/endonut#start
- Farling PA et al. Endocrine physiology. Current Updates in Anastehesia. 2002. No. 14.
- Francis GA, Fayard E et al. Nuclear receptors and the control of metabolism. Annu Rev Physiol 2002. 65: 261-311.
- García-Sainz JA. Hormonas, mensajeros químicos y comunicación celular. Fondo de Cultura Económica, México, 1997.
Halstead K. Localization of calcium channel types in cultured hippocampal Ca1 neurons over time. Marquette University, Milwaukee, WI. www.mendel.biol.mu.edu/
Bibliografías Seleccionadas
- Hamm HE. How activated receptors couple to G proteins. Proc Natl Acad Sci USA. 2001. 98:4819-4821.
- Kimball J. The hormones of the human. www.users.rcn.com/jkimball.ma.ultranet/BiologyPages/H/Hormonesl
- Klee CB. Regulation of the calmodulin-stimulated protein phosphatase, calcineurin. J Biol Chem 1998. 273: 13367-13370.
Koeslag J. Companion to endocrinology studies. Department of Medical Physiology, University of Tigersberg, South Africa. www.sun.ac.za/med_physbio/med_physiology/dept/ENDO - Labrie F, Simard J et al. Molecular biology of the intracrine steroidogenic enzymes in the human prostate. Laval University, Quebec, Canada. www.fernand.labrie.crchul.ulaval.ca
- Modlin IM, Kidd M, Farhadi J. Ernest Starling and the discovery of secretin. J Clin Gastroenterol 2001. 32: 187-192.
- Raff H. Secretos de la Fisologìa. Editorial McGraw-Hill Interamericana, México, 2000.
- Shostak S. Endocrine system. 2003. www.pitt.edu/
- Teintze M. CTFR review page (University of Montana). 2002. www.search.yahoo.com/
- Ward C. Lectures on endocrinology. Department of Physiology, Queens University, Canada. www.meds.queensu.ca/medicine/physiol/
Textos Recomendados de Endocrinología.
- Greenspan FS, Gardner DG. Basic and clinical endocrinology. 7th Edition. Appleton & Lange, 2003. 900 páginas.
- Griffin JE, Ojeda SR. Textbook of endocrine physiology. 4th Edition. Oxford University Press, 2000. 496 pàginas
- Kacsoh B. Endocrine Physiology. McGraw-Hill, NYC. 2000. 741 pàginas.
- McDermott MT. Secretos de la endocrinología, 2ª. Edición. Editorial McGraw Hill interamericana, México, 1999. 407 páginas.
- Orrego A. Endocrinología. 5ª. Edición. 1998. Corporación para Investigaciones Biológicas, Medellín. 396 pp.
- William’s Textbook of endocrinology. 10th Edition. (Larsen PR, Kronenberg HM, Melmed S, Polonski KS, Editors). WB Saunders, Philadelphia. 2003. 1820 pàgs.
- De Groot L. Your endocrine source (endocrine web textbook). www.endotext.org

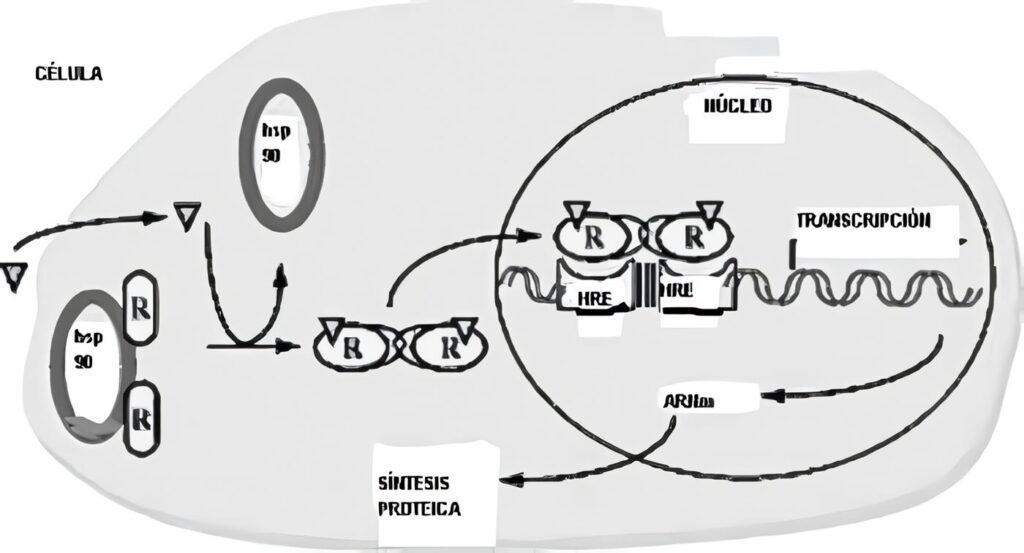
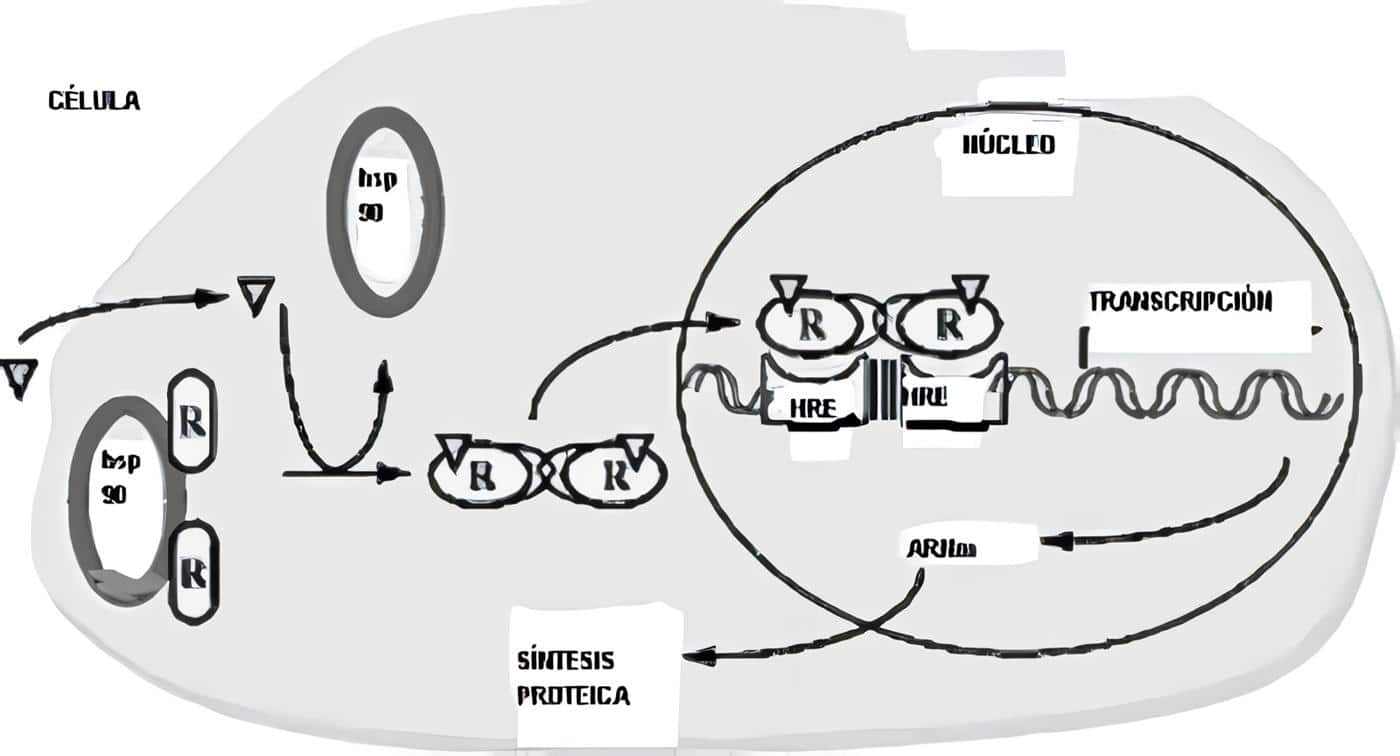 Figura 3. Receptores intracelulares
Figura 3. Receptores intracelulares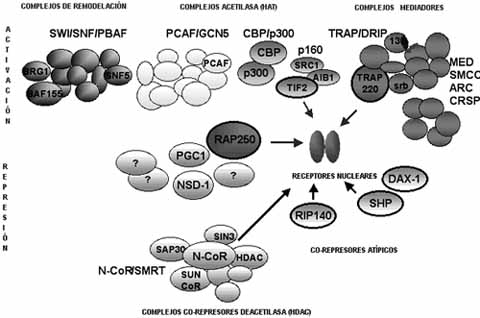 Figura 4. Co-activadores y co-represores de la trascripción celular.
Figura 4. Co-activadores y co-represores de la trascripción celular.