Myriam Gutiérrez de Salazar M.D.
Médica Magíster en Toxicología
Coordinadora Centro de Información y Asesoría Toxicológica CIATOX
Convenio Consejo Colombiano de Seguridad – Ministerio de la Protección Social – Universidad Nacional de Colombia
Docente Universidad Nacional de Colombia
Generalidades del Plomo:
El plomo es un metal maleable de color grisáceo el cual se puede encontrar en forma orgánica e inorgánica. Los principales compuestos inorgánicos se presentan como arseniato, carbonato, cromato, cloruro, dióxido, fosfato, monóxido, sesquióxido, tetraóxido, silicato, sulfato y sulfuro de plomo. Los compuestos orgánicos más comunes son acetato, estearato, oleato, tetraetilo y tetrametilo de plomo.
El plomo inorgánico se presenta en todos los procesos que supongan su fundición, extracción, manufactura de piezas, fabricación de aleaciones y recuperación de metales. El reciclaje de baterías es una actividad laboral de alto riesgo para los trabajadores informales y sus familias que habitan en el mismo sitio de trabajo.
Absorción y Toxicidad del Plomo
El plomo se absorbe por inhalación, ingestión y por vía dérmica; el grado depende de factores tales como la edad, el estado nutricional, enfermedades previas y la forma de presentación del plomo. El 35% del total del plomo inhalado se deposita en las vías aéreas y pasa directamente a la circulación, el restante asciende hasta llegar a esófago y es deglutido y absorbido en tracto gastrointestinal, vía principal de absorción e intoxicación en niños. La absorción dérmica es muy baja.
El plomo absorbido es transportado por la sangre y distribuido en un 90% a hueso y el restante a tejidos blandos, hígado y riñón. Atraviesa fácilmente la barrera placentaria y trae también efectos deletéreos en el feto. La vida media del plomo en el organismo es variable, según el lugar en donde se encuentra; de 3 a 4 semanas si el metal se encuentra en sangre; de 4 semanas si se depositó en tejidos blandos y de 20 a 27 años si está en tejido óseo.
Talio en Urgencias Toxicológicas
Mecanismo de Acción:
• Compite con metales esenciales, especialmente calcio y zinc.
• Tiene afinidad por los grupos sulfidrilos de las proteínas, alterando su función.
• Altera el transporte de iones esenciales.
Son estos mecanismos de acción los que explican las manifestaciones clínicas del saturnismo. La vía de ingreso, la cantidad absorbida, el tiempo de exposición y la susceptibilidad del individuo expuesto determinarán las características de aparición de la enfermedad, la evolución, las complicaciones y, finalmente, las secuelas.
Manifestaciones clínicas:
• Presencia de anemia como consecuencia de la alteración de la síntesis del grupo hem y de la eritropoyesis, por medio de la inhibición de la enzima deshidratasa del AAL-D y de la hemosintetasa; además, de interferencia de la enzima sintetasa de la enzima AAL-S dando como resultado anemias hipocrómicas, normocíticas o microcíticas, punteado basófilo en los eritrocitos y reticulocitosis por hemólisis al disminuir su vida media.
• Adinamia, astenia, palidez mucocutánea y sensación de debilidad
• Encefalopatía saturnina con cambios conductuales sutiles o transtornos neurológicos severos que lo lleven a la muerte. Los signos y síntomas pueden incluir irritabilidad, vértigo, cefalea, visión borrosa, temblor, alucinaciones, pérdida de memoria y concentración. En casos más severos pueden presentarse estados confusionales, sicosis, parálisis y muerte por hipertensión endocraneana. En los niños menores de 5 años severamente comprometidos se presentaregresión en el desarrollo sicomotor, atrofia cortical, hidrocefalia, convulsiones y retardo metal. Los niños expuestos pero que no manifiestan síntomas, pueden presentar retraso en el aprendizaje y alteraciones neuropsicológicas.
• Cólicos abdominales severos que semejan un abdomen agudo quirúrgico, además de sintomatología no específica como son la anorexia, cambios en el hábito intestinal, náuseas, vómito, sabor metálico e ictericia.
• El ribete de Burton puede aparecer en las encías como resultado de la oxidación del plomo con las proteínas de la placa bacteriana, aunque no es un hallazgo patognomónico ni sensible de la enfermedad.
• Lesiones tubulares, presentándose aminoaciduria, glucosuria e hiperfosfaturia, a largo plazo se desencadena una fibrosis tubular e intersticial difusa hasta terminar en una insuficiencia renal crónica, a pesar de haber suspendido la exposición años antes.
• Inductor de abortos, irregularidades menstruales, partos pretérmino, mortinatos y en el hombre de alteraciones en el espermograma.
• Inhibe procesos en la reparación del ADN permitiendo manifestaciones mutagénicas producidas por otros agentes genotóxicos. Los fetos presentan bajo peso al nacer, prematurez, talla baja y alteraciones en el desarrollo neuroconductual.
Laboratorio de Toxicología:
La prueba de oro para el diagnóstico exacto de la intoxicación o sobre-exposición es la determinación de plomo a nivel sanguíneo o plumbemia.
• Población no expuesta niveles máximos de 25 – 30 ug/dl.
• Niños sólo se permiten niveles hasta 10ug/dl según la CDC (Centro de control de enfermedades de los EEUU) desde 1991 y para adultos hasta 25 ug/dl.
• Población ocupacionalmente expuesta se debe vigilar desde el punto de vista clínico cualquier manifestación de las descritas en el cuadro clínico y realizar plumbemia si el caso lo amerita para decidir el tratamiento a seguir.
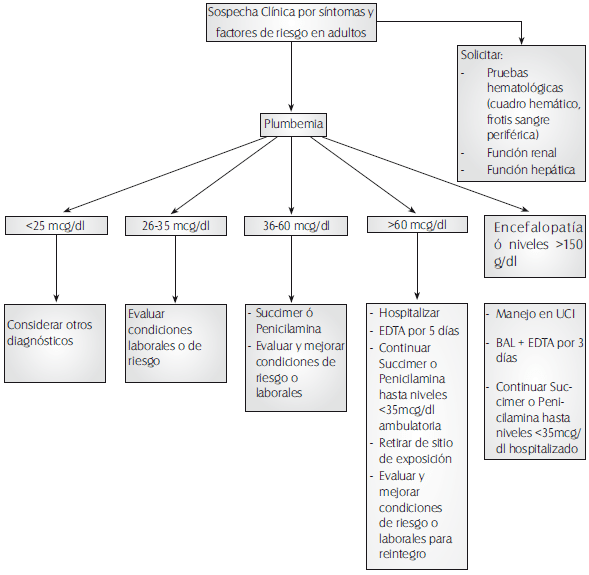
ALGORITMO DIAGNÓSTICO
Tratamiento:
1. Depende de la severidad del cuadro clínico y de los valores de plumbemia de cada caso.
• Encefalopatía presente o plumbemia mayor de 150 ug/dl se administra BAL (British antilewisita) 3-5 mgs/Kg/día IM dividido en dosis cada 4 horas y a las 4 horas después de empezar adicionar EDTA 60-75 mg/Kg/día en infusión IV continua, diluido en Dextrosa al 5% o solución salina. Tratamiento por 5 días. Esperar 48 horas y repetir el esquema si los niveles superan los 50 ug/dl.
• Otros síntomas o asintomático con niveles mayores de 60 ug/dl se administra EDTA 30- 50 mgs/kg/día en infusión IV durante 5 días. Esperar 48 horas y repetir el esquema si la plumbemia continúa por encima de 50 ug/dl.
2. En caso de no ser posible la quelación parenteral y que el paciente se encuentre en condiciones de ser manejado ambulatoriamente se utiliza Penicilamina a dosis de 750 – 1000 mgs/ día administrada en cápsulas de 250 mgs, vía oral cada 6 u 8 horas durante 10 días. Se realiza control de plumbemia y se debe repetir el ciclo por 10 días hasta obtener plumbemias menores a 35 ugs/dl. Se debe llevar un estricto control de la función renal del paciente por la nefrotoxicidad de este quelante.
3. Además de lo anterior se deben estudiar los factores que llevaron a esta intoxicación, hacer los correctivos a que dé lugar, reubicar a los trabajadores o retirarlos de la exposición mientras se da el tratamiento correspondiente e iniciar el programa de vigilancia epidemiológica periódica en beneficio de toda la empresa.
El pronóstico está relacionado con la intensidad y duración de la exposición, siendo de mejor pronóstico una intervención terapéutica temprana en ausencia de compromiso neurológico severo y el manejo de un paciente adulto.
GUÍA DE MANEJO DE URGENCIAS TOXICOLÓGICAS
Lecturas recomendadas:
1. Olson, K. R. Poisoning and Drug Overdose: McGraw-Hill- Lange Clínical Manual. 5ª. Edición. 2007, USA.
2. Casarett and Doull’s. Toxicology: The Basic Science of Poison: Toxic effects of Metals. Editorial McGraw- Hill. 7th Edition. USA., 2004.
3. Goldfrank‘s F. Toxicologic Emergences: Lead. Editorial McGraw- Hill. 8th Edition. USA., 2006.
.4. Uribe, M. G. Neurotoxicología: Neurotoxicidad por metales. Bogotá: Exlibris Editores S.A., 2001
5. Córdoba, D. Toxicología: Plomo, Medellín: 5a. Edición, 2006.
6. Repetto, M. Toxicología Avanzada: Revisión General de la Toxicología de los metales. Madrid: Editorial Díaz de Santos, 1995.








excelente
EXCELENTE Y RESUMIDA EXPLICACION SOBRE LA PLUMBEMIA.