Evaluación de lípidos y ultrasonido de calcáneo con terapia hormonal de reemplazo (THR) en baja dosis durante seis meses en mujeres perimenopáusicas *
Trabajos de Investigación
William Onatra H**, Héctor Posso***, Sandra Benavides****
* Este estudio fue financiado por el Departamento de Investigaciones de la Universidad de Ciencias Aplicadas y Ambientales y aprobado por el Comité de Bioética de la misma universidad.
** Profesor Asociado de la Universidad Nacional de Colombia. Docente de Ginecología y Obstetricia en la Universidad de Ciencias Aplicadas y Ambientales. williamonatra @elsitio.net.co
*** Médico Cirujano de la Universidad Nacional. M. Sc., Epidemiólogo. Director de Investigación del Instituto Nacional de Cancerología, Bogotá.
**** Epidemióloga. MD, Universidad El Bosque. Docente de la Universidad de Ciencias Aplicadas y Ambientales. Recibido: Septiembre 10 de 2005. Corregido: Octubre 16 de 2005. Aceptado: Noviembre 30 de 2005.
Resumen
Objetivo: Conocer el comportamiento de los parámetros lipídicos y hacer evaluación ósea por ultrasonido de calcáneo después de seis meses de THR en baja dosis.
Material y métodos: Se tomaron como población objeto, 25 mujeres posmenopáusicas (un año de amenorrea), con edades entre 45 y 65 años, que consultaron por síntomas climatéricos en la consulta externa de los Hospitales de Fontibón y San Rafael de Facatativá durante el año 2002, independiente del estado socioeconómico o de la patología concomitante. Se valoraron al ingreso y 6 meses después.
Se aplicaron la Historia Clínica Nacional para el Climaterio, evaluada por la Asociación Colombiana de Menopausia y el Minimental (Test para evaluar la memoria), auspiciado por la Asociación Colombiana de Gerontología. Se inicia tratamiento con estrógenos en baja dosis por vía transdérmica 25 µg, 24%; transdérmico + progesterona, 44%; vía oral estrógenos 0.3 mg y acetato de medroxiprogesterona 2.5 mg, 32%; transdérmico 25µg + AMP, 2,5 mg.
Variables: Factores de riesgo, Índice de masa corporal (IMC), Tensión Arterial, hemoglobina, hematocrito, glicemia, colesterol total, HDL, triglicéridos, mamografía, ultrasonido de calcáneo.
Resultados: El promedio de edad de este grupo fue de 54.32 + 4.96 años. El promedio de IMC 27.48 +3.86. Al final del estudio no se observó modificación del IMC, aunque algunos presentaron disminución, sin ser significativa: hematocrito
(Hcto) promedio 44%, hemoglobina (Hb) 13%, glicemia 110 mg/dl +89.8, colesterol total 227.20+45.2, mg/dL, triglicéridos 174.8+90 mg/dL. Al final de los seis meses no hubo modificaciones en la Hb ni en el Hcto. Se aprecia una disminución del Colesterol y aumento de las HDL (p<0.05). Los triglicéridos con tendencia a la disminución, sin ser significativa.
El ultrasonido mostró: Normalidad 44%, Osteoporosis 12%, Osteopenia 24%. A los seis meses no hay modificaciones en la DMO y, por el contrario, en algunos casos hubo tendencia a la disminución. La pérdida de memoria por el test de Minimental fue de mala memoria, 16% y en forma moderada, 76%. En su evaluación se observa una mejoría en la pérdida de memoria significativamente (p<0.001).
Conclusión: La inclusión de 25 mujeres posmenopáusicas para un ensayo clínico con terapia hormonal de baja dosis muestra la hipertensión como marcador de factor de riesgo, lo cual se confirma con un aumento del perfil lipídico. Existe en esta muestra sobrepeso en su promedio, hay una disminución en el colesterol total y un aumento de las HDL significativamente, con tendencia a la disminución de los triglicéridos. No hay diferencias significativas en la evaluación de osteopenia y osteoporosis por ultrasonido de calcáneo. Llama la atención la recuperación de la pérdida de memoria.
Palabras clave: Bajas dosis, THR, menopausia, ultrasonido de calcáneo, osteoporosis.
Introducción
La terapia hormonal de reemplazo puede modificar el riesgo de enfermedad cardiovascular por diferentes mecanismos, los cuales incluyen: modificaciones en la concentración de lipoproteínas, factores hemostáticos, cambios en la glucosa, insulina y presión sanguínea. El mecanismo por el cual los estrógenos y las progestinas interfieren cada día es más complejo, postulándose el papel sobre las lipoproteínas y triglicéridos1, factores hemostáticos2, del óxido nítrico3, y de la proteína C reactiva4.
A nivel cardiovascular hay evidencia de que reduce la incidencia de enfermedad coronaria entre un 35 y un 50% en mujeres posmenopáusicas normales5 y aún con enfermedad ya establecida6. Sin embargo, el estudio HERS (Heart and estrogen/progestin replacement study) demuestra que los eventos cardiovasculares aumentaban significativamente en el primer año en la mujeres con THR frente al placebo, pero que después de cuatro a cinco años la cifras se igualaban7.
La discusión continúa y se plantea que la THR de baja dosis podría solucionar en parte los efectos secundarios a largo plazo29.
La osteoporosis es una entidad multifactorial caracterizada por la disminución de la masa ósea, debida a un desbalance entre la formación y resorción ósea. Es aceptado por diferentes estudios que esta pérdida es progresiva al aumentar la edad y se acelera en la mujer después de la menopausia ante la disminución de las hormonas esteroideas. Estudios longitudinales han demostrado que la pérdida de hueso durante la premenopausia se lleva a cabo a nivel lumbar, fémur y antebrazo en un promedio de 0.9 a 1% anual8-10. Uno de los mayores beneficios de la THR es la prevención de la osteoporosis y la disminución de la incidencia de fractura en mujeres posmenopáusicas11. Los estrógenos conjugados, considerados como agentes antirresortivos, protegen contra la pérdida ósea12-31a y el acetato de medroxiprogesterona (AMP) ejerce un efecto sinérgico en el hueso13. Hay evidencias de que los estrógenos por vía transdérmica también han mostrado ser útiles en la disminución de la osteoporosis14.
Basado en las anteriores consideraciones se plantea que la terapia hormonal de reemplazo de baja dosis pudiera solucionar los efectos secundarios de la dosis estándar que actualmente se utiliza. Se entiende por baja dosis la mínima cantidad de hormona suficiente para promover beneficios sin exhibir riesgos. Es así como se inician una serie de estudios con concentraciones de 0.3 mg, 0.4 mg de estrógenos conjugados, 25 mg del 17-beta estradiol por vía transdérmica, acetato de noretisterona (NETA) en dosis 0.25 y 0.50 mg. Baerug y col.15 estudiando en forma retrospectiva 119 mujeres con dosis de diferentes concentraciones de NETA más 1 mg de 17 beta estradiol, logran una reducción significativa de las oleadas de calor24-27 , demostrando que el progestágeno no minimiza los efectos benéficos de la baja dosis de estradiol. Uthian y col.16 en un estudio aleatorizado, doble ciego y controlado contra placebo (Estudio HOPE), encontraron que los síntomas a mayor dosis disminuían en su severidad.
A nivel del perfil lipídico se demuestra que después de doce meses de tratamiento se observa una disminución en los niveles de colesterol total, aumento de las HDL16-18. En los parámetros hemostáticos existe una mejoría significativa en relación con el placebo cuando se utiliza 17-beta estradiol 1 mg asociado con NETA. Esta misma observación se encuentra con la vía transdérmica y vía oral de estrógenos o progestágenos 19-20-26.
Fue interés de los autores conocer en nuestro medio cómo la baja dosis podría o no modificar el perfil lipídico y los efectos que podría tener sobre el ultrasonido de calcáneo. Como complemento, se evaluó el efecto sobre la memoria.
Material y Métodos
El estudio se realizó en las consultas externas de ginecología de los hospitales de Fontibón y San Rafael de Facatativá. Se seleccionaron al azar mujeres entre 45 y 65 años, que consultaran por síntomas compatibles de síndrome climatérico, amenorrea de un año de evolución, que no hubieran recibido terapia hormonal previa.
Como criterios de exclusión se incluyeron los antecedentes de cáncer mamario, trombosis reciente, hipertensión maligna o antecedentes de lesiones hepáticas o renales previas. La muestra se recolectó durante enero a diciembre del año 2001, para un total de 25 casos.
Tipo de estudio: Se trata de un ensayo clínico en el cual se seleccionaron 25 mujeres posmenopáusicas, al azar, independiente del estado socioeconómico y de acuerdo a los criterios de inclusión.
Instrumentos: Como instrumento de registro se utilizó la Historia Clínica Nacional para el Climaterio, avalada por la Asociación Colombiana de Menopausia y en la evaluación de la memoria se utilizó el Test Minimental, recomendado por la Asociación Colombiana de Gerontología.
Variables: Se tomaron en cuenta como factores de riesgo, los antecedentes como hipertensión, diabetes y cáncer.
T. Arterial: Considerándose los parámetros de normalidad de 120/80 mm de Hg. Para la tabulación inicial se consideró la tensión arterial media = (T.A. Diastólica x 2 + T.A.S )/3.
Índice de masa corporal (IMC): peso /talla 2, considerándose bajo peso <19, 20 -24 normal, 25 a 29 sobrepeso y > 30 obesidad.
Minimental: Se considera en la evaluación un total de 30 puntos: si el puntaje está por debajo de 15, se considera una memoria deficiente; buena, entre 15 y 25, y mayor de 25, excelente.
Exámenes Paraclínicos: Se solicitaron hemoglobina, hematocrito, glicemia, colesterol total, HDL, triglicéridos. Para su determinación se utilizó un equipo automatizado.
Imágenes diagnósticas: Mamografía: se utilizó el equipo Siemens del Hospital de la Victoria.
Ultrasonido de Calcáneo: con equipo Lunar, Stiffness del 2% para joven, Velocidad de sonido (SOS), m/seg: 5 m/seg, Banda ancha de atenuación del sonido (BUA) dBMHZ +3 dB/MHz.
Parámetros de normalidad: Stiffness %: > 70 =normal, 60-70 osteopenia, < 60 osteoporosis.
Terapéutica: Para el manejo terapéutico se seleccionaron las pacientes en tres grupos. Grupo I: mujeres histerectomizadas, con dislipidemia o várices, baja dosis de 17 beta estradiol en la forma transdérmica de 25 mg. Grupo II: pacientes con útero y dislipidemia, se propuso la vía transdérmica y acetato de medroxiprogesterona (AMP) 2.5 mg vía oral. Grupo III:
Pacientes con útero sin dislipidemia; se utilizaron los estrógenos conjugados 0.3 mg (0.625 mg tomando una tableta día de por medio) y AMP 2.5 mg vía oral.
Evolución y controles: se realizaron controles mensuales pero para la tabulación se tuvieron en cuenta los controles iniciales y a los seis meses.
Análisis Estadístico: La recolección de los datos se codificó en tres formularios, uno para los datos clínicos, otro para los exámenes paraclínicos y otro para el test de Minimental. Las diferentes variables se digitaron y se pasaron a Epi-Info 6, las cuales se exportaron a SPSS para su análisis. Las variables cuantitativas se analizaron mediante la prueba T pareada y las variables categóricas mediante la prueba de Chi Cuadrado. La prueba de rango de Wilcoxon y prueba de muestras relacionadas, con intervalo de confianza, se consideró prueba significativa una p < 0.05.
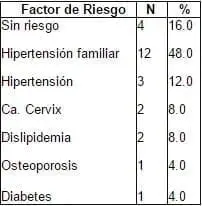
Tabla 1. Factores de Riesgo.
Resultados
El promedio de edad de este grupo fue de 54.32 + 4.96 años. En los Factores de Riesgo aparece la hipertensión como un marcador, no sólo a nivel familiar 48%, sino personal con un 16%. Los antecedentes de Dislipidemia (8%), y Osteoporosis y Diabetes con un 4%.
El número de gestaciones mostró un promedio de 3.5 con una desviación estándar (DS) de 2.71; el mayor porcentaje se dio entre las G3 (24%) y G2 (16 %). El promedio de partos fue de 3.0 con una DS 2.5, con un 52% entre los partos 1, 2 y 3 y una tasa del 28% de abortos.
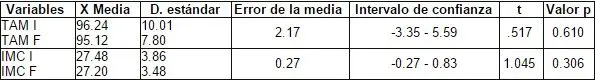
La tensión arterial media (TAM), el índice de masa corporal (IMC), tanto al inicio como al final no sufren modificaciones y sus cifras, por lo tanto, en la evaluación estadística, no son significativas. Tabla 2.
Tabla 2. Tensión Arterial Media (TAM) e Índice de Masa Corporal (IMC).
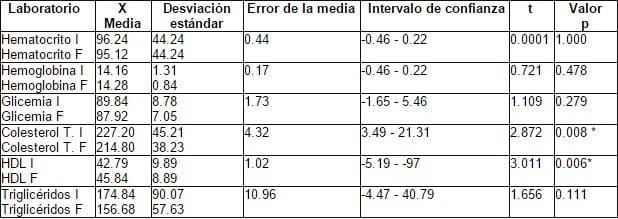
El hematocrito (Hcto) y la hemoglobina (Hb), no sufren modificaciones al final del tratamiento. Si bien la Glicemia tiende a disminuir a los seis meses, esta diferencia no es significativa. El colesterol total disminuye con un aumento de la HDL (p < 0.05) al cabo de los seis meses en forma significativa. Los triglicéridos, si bien muestran una disminución, estadísticamente no es significativa. Tabla 3, Gráfica 1.
El ultrasonido de Calcáneo: Score T mostró normalidad 44%, osteoporosis 12%, osteopenia 24%. A los seis meses el Stiffness muestra una tendencia a la disminución sin ser significativa. Tabla 4.
La pérdida de memoria por el test de Minimental fue de mala memoria al inicio del 16% y en forma moderada 76%, una media 25.4 al inicio y al final un aumento del 26.76 (p< 0.01). En la evaluación del Minimental se observa una mejoría en la pérdida de memoria a los seis meses, la cual es significativa. Tabla 5.
Tabla 3. Laboratorio; Hematocrito, Hemoglobina, Glicemia y perfil lipídico.
* p< 0.005
Gráfica 1. Efecto de la terapia en baja dosis sobre el perfil lipídico.
Para el manejo terapéutico se seleccionaron las pacientes en tres Grupos. I: 6 mujeres (24%) histerectomizadas, con dislipidemia o várices; se utilizó baja dosis de 17 beta estradiol en la forma transdérmica de 25 µg. Grupo II: pacientes con útero y dislipidemia, 11(44%); se propuso la vía transdérmica y acetato de medroxiprogesterona (AMP) 2.5 mg vía oral. Grupo III: pacientes con útero sin dislipidemia, 8(32%); los estrógenos conjugados 0.3 mg y MPA 2.5 mg vía oral (Tabla 6).
Por el número escaso en cada grupo, se acepta que la dosis es equivalente y que los resultados son comparables para la baja dosis.
Discusión
Durante muchos años la terapia hormonal de reemplazo (THR) ha sido prescrita en una dosis “ estándar” para estrógenos conjugados de 0.625 mg, 17 beta estradiol 50 mg por vía transdérmica, o etinil estradiol 5-10 mg en mujeres sin útero y se agrega 5-10 mg. del acetato de medroxiprogesterona, progesterona micronizada 100-200 mg, noretindrona (noretisterona), 0.35 mg con el fin de evitar la hiperplasia endometrial. Estas dosis se basaron en estudios previos que mostraban una mejoría del síndrome climatérico, con efectos benéficos a nivel cardiovascular2, óseo21 y sistema nervioso central4. Estudios recientes a largo plazo, por más de cinco a diez años, en mujeres con promedio de edad 65 años, evidenciaron un aumento en el riesgo relativo (RR) para cáncer mamario (WHI)22 y RR de 2.1 para trombosis (HERS)11.
Tabla 5. Minimental.
Tabla 6. Grupo terapéutico
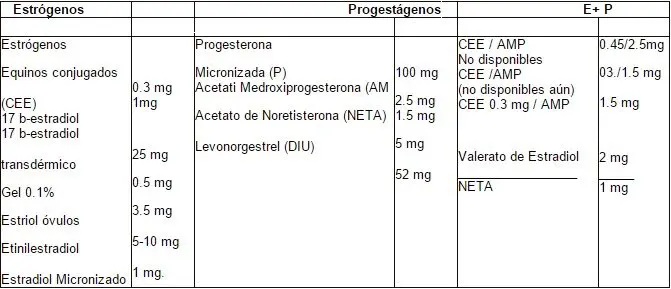
Basados en los últimos estudios se ha planteado que las dosis bajas podrían ser benéficas para mujeres con más de cinco a diez años de THR, mayores de 65 años25; es un esquema más fisiológico, tiene menos efectos secundarios, garantiza los beneficios a corto y largo plazo, con mejor adherencia al tratamiento y una menor preocupación respecto al cáncer mamario y de endometrio20, 23. ¿Qué se considera baja dosis? Existe un consenso de los diferentes investigadores que sería la mínima dosis capaz de mejorar los síntomas climatéricos, protección cardiovascular, prevención de osteoporosis y mejoría de la función cognitiva. En ese orden de ideas se acepta como baja dosis para estrógenos y progesterona los mostrados en la tabla 7.
Uno de los temas controversiales es si con la terapia hormonal puede o no aumentar el peso. Diferentes estudios muestran que no hay aumento de peso sino una redistribución de la grasa, efecto benéfico de los estrógenos. El presente estudio tampoco demuestra un cambio en el índice de masa corporal, lo cual está de acuerdo con otros estudios de reciente aparición en la literatura47.
La THR en baja dosis ha mostrado sus beneficios a nivel cardiovascular y diferentes estudios epidemiológicos de casos y controles por más de 20 años 2,3,7, evidencian el efecto benéfico de los estrógenos a nivel cardiovascular. El estudio de Salud de las Enfermeras mostró una reducción de la enfermedad coronaria en dosis de 0.3 y 0.625 por día, con un efecto menos benéfico en dosis de 1.25 de CEE32. El estudio WHI (Women’s Health Initiative), estudio de la iniciativa de la Salud femenina, reclutando 27.000 mujeres entre 1993 y 1998, aleatorizadamente; 16.608 recibieron terapia con estrógenos conjugados 0.625 mg y acetato de medroxiprogesterona 2.5, vs. placebo proyectado a cinco años. El Riesgo Relativo para enfermedad cardiovascular aumentó 1.29 (IC 95%, 1.02-1.63) es decir que el riesgo se incrementó en un 29%. El Riesgo Absoluto fue del 0.37% vs. 0.30%, es decir 37 veces, 30 eventos anuales por 10.000 mujeres. El R.R. de ACV fue 1.41 y de trombosis venosa, de 2.11 y RR para Ca. de mama fue de 1.26, con una disminución en el R.R. del cáncer de colon de 0.63 y de R.R. de fractura por osteoporosis de 0.66. Estos resultados obligaron a suspender una parte del estudio y se esperan resultados de la terapia con solo estrógenos22 (Recordar que este brazo del WHI fue también suspendido por aumento de E. cerebrovascular).
Este grupo tiene un promedio de edad de 65 años, raza blanca y donde la existencia de lesión endotelial es muy alta y explicaría los resultados a nivel cardiovascular.
La vía transdérmica evidencia una disminución del colesterol total (<5%) después de dos años de terapia45, un aumento de los niveles de HDL (25%) con diferencias significativas
Tabla 7. Productos terapéuticos en baja dosis.
(p<0.05) a las 12 semanas y de (p<0.03) a los 24 semanas48. Una disminución de las LDL (-8%) con terapia sola. Al utilizar la terapia combinada con progestágenos no lo reduce y por el contrario aparece un leve aumento49. En dosis de 100 mg/día por tres semanas hay una protección contra LDL oxidada que se sabe son absorbidas por las células de la pared arterial dando lugar a la formación de las células espumosas y posteriormente a placas arterioscleróticas. Es posible que por esta vía la terapia transdérmica pueda proteger el daño arterial. Por otra parte hay evidencia de que los estrógenos conjugados por vía oral incrementan los niveles de triglicéridos séricos48, la vía transdérmica, por el contrario, los diminuye dependiendo de la dosis y tiempo de duración. En el presente estudio se evidencia, a pesar del corto tiempo de 24 semanas, una disminución significativa (p<0.5) del Colesterol Total y aumento de la HDL con tendencia a disminuir los triglicéridos, datos confirmados por otros autores45. Stevenson en un estudio aleatorizado doble ciego controlado contra placebo muestra cómo con la terapia transdérmica influye significativamente sobre el colesterol total, HDL, apoliproteína A y B, insulina, selectina, enzima convertidora de angiotensina, dimero D (p<0.5)46.
El estudio HOPE30 incluyó 749 mujeres con edad promedio de 51.6 años y 2.3 años de menopausia, reportó que las bajas dosis de CEE con o sin AMP aumentaban la HDL y disminuían la LDL y la combinación de 0.45/ 1.5 tenían los mismos efectos a nivel de los lípidos que dosis de 0.625/2.5. La dosis de CEE 0.625/AMP 1.25 aumentó la HDL en un 10% y disminución de la LDL en 10%.
Dosis de 0.45/1.5 no tuvieron efectos sobre las HDL. Sin embargo, en otro estudio realizado en Alemania con 0.3 mg de CEE no hubo aumento de las HDL después de seis meses de tratamiento33. La baja dosis también ha sido utilizada con buenos resultados en mujeres hiperlipidémicas34 y por vía transdérmica se observa aumento de las HDL35, contrario a los primeros estudios que reportaban un nulo efecto sobre los lípidos. El presente estudio con bajas dosis demuestra también una disminución significativa del colesterol total y aumento de las HDL, sin modificación en los triglicéridos, lo cual está de acuerdo con otros autores 46, 48, 50 .
El estudio clásico de Lindsay en 198421 demostró que las dosis de 0.625 de CEE mantenían la densidad mineral ósea (DMO) y que al suspender se perdía el efecto benéfico con disminución a los dos meses de la pérdida ósea. Al mejorar la técnica radiológica aparece la absorpsiometría dual de Rx (DXA), la cual detecta cambios del 5%. 5-20% a nivel de columna después de tres años de tratamiento y un incremento del 1.5% en la DMO del metacarpo36, 37. Trabajos posteriores con estradiol micronizado38 y otras hormonas calciotrópicas, mostraron prevención del riesgo de fractura 39-40; la vía transdérmica demostró un aumento de la DMO tanto en columna como en fémur.
Los estudios con bajas dosis han sido controversiales; Genant41 demostró que los estrógenos esterificados de 0.3 mg/día por 24 meses combinado con suplemento de calcio incrementaban la DMO comparado con el placebo. El estudio de Hormonas Continuas como Terapia de Reemplazo CHART42, se realizó en mujeres con uno a cuatro años después de la menopausia, con promedio de edad de 53 años, quienes recibieron dosis de etinil estradiol (1.0, 2.5, 5 y 10 mg/día) sin oposición y oposición continua combinada de acetato de noretindrona (0.2,0.5, y 1 mg/día) más suplemento de calcio por dos años, no incrementaba la DMO. Se observó aumento de la DMO en quienes recibieron etinil estradiol a dosis de 5 o 10 mg; paradójicamente no hubo aumento de la DMO a las que se les agregó NETA a pesar de que también recibían etinil estradiol.
Hay evidencia de otros estudios aleatorizados, multicéntricos, contra placebo en seguimiento a tres años como el estudio PEPI3 que evalúa mujeres de uno a diez años posmenopausia, promedio de edad 56 años, tratadas con CEE 0.625 mg/día sin oposición y con oposición de AMP 2.5 mg día, continua o cíclica 10 mg por 12 días, o progesterona micronizada 200 mg por 12 días/mes. La DMO medida por DXA, a nivel de columna y fémur y cadera después de tres años, se aprecia un aumento del 5.1% en columna sin diferencias en columna o fémur con el resto de presentaciones de estrógenos solos o con progestágenos.
El estudio HOPE30, prospectivo, randomizado multicéntrico con 2.805 mujeres posmenopáusicas, promedio de edad de 52 años, compara los efectos a nivel de hueso con varias dosis de CEE (0.3, 0.45, y 0.625 mg/ día) solos o con oposición de AMP (1.5, 2.5 mg/día) durante dos años. La respuesta a nivel de columna en 1% se observa en el grupo que recibió 0.625 mg solo y a los que se les agregó 2.5 mg de AMP, confirmando los hallazgos del estudio PEPI. No hubo incremento en cadera o total de cuerpo cuando se añadió 1.5 o 2.5 de AMP. El presente estudio confirma las observaciones anteriores donde la baja dosis tiene una pobre respuesta sobre hueso a largo plazo.
Uno de los síntomas precoces de la disfunción ovárica durante el climaterio es la disminución de la concentración y el olvido pasajero de quehaceres domésticos.43 El Minimental es un test reconocido a nivel mundial como un método de evaluación de la memoria. El presente estudio a pesar del escaso número de casos, evidencia que la memoria empieza a disminuir durante el climaterio y hay una tendencia a mejorar con la terapia hormonal de reemplazo (p<0.001), lo cual se encuentra mencionado por Yesavage y colaboradores44.
Conclusión
La inclusión de 25 mujeres posmenopáusicas para un ensayo clínico con terapia hormonal de baja dosis, muestra la hipertensión como marcador de factor de riesgo que se confirma con un aumento del perfil lipídico. Existe en esta muestra sobrepeso en su promedio, osteopenia y osteoporosis 36% relativamente bajo con relación al promedio de otras investigaciones. Llama la atención la pérdida de memoria en el 16%. La terapia hormonal de reemplazo en baja dosis mejora el síndrome climatérico en todas sus manifestaciones a partir del tercer mes de tratamiento. Existe una aumento significativo p
Agradecimientos
A las directivas de la Universidad de Ciencias Aplicadas y Ambientales (UDCA), a los Gerentes, al personal de consulta externa de los Hospitales de Fontibón y Facatativá, a los Laboratorios Wyeth y Janssen Farmaceutical por el apoyo recibido para la realización de esta investigación.
Referencias
1. Berg J, Taylor D. Symtom experience of Filipino American midlife women. Menopause 1999; 6: 105-114.
2. Stampfer MJ, Colditz GA, Willet WC, et al. Postmenopausal estrogen therapy and cardiovascular disease. Ten-year follow-up from the nurses´health study. N Engl J Med 1991; 325: 756-762.
3. The Writing Group for de PEPI trial. Effects of hormone therapy on bone mineral density: Results from the postmenopausal estrogen/progestin Intervention Trial. JAMA 1996; 276:1389-1396.
4. Sherwing BB. Estrogen effects on cognition in menopausal women. Neurology 1997; 48: (Suppl) S121-S126.
5. Stampfer MJ, Colditz GA. Estrogen replacement therapy and coronary heart disease: a quantitative assessment of the epidemiologic evidence. Prev Med 1991; 20: 47-63.
6. Manolio TA, Furgerg CD, Shemanski L, et al. Association of postmenopausal estrogen use with cardiovascular disease and its risk factors in older women. Circulation 1993; 88: 2163-2171.
7. Hulley S, Grady D, Bush T, et al. For the Heart and Estrogen/progestin Replacement Study (HERS) Research Group. Randomized trial of estrogen plus progestin for secundary prevention of coronary heart disease in postmenopausal women. JAMA 1998; 280: 605-613.
8. Riggs BL, Melton LJ. III The prevention and treatment of osteoporosis. N Engl J Med 1992; 327: 620-627.
9. Seeman E. Reduced bone density in women with fractures: contribution of low peak bone density and rapid bone loss. Osteoporosis Int 1994; 4: 15S-25S.
10. Lindsay R. The menopause and osteoporosis. Obstet Gynecol 1996; 87: 16S-19S.
11. Kiel DP, Felson DT, Andersson JJ, et al. Hip fractura and the use of estrogen in postmenopausal women. The Framinngham study. N Engl J Med 1987; 317: 117-123.
12. Cooper C, Stakkestad JA. Radowicki S, et al. Matrix delivery transdermal 17 b-estradiol for the prevention of bone loss in postmenopausal women. The international Study Group. Osteoporosis Int.1999; 9: 358-366.
13. Gallager JC, Kable WT, Goldgar D. Effect of progestin therapy on cortical and trabercular bone comparison with estrogen. Am J Med 1991; 90: 171-178.
14. Ettinger B, Genant HK, Cann CE. Postmenopausal bone loss is prevented by treatment with low-dosage estrogen with calcium. Ann Intern Med 1987; 106: 40-45.
15. Berug U, Winge T, Nordland, et al. Decombinations of 1 mg estradiol and low dosis of NETA effectively control menopausal symptoms? Climateric 1998; 1: 219-228.
16. Utian WH, Shoupe D, Bachamann G, et al. Relief of vasomotor symptoms and vaginal trophy with lower dosis of conjugated equine estrogens and medroxyprogesterone acetate. Fertil Steril 2001; 75: 1065-1079.
17. Schelegel W, Petersdorf LI, Junker R, et al. The effects of six months of treatment with a low dosis of conjugated oestrogens in menopausal women. Clin Endocrinol (0xf) 1999; 51: 643-651.
18. Naessen T, Rodríguez-Macías K, Lithell H. Serum lipid profile improved by ultralow dosis of 17 beta-estradiol in elderly women. J Clin Endocrinol Metab 2001; 86: 2757-2762.
19. Lobo RA, Bush T, Carr BR, et al. Effects of lower dosis of conjugated equine estrogens and medroxyprogesterone acetate on plasma lipid and lipoproteins, coagulation factors, and carbohydrate metabolism. Fertil Steril 2001; 76: 13-24.
20. Ettinger B. Personal perspective on low dosage estrogen therapy for postmenopausal women. Menopause 1999; 6: 261-273.
21. Lindsay R, Hart DM, Clark DM. The minimum effective dose of estrogen for prevention of postmenopausal bone loss. Obstet Gynecol 1984; 63: 759-763.
22. WHI (Women’s Health Initiative). Writing Group for the Women’s Health Initiative Investigations. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: Principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288: 321-333.
23. De Melo NR, Leite-Grimbaum M, Fernández CE, et al. THR Baja dosis hormonales. Rev Col Meno 2002; 8: 204-209.
24. Wenger A. Cultural meaning of symtoms. Holist Nurs Pract 1993; 7: 22-35.
25. Lee K, Taylor D. Is there a generic midlife woman? the health and symptom experience of employed midlife women. Menopause 1996; 3: 154-164.
26. Longscope C, Crawford S, McKinlay S. Endogenous estrogens relationships between estrone, estradiol, non-protein bound estradiol and hot flashes and lipids. Menopause 1996; 3: 77-84.
27. Stadberg E, Mattsson I, Milsom I. The prevalence and severety of climateric symptoms and the use of different treatment regimens in a Swedish population. Acta Obstet Gynecol Scand 1997; 76: 442-448.
28. Onatra W, Sánchez J, Acuna R, et al. Epidemiología de la Menopausia en Colombia. Rev Col Obstet Ginecol 1994; 45 (Supp): 20-28.
29. Plunkett ER, Wolfe BM. Prolonged effects of a novel, low-dosage continuous progestin- cyclic estrogen replacement program in postmenopausal women. Am J Obstet Gynecol 1992; 166: 117-121.
30. Lindsay R, Gallagher JC, Kleerekoper M, et al. (HOPE). Effect of lower doses of conjugated equine estrogens with and without medroxyprogesterone acetate on bone in early postmenopausal women. JAMA 2002; 287: 2668-2676.
31. Speroff L, Whitcomb RW, Kempfer NJ, et al. Efficacy and local tolerance of low dowdose, day matrix estradiol transdermal system in treatment of menopausal vasomotor symptoms. Obstet Gynecol 1996; 88: 587-592. 31ª) Gambacciani M, Ciaponi M, Cappagli B, et al. Effects of low doses continuous combined conjugated estrogens and medroxyprogesterone acetate on menopausal symptoms, body weight, bone density and metabolism in postmenopausal women. Ann J Obstet Gynecol 2001; 185: 1180-1185.
32. Grodstein F, Manson JE, Colditz GA, et al. A prospective, observational study of postmenopausal hormone therapy and primary prevention of cardiovascular disease. Ann Intern Med 2000; 133: 933-941.
33. Schlegel V, Petersdorf LI, Junker R, et al. Effects of six months of treatment with a low dose of conjugated estrogens in menopausal women. Clin Endocrinol 1999; 51: 643-651.
34. Wolfe BM, Nisker JA, Hutton LC, Rutt BK. Novel low-dosage hormonal replacement the rapy complements dietary treatment of moderately hypercholesterolemic postmenopausal women. Clin Invest Med 1995; 18(5): 362-369.
35. Basdevant A, De Lignieres B, Guy-Grand B. Differential lipemic and hormonal responses to oral and parenteral 17 beta estradiol in postmenopausal women. Am J Obstet Gynecol 1983;147(1): 77-81.
36. Horsman A, Jones M, Francis R, Nordin C. The effect of estrogen dose on postmenopausal bone loss. N Engl J Med 1983; 309(23): 1405-1407.
37. Insua A, Negri A, Zanchetta JR. Effects of estrogen therapy on bone mass in postmenopausal women with osteopenia. Medicina (B Aires) 1995; 55: 408-414.
38. Prestwood KM, Kenny AM, Unson C, et al. Effect of low dose micronized 17-bestradiol on bone turnover, sex hormone levels, and side effects in older women a randomized, double blind, placebo controlled study. J Clin Endocrinol Metab 2000; 85:4462-4469.
39. Cummings SR, Browner WS, Bauer D, et al. Endogenous sex and calciotropic hormones and the risk of hip fracture and vertebral fractures in older women: the Study of Osteoporotic Fractures. N Engl J Med 1998; 339: 733-738.
40. Balfour JA, McTavish D. Transdermal estradiol. A review of its pharmacological profile, and therapeutic potential in the prevention of postmenopausal osteoporosis. Drugs Aging 1992; 6: 487-507.
41. Genant HK, Lucas J, Weiss S, et al. Low dose esterified estrogen therapy: effects on bone, plasma estradiol concentrations, endometrium, and lipid levels. Arch Intern Med 1997; 157: 2609-2615.
42. Sperof L, Roman J, Symons J, et al. CHART Study Group. The comparative effect on bone density, endometrium and lipids of continous hormones as replacement therapy. (CHART Study): randomized controlled trial. JAMA 1996; 276: 1397- 1403.
43. Robison D, Friedman L, Marcus R, et al. Estrogen replacement therapy and memory in older women. J Am Geriatr Soc 994; 42: 919-922.
44. Yesavage JA. Geriatric depression scale. Psychopharm Bull 1988; 24: 709-711.
45. Fang-Ping C, Nig L, Soog YK, et al. Comparison of transdermal and oral estrogenprogestin replacement therapy: effects of cardiovascular risk factors. Menopause 2001; 8: 347-352.
46. Stevenson JC, Manassiev O, Whitehead MI et al. Randomized trial of effect of transdermal continuous combined hormone replacement therapy on cardiovascular risk markers. Br H Haematol 2004; 124: 802-808.
47. Utian MH, Gass MI, Pickar JH. Body mass index does not influence response to treatment, nor does body weight change with lower doses of conjugated estrogen and medroxyprogesterone acetate in early postmenopausal women. Menopause 2004; 11: 306-314.
48. Stanczyk FZ, et al. Randomized comparison of nooral estradiol delivery in postmenopausal women. Am J Obstet Gynecol 1988; 159: 1540-1546.
49. Walsh BW, et al. Effects of postmenopausal estrogen replacement on the concentrations and metabolism of plasma lipoproteins. N Engl J Med 1991; 325: 1196-1204.
50. Mattson LA, Samsioe C, Von Shoultz B, et al. Transdermal administered oestradiol combined with oral medroxiprogeterone acetate the effect on lipoprotein metabolism in postmenopausal women. Br J Obstet Gynecol 1993; 100: 450-453.



CLIC AQUÍ Y DÉJANOS TU COMENTARIO