Revisión de Temas
Mario Arturo González Mariño, MD*
Resumen
Resultados principales: la detección de lesiones neoplásicas en el seno cuando aún no han llegado al tamaño de hacerse palpables, representa un importante avance en el manejo y pronóstico del cáncer de seno. La mamografía es el examen que con más frecuencia permite el diagnóstico de estas lesiones. Puesto que las lesiones mamográficas, en la mayoría de las veces, representan lesiones benignas, se han acordado lineamientos de clasificación para correlacionar los hallazgos encontrados en el examen radiológico, con la posibilidad de encontrar patología maligna en la biopsia. El sistema BI-RADS (“Breast imaging reporting and data system”) se usa hoy día con este propósito. Una vez definida la necesidad de establecer un diagnóstico patológico de la lesión, se desarrollan diferentes procedimientos que orientan la biopsia. El método considerado como “prueba de oro”, es la marcación por arpón, pero se han desarrollado métodos basados en equipos de estereotaxia, que aunque tienen una menor precisión, poseen menos complicaciones y permiten un resultado estético óptimo.
Se han propuesto otros sistemas de localización de lesiones no palpables, como el de biopsia guiada por radiocirugía y se adelanta investigación con aplicaciones diferentes de la Resonancia Nuclear Magnética (RNM).
Conclusiones: la biopsia escisional previa marcación por arpón, representa el método más preciso en el diagnóstico de lesiones no palpables de seno. Sin embargo, con equipos de estereotaxia, se pueden lograr resultados que aunque tienen menor precisión que la biopsia escisional, tienen menos complicaciones y mejor resultado estético.
La posibilidad de detectar lesiones no palpables en el seno es un desarrollo médico que ha contribuido de manera notable a la disminución de la mortalidad causada por el cáncer mamario, en el que la sobrevida está relacionada con un menor tamaño del tumor y la ausencia de diseminación a los ganglios axilares o a otros órganos (1-6). El amplio uso de la mamografía y el progreso de otros procedimiento permiten la detección temprana del cáncer de mama en pacientes que en su mayoría son asintomáticos y solo acuden a un control mamográfico de tamizaje (7,8). Actualmente las lesiones no palpables constituyen una importante proporción de las biopsias en los servicios de patología mamaria, como lo reporta Lifrange, en cuyo servicio constituyen el 30% de las biopsias y en el que más de 20% de los cánceres operados tienen un tamaño menor de 1 cm (9).
La posibilidad de encontrar lesiones muy pequeñas es el resultado de un importante manejo en equipo del cáncer de seno; así llegamos a la conclusión de que el cirujano tiene que intervenir basado en imágenes o con el apoyo de otros recursos médicos, puesto que estas lesiones no son visibles ni se pueden tocar; además, este resultado permite formas de tratamiento menos agresivo para el carcinoma.
El tamizaje conduce a la detección de una variedad de cambios en el tejido glandular del seno, muchos de los cuales no se deben al cáncer; por lo tanto, se requiriere del diagnóstico patológico (10). Si una lesión mamográfica necesita biopsia, la decisión se basa en la buena técnica radiológica, en sólidos conocimientos de interpretación mamográfica y en la experiencia clínica (11). Para este efecto se acepta, hoy en día, la categoría de BI-RADS (Breast Imaging Reporting and Data System), que es el producto de la colaboración entre miembros de varios comités del American College of Radiology, con la cooperación de otras instituciones (12-14).
La clasificación y sus recomendaciones son:
0 Se requiere de evaluación adicional.
1 Normal (tamizaje de rutina).
2 Benigna (tamizaje de rutina).
3 Probablemente benigna (seguimiento a corto plazo).
4 Sospechosa (se debe considerar la biopsia).
5 Altamente sospechosa de malignidad (se indica la biopsia).
En la evaluación de las biopsias correspondientes a estas lesiones mamográficas, se encuentra carcinoma en aproximadamente el 33% de la categoría BI-RADS 4 y en 90% de la categoría 5 (15-17).
La decisión de proceder a la biopsia no debe tomarse hasta completar la evaluación con imágenes, además del examen físico (13). En imágenes se incluyen: proyecciones adicionales, compresión localizada, magnificación y evaluación ecográfica (lesiones de tipo masa de las que pueden resultar quistes y no lesiones sólidas).
En el caso de BI-RADS 3 se recomienda, en la mayoría de los casos, un control mamográfico a los seis meses. La probabilidad de malignidad en estas lesiones es menor del 2% (18), pero puede estar indicada la biopsia en el caso de una paciente ansiosa, o con historia familiar importante, o cuando es improbable el cumplimiento para el control a los seis meses, o planea un embarazo o una mamoplastia de aumento o reductora (17).
La manera de abordar la biopsia de lesiones no palpables ha cambiado desde la resección de cuadrantes a la localización con arpón. La aspiración con aguja fina guiada por radiografía se reemplazó por la aspiración con aguja fina orientada por estereotaxia. A comienzos de 1990 se desarrolló la biopsia estereotáxica con agujas 18 y 14; luego apareció la biopsia asistida por vacío con agujas 11 o 14, y más recientemente, un nuevo aparato llamado ABBI (Advanced Breast Biopsy Instrumentation).
Cuando aparece un equipo nuevo se compara este contra el “patrón oro” para lesiones no palpables, que es la localización con arpón y biopsia escisional (19).
En la selección del tipo de procedimiento se han evidenciado varias lesiones que son mejor tratadas con biopsia escisional que por biopsia percutánea (20). Entre estas se encuentran la distorsión de la arquitectura o microcalcificaciones poco agrupadas, segmentarias o regionales. Hay también ciertas lesiones cuyo diagnóstico realizado mediante biopsia estereotáxica requiere, posteriormente, efectuar una biopsia escisional, estas son: en la hiperplasia ductal atípica, cicatriz radial, muestra insuficiente o mamografía y patología no concordantes; en la hiperplasia lobular atípica y en el carcinoma lobulillar “in situ” (21) (en caso de quedar microcalcificaciones residuales), lesión papilar no especificada, para diferenciar entre fibroadenoma celular y tumor filodes, y en el carcinoma si se ha decido cirugía conservadora mediante marcación por arpón.
En la hiperplasia ductal atípica se ha encontrado carcinoma cercano al sitio de la biopsia estereotáxica en el 50% de los casos y la cicatriz radial coexiste con carcinoma en el 20% de los casos. Con imágenes altamente sugestivas de malignidad, no se acepta una biopsia con aguja gruesa discordante.
En el estudio de Liberman y cols. (22), en el cual se evalúa la confiabilidad de la biopsia con aguja gruesa para detectar invasión en comparación con la biopsia quirúrgica, hubo una discordancia en la histología en el 8% de los cánceres respecto a la presencia o ausencia de invasión. Esta diferencia parece ser más frecuente en la evidencia de masa que en la de calcificaciones y menor en la biopsia por mamotomo (23).
Biopsia Orientada por Arpón
Se puede orientar la localización de la lesión mediante mamografía y en algunas oportunidades bajo visión ecográfica.
Mamografía
Las resecciones para biopsia del seno, con localización preoperatoria con arpón, requieren del trabajo conjunto y bien coordinado de radiólogos que marcan la lesión y controlan la pieza quirúrgica extraída, de cirujanos que la extirpan intentando conseguir el mayor resultado estético posible y de patólogos expertos que procesan y analizan correctamente la pieza (11, 24).
Para la colocación del arpón con el mamógrafo convencional es imprescindible realizar dos proyecciones perpendiculares, cráneo-caudal y lateral, para tener una idea tridimensional de la ubicación de la lesión. Mediante el uso de un compresor fenestrado y marcado, se introduce la aguja por la zona de menor distancia entre la lesión y la piel (figura 1). Los métodos más seguros y precisos implican colocar agujas paralelas a la pared torácica (10). Una vez obtenida la muestra quirúrgica es imprescindible que esta se someta a evaluación mamográfica para asegurar la extracción de la lesión que se va a estudiar.
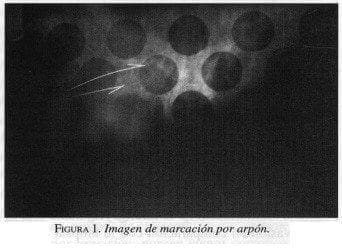
La falla para quitar un cáncer de seno tras una localización con aguja debe ser menor del 1%. En este caso, si se evidencia que una lesión no ha sido extraída mediante la mamografía de la pieza, se puede ampliar la biopsia inmediatamente (25).
Si los criterios morfológicos sugieren malignidad, se recomienda una escisión más amplia, para tratar de obtener márgenes libres de tumor y reducir la necesidad de una nueva escisión (10).
Los arpones son alambres de dos tipos: reposicionables y no reposicionables; división relacionada con la posibilidad de corregir su ubicación una vez colocados. El inconveniente con los reposicionables, es que se pueden desplazar con el traslado y durante el procedimiento quirúrgico.
Ecografía
Cuando en la ecografía resulta visible la lesión, esta es la técnica ideal para la marcación por ser la más rápida, exacta y cómoda para la paciente (26). Para estos procedimientos se requiere de un transductor lineal de 7,5 mhz o mayor (27). La ecografía se puede usar en mujeres embarazadas, biopsia de ganglios, lesiones cercanas a la pared torácica y lesiones adyacentes a prótesis o que están en la periferia del seno, y por esta razón no logran ser proyectadas en la mamografía. Además es un procedimiento de bajo costo (17,28), con el cual se visualiza la aguja en tiempo real, y permite la marcación de lesiones a través de un menor volumen mamario.
Entre sus desventajas figuran (10): ya no detectan las microcalcificaciones que son el signo radiológico más frecuente en las lesiones no palpables; es una técnica dependiente del examinador; cuando hay hipertrofia mamaria la visión profunda es limitada, y en el patrón muy lipoideo es difícil la identificación de nódulos inferiores a 10 mm.
El alcohol o la solución salina son los mejores materiales de acoplamiento para estos procedimientos, porque el gel convierte a la mama en resbaladiza y difícil de estabilizar (10).
Como se hace con las biopsias localizadas por mamografía, el tejido extirpado debe colocarse en una bolsa de plástico y enviarse para confirmación por imagen. Si la lesión es visible con ultrasonido, se puede utilizar imagen por ultrasonido de la pieza directamente a través de la bolsa de plástico para confirmar la extirpación de la lesión.
En resumen, la biopsia, previa marcación por arpón, es el método más preciso en el diagnóstico de lesiones no palpables en el seno y puede conseguir márgenes libres en caso de malignidad. Sin embargo, tiene inconvenientes, como el de requerir incidir en el seno, lo cual deja una cicatriz más amplia, y poseer mayor riesgo de complicaciones postoperatorias, como hematoma e infección. Para el cirujano los arpones pueden ser difíciles de sentir, dificultando así el procedimiento (10) y con frecuencia se extrae mayor tejido del necesario, como en el caso de una lesión benigna.
* Médico Especialista Grupo de Seno. Clínica San Pedro Claver. Hospital Central de la Policía.
Biopsia por Aguja Bajo Guía Estereotáxica
El principio de la estereotaxia es la localización precisa de la lesión mediante tres dimensiones que se determinan sobre la base de su aparente cambio de posición en dos ángulos de la imagen (29); las coordenadas x y y son evidentes en las imágenes y la profundidad Z se calcula del giro del paralelaje (20).
Es menos invasiva y costosa que la biopsia quirúrgica (17,20,30,31), y se utiliza para demostrar enfermedad multicéntrica (17), evitando a la paciente una doble cirugía (20); se remueve menos tejido, no hay deformidad en el seno y la cicatriz es mínima o no se encuentra en los mamogramas posteriores (31). Puede obviar los procedimientos quirúrgicos en mujeres con lesiones benignas (17) y reducirlos en pacientes con cáncer (17,30). Sin embargo, con la aguja las calcificaciones son difíciles de obtener y no permite dejar un marcador; puede caracterizar incompleta la lesión mamotomo (27).
La indicación más importante es en las lesiones de categoría BI-RADS 4, permitiendo definir entre el manejo médico con seguimiento mamográfico y el quirúrgico (20).
Otros de sus posibles usos son en las lesiones BI-RADS 5. En ellas se puede realizar para confirmar el diagnóstico y planear el tratamiento; también en los casos de BI-RADS 3 y que son aceptados para biopsia y en lesiones de pacientes sin posibilidades quirúrgicas (estado IV, recidivas, linfomas, etc.).
Los aparatos de estereotaxia son de dos tipos: los adicionados a equipos convencionales de mamografía y las unidades exclusivas con mesas para decúbito prono, que permiten el paso de la mama a través de una abertura en la mesa.
Las ventajas (10) de los equipos adicionados son de menor costo, el mamógrafo puede ser usado en la actividad acostumbrada, más cómodo para pacientes en mal estado general y permite mejor visión de las lesiones cercanas a la pared torácica y axila (20). Sus desventajas son mayor probabilidad de reacción vasovagal, por estar la paciente observando el procedimiento, menor espacio para realizar la biopsia, requiere que la paciente permanezca sentada e inmóvil (27), y las anormalidades mamográficas justo debajo de la piel pueden ocasionar problemas técnicos.
Las unidades con mesas para decúbito prono permiten a la paciente yacer en la mesa con el seno colgando a través del agujero ubicado alrededor de la mitad de la mesa. El mamógrafo y el equipo de biopsia se colocan debajo de la mesa para dar mayor espacio y el uso de microprocesadores asegura que la aguja se introduzca en la lesión en forma precisa.
Las desventajas son:
• Impedir el acceso a lesiones cerca de la pared torácica y las localizadas en la axila o que están próximas al esternón, incapacidad para biopsia, lesiones superficiales, probabilidad de falla en lesiones del lado contrario o senos muy delgados, y peso límite máximo.
• El movimiento de la paciente puede invalidar los datos de localización, especialmente si el movimiento ocurre en el intervalo de la localización de la imagen y la colocación de la aguja.
• Las pacientes que no pueden permanecer en decúbito prono o que son incapaces de cooperar (por ejemplo, con falla cardíaca, artritis o trastornos psiquiátricos), por la duración del procedimiento (20 a 40 minutos), no son candidatas apropiadas (10).
• La mesa en prono es costosa y el equipo únicamente está dedicado a procedimientos de toma de biopsia (12).
Se recomienda excluir de este procedimiento a las pacientes con diátesis hemorrágica.
Las imágenes pueden ser grabadas en película o se puede utilizar un detector digital. Las películas son baratas, pero el procedimiento se hace más largo. La imagen digital provee una visión casi inmediata; permite que el procedimiento sea más rápido y reduce la posibilidad de que la paciente se mueva.
En sus comienzos, la biopsia percutánea se hizo por aspiración con aguja fina, pero debido al alto porcentaje de muestra insuficiente (35,4%) (33-35), incapacidad para diferenciar carcinoma in situ e invasivo (35) y escasez de citopatólogos experimentados fue dejada de lado y actualmente se prefiere la biopsia con aguja gruesa (17).
Es raro que las muestras con aguja gruesa sean insuficientes (36) y el material así obtenido permite el diagnóstico diferencial entre carcinoma in situ e invasivo. Se han reportado cinco especímenes con aguja 14 que logran el 99% de precisión para las masas, pero se requiere de 10 o más especímenes para las calcificaciones (12). Se recomienda hacer radiografía rutinaria del espécimen en el caso de microcalcificaciones para verificar su obtención y para orientar al patólogo (12).
En un estudio interinstitucional, se reportó que en el 5.4% de las mujeres en las que se diagnosticó una lesión benigna por estereotaxia con aguja gruesa, se encontró carcinoma en el seguimiento (12), en contraste con radiólogos y cirujanos con experiencia en biopsia escisional, quienes reportaron que solo se omiten del 0,2 al 0,3% de las lesiones.
El error en la muestra (10) posiblemente se deba a movimiento de la paciente, a su mama, al tejido diana durante el procedimiento, al hecho de que los cánceres son heterogéneos y el tejido del que se obtuvo la muestra no tenía tumor, o por error en la ubicación de la lesión.
En resumen, la biopsia con aguja presenta una baja tasa de error, aunque mayor que la biopsia escisional guiada por arpón, pero es un procedimiento poco traumático y una alternativa que se ha reportado como menos costosa.
Otras Alternativas Diagnósticas
Punción con aguja gruesa de corte y aspiración de tejido mamario (mamotomo-MIBB)
Es una técnica similar a la biopsia con aguja gruesa, que además de utilizar agujas de mayor calibre, añade aspiración del fragmento extraído, con lo que se consigue obtener múltiples cilindros de tejido de mayor longitud sin necesidad de extraer la aguja; igualmente, permite la colocación de marcadores en caso de requerirse una intervención quirúrgica. Su sistema consiste en una cuchilla circular accionada eléctricamente y de un dispositivo de aspiración de tejido. No se requiere suturar la piel ni el ingreso hospitalario. Es conveniente realizar mamografía de los cilindros para confirmar la presencia de microcalcificaciones.
Con este sistema se recupera una mayor cantidad de microcalcificaciones, lo cual puede disminuir la posibilidad de error (37). Las indicaciones son lesiones BI- RADS 4 y 5.
Brem y cols. (38) encontraron que la tasa de subestimación en lesiones diagnosticadas como carcinoma ductal in situ, con aguja 14 y con biopsia asistida por vacío, es del 35 y 14%, respectivamente. En el mismo sentido, Won y cols. reportaron que con aguja 11 asistida por vacío se puede mejorar el diagnóstico de carcinoma ductal in situ, sin embargo, persiste la subestimación (39).
Sistema ABBI
Consiste en una cánula de plástico que contiene una cuchilla de corte circular. Existen varios diámetros en el mercado: 5, 10, 15 y 20 mm. Este sistema permite la extracción con anestesia local de un único cilindro de gran calibre, con el que se puede conseguir la extirpación total de lesiones detectadas por mamografía con diámetro menor de 2 cm, sin intervención quirúrgica. Se necesita un sistema de decúbito prono, requiriéndose de esta posición por tiempo prolongado. Además, permite la colocación de marcadores metálicos (clips o carbono en el lecho de la lesión para la identificación de la zona en el momento quirúrgico abierto). A pesar de tener opiniones favorables como la de La Raja y cols. (40), quienes lo conciben como un valioso instrumento para el cirujano, existen otras que se oponen a su uso por tener varios inconvenientes (41): es más dispendioso que los anteriores procedimientos (30) y no se ha probado que provea beneficios que justifiquen ese costo (17), la tasa de falla es alta (del 20% o más, según reporte de varios estudios (17), las complicaciones son mayores que con otros métodos (17) (cerca del 6% (27)), los especímenes son recuperados en forma tubular siendo difícil su orientación (42), el cirujano puede tener dificultad para encontrar el sitio del carcinoma dentro de la cavidad de la biopsia y entre el 0 y el 29% de las lesiones no palpables no son adecuadas para el sistema ABBI (43,44).
Cirugía radioguiada
Es un procedimiento desarrollado y convertido en método de rutina en el Instituto Europeo de Oncología de Milán (Italia) y se le ha denominado ROLL (del inglés “Radioguided Occult Lesion Localization”: localización radioguiada de lesiones ocultas) (45,46); consiste en la inyección de partículas coloidales de albúmina sérica humana de 10 a 150 mm de diámetro, marcadas con 3,7 MBq de tecnecio radiactivo directamente en la lesión durante la mamografía o ecografía, 24 horas antes de la cirugía. Mediante un detector gammagráfico se busca el sitio de la lesión que ha sido previamente señalado en la piel. Una vez extraída la pieza, se evalúa la radiactividad residual y se hace comprobación radiológica. De 647 pacientes del estudio de Gennari, se verificó la presencia y ubicación central de la pieza en 644 de estos.
Este procedimiento, según el estudio, es seguro desde el punto de vista de la radiactividad para las pacientes y el grupo médico. El estudio advierte que las pacientes con calcificaciones difusas o multicéntricas, fueron excluidas del mismo.
Resonancia nuclear magnética
Los sistemas de biopsia con resonancia nuclear magnética (RNM) actualmente son considerados como experimentales y se encuentran en pocos sitios (27,47). Una de sus limitaciones es la comprobación de la remoción de la lesión, por lo que se investiga un marcador que sea visible en la revisión de la pieza por mamografía o sistemas para evaluar la biopsia directamente con resonancia magnética.
Abstract
The detection of neoplastic lesions of the breast at the stage when they are not palpable represents an importance advance in the management and prognosis of breast cancer. Mammography is the most frequently performed procedure in the diagnosis of these lesions. Considering that most of the lesions detected by mammography are benign, there has been an increased interest in developing classification schemes intended to correlate the radiologic findings with the probability of malignancy in the biopsy. The BI-RADS (“Breast Imaging Reporting and Data System”) system is widely utilized for this purpose today. Once defined the necessity of establishing a pathologic diagnosis, there are different methods for approaching the biopsy. The gold standard is the preoperative localization with a needle, bust there are also stereotactic methods; however, these are less accurate, although they are associated with fewer complications and provide an optimal cosmetic result.
Other systems have been proposed for the localization of nonpalpable lesions, such as the biopsy guided by radiosurgery, and there is research on applications of MRI.
Conclusions: excisional biopsy of a needle localized lesion is the most reliable method for the diagnosis of non palpable breast masses. However, stereotactic methods although less reliable than the excisional biopsy, are associated with fewer complications and better cosmetic result.
Referencias
1. Carter CL, Allen C, Henson DE: Relation of tumor size, lymph node status, and survival in 24740 breast cancer cases. Cancer 1989; 63: 181-7.
2. Nystrom L: Breast cancer screening with mammography: overview of Swedish randomized trials. Lancet, 1993; 341: 973-8.
3. Letton AH, Mason EM, Ramshaw BJ: Twenty-year review of a breast cancer screening project. Ninety-five percent survival of patients with nonpalpable cancers. Cancer, 1996; 77: 104-6.
4. González Mariño M, Márquez G: Cáncer de mama. Clínica San Pedro Claver 1982-1993. Rev Col Obst Ginec, 1996; 47: 103-13.
5. Abaunza H: Cáncer mamario: factores pronósticos. En: Abaunza H (ed). Cáncer mamario. 2ª ed. Avanzar Editores Ltda., 1997; 37-49.
6. Márquez G, González Mariño M, Abaunza H: Cáncer mamario. Clínica San Pedro Claver, ISS. En: Abaunza H (ed). Cáncer mamario. 2ª ed. Avanzar Editores Ltda., 1997; 343-71.
7. Clay MG, Hiskop G, Kan L, et al.: Screening mammography in British Columbia 1988-1993. Am J Surg, 1994; 167: 490-2.
8. Sánchez H, Cambas A: Imágenes diagnósticas en cáncer mamario. En: Abaunza H (ed). Cáncer mamario. 2ª ed. Avanzar Editores Ltda., 1997; 79-108.
9. Lifrange E, Colin C: La chirurgie mammaire supraconservatrice. J Gynecolog Obstet Biol Reprod 2000; 29: 285-7.
10. Kopans DB: Biopsia guiada por imagen y localización o marcación preoperatoria de las lesiones clínicamente ocultas. En: Kopans DB (ed). La mama en imagen, 2ª ed. Madrid: Marban de España 1999; 637-720.
11. Peña PM, Montoya J, Patiño JF: Lesiones no palpables del seno. Rev Colomb Cir, 1990; 5: 123-7.
12. Bassett L, Winchester DP, Caplan RB: Stereotactic Core-Needle Biopsy of the breast: A report of the Joint Task force of the American College of Radiology, American College of Surgeons and College of American Pathologists. CA Cancer J Clin, 1997; 47: 171-90.
13. Basset LW: Determinants of quality in mammography. Surg Oncol Clin N Am, 1997; 6: 213-32.
14. Fajardo L, De Angeles GA: The role of stereotactic biopsy in abnormal mammograms. Surg Oncol Clin N Am, 1997; 6: 285-99.
15. Liberman L, Abramson AF, Squires FB, et al.: The breast imaging reporting and data system: positive predictive value of mammographic features and final assessment categories. AJR Am J Roentgenol, 1998; 171: 35-40.
16. Orel SG, Kay N, Reynolds C, et al.: BI-RADS categorization as a predictor of malignancy. Radiology, 1999; 211: 845-50.
17. Liberman L: Clinical management issues in percutaneous core breast biopsy. Radiol Clin North Ame, 2000; 38: 791-807.
18. Sickles EA: Periodic mammographic follow-up of non palpable breast lesions: results in 3184 consecutive cases. Radiology, 1991; 179: 463-8.
19. Rebner M, Chesbrough R, Gregory N: Initial experience with the advanced breast biopsy instrumentation device. AJR 1999; 173: 221-6.
20. De Paredes ES, Langer TG, Cousins JF: Current Probl Diagn Radiol, 1998; 27: 133-84.
21. Berg WA, Mrose HE, Loffe OB: Atypical lobular hyperplasia or lobular carcinoma in situ at core-needle breast biopsy. Radiology, 2001; 218: 503-9.
22. Liberman L, Dershaw DD, Rosen PP, et al.: Stereotactic core biopsy of breast carcinoma: accuracy at predicting invasion. Radiology, 1995; 194: 379-81.
23. Jackman RJ, Burbank F, Parker SH, Evans III WP, et al.: Stereotactic breast biopsy of nonpalpable lesions: Determinants of ductal carcinoma in situ underestimation rates. Radiology, 2001; 218: 497-502.
24. Gimeno MJ, Villavieja JL, Sainz JM, Moros M, Madariaga B: Biopsias radioquirúrgicas con arpón colocado por estereotaxia en lesiones mamarias subclínicas: Análisis de resultados. Rev Senología y Patol Mama, 2000; 13: 155-65.
25. Kopans DB, Meyer JE, Lindfors KK: Spring-hook wire breast lesion localizer use with rigid compression mammographic systems. Radiology, 1985; 157: 537-8.
26. Sadowsky NL, Semine A, Levin E: Ultrasonographic guidance for needle biopsy of breast lesions. Surg Oncol Clin N Am, 1997; 6: 265-84.
27. Dershaw DD: Equipment, technique, quality assurance and accreditation for imaging-guided breast biopsy procedures. Radiol Clin North Am, 2000; 38: 773-807.
28. Liberman L, Feng TL, Dershaw DD, et al.: Ultrasound-guided core breast biopsy: utility and cost-effectiveness. Radiology, 1998; 208: 717-23.
29. Liberman L: Percutaneous imaging-guided core breast biopsy: State of the art at the Millennium. AJR 2000; 174: 1191-9.
30. Lee CH, Eglin TIK, Philpotts LE, et al.: Cost-effectiveness of stereotactic core-needle biopsy: analysis by means of mammographic findings. Radiology, 1997; 202: 849-54.
31. Jackman RJ, Nowels KW, Rodríguez-Soto, et al.: Stereotactic, automated, large-core needle biopsy of nonpalpable breast lesions: false-negative and histologic underestimation rates after long-term follow-up. Radiology, 1997; 210: 799.
32. Burbank F: Mammographic findings after 14-gauge automated needle and 14-gauge directional, vacuum-assisted stereotactic breast biopsies. Radiology, 1997; 204: 153-6.
33. Pisano ED, Fajardo LL, Caudry DJ, et al.: Fine-needle aspiration biopsy of nonpalpable breast lesions in a multicenter clinical trial: results from the Radiologic Diagnostic Oncology Group V. Radiology, 2001; 219: 785-92.
34. Jackson VP, Basset LW: Stereotactic fine-needle aspiration biopsy for nonpalpable breast lesions. Am J Roentgenol, 1990; 154: 1196-7.
35. Massod S: Occult breast lesions and aspiration biopsy: a new challenge. Diagn Cytopathol, 1993; 9: 613-4.
36. Helvic MA, Baker DE, Adler DD, et al.: Radiographically guided fine-needle aspiration of nonpalpable breast lesions. Radiology, 1990; 174: 657-61.
37. Zannis VJ, Aliano KM: Evolving patterns of breast surgery with disappearance of open biopsy for nonpalpable lesions. Am J Surg, 1998; 176: 525-9.
38. Brem RF, Schoonjans JM, Goodman SN, Nolten A, et al.: Nonpalpable breast cancer: percutaneous diagnosis with 11 and 8-gauge stereotactic vacuum-assisted biopsy devices. Radiology, 2001; 219: 793-6.
39. Won B, Reynolds HE, Lazaridis CL, Jackson VP: Stereotactic biopsy of ductal carcinoma in situ of the breast Using an 11-gaugage vacuum-assisted device: persistent underestimation of disease. AJR 1999; 173: 227-9.
40. La Raja R, Saber AA, Sickles A: Early experience in the use of the advanced breast biopsy instrumentation: a report of one hundred twenty-seven patients. Surgery, 1999; 125: 380-4.
41. Rebner M, Chesbrough R, Gregory N: Initial experience with the advanced breast biopsy instrumentation device. AJR 1999; 173: 221-6.
42. Liberman L: Advanced breast biopsy instrumentation (ABBI). AJR 1999; 172: 1413-6.
43. Dahlstrom JE, Jain S, Sutton T, et al.: Diagnostic accuracy of stereotactic core biopsy in mammographic breast cancer screening programme. Histopathology, 1996; 28: 421-7.
44. Leibman A, Frager D, Choi P: Experience with breast biopsies using the advanced breast biopsy instrumentation system. AJR 1999; 172: 1409-12.
45. Luini A, Zurrida S, Galimberti V: Radioguided surgery of occult breast lesions. Europ J Cancer, 1998; 34: 204-5.
46. Gennari R, Gallimberti V, De Cicco C, et al.: Use of Technetium-99m-labeled colloid albumin for preoperative and intraoperative localization of nonpalpable breast lesions. J Am Coll Surg, 2000; 190: 692-9.
47. Orel SG: MR Imaging of the breast. Radiol Clin North Am, 2000; 38: 899-913.
Correspondencia:
Mario Arturo González Mariño
Correo electrónico: Marioar90@hotmail.com
Tels.: 248 31 07 – 623 45 66
