Almansa, J. E.; Barrera, G. P.; Malagón, A. L.
Respectivamente: DMV., MSc. Investigador,
Programa Nacional de Biotecnología Animal.
Corporación Colombiana de Investigación Agropecuaria, CORPOICA, Ceisa.
Av. El Dorado No. 42-42. Santafé de Bogotá.
Bacterióloga, MSc (candidata).
Unidad de Microscopía Electrónica. CORPOICA. Ceisa.
Estudiante de último semestre de bacteriología Universidad Colegio Mayor
De Cundinamarca. Pasante en CORPOICA.
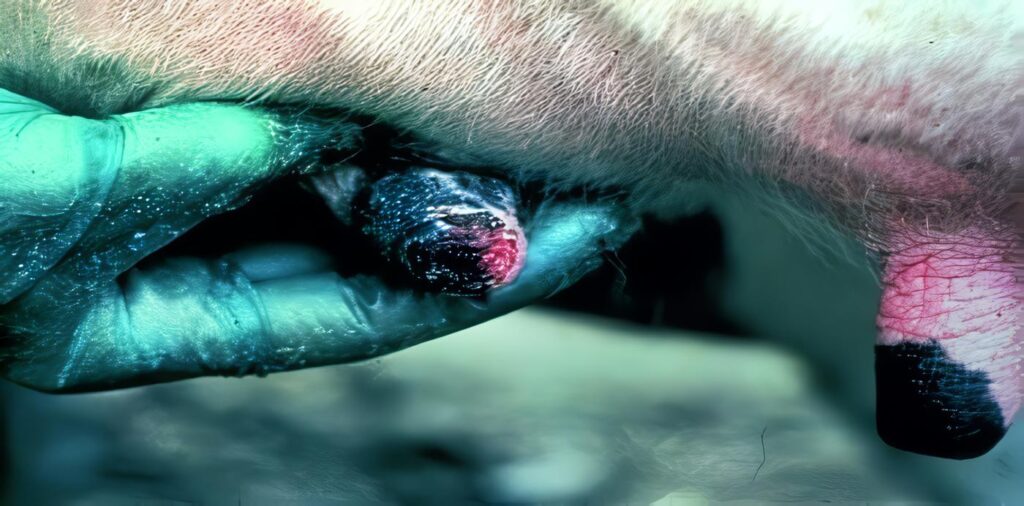
La estomatitis vesicular (EV) es una enfermedad contagiosa de origen viral que afecta entre otras especies bovinos, equinos, porcinos y eventualmente al hombre, en el que se desarrolla como un proceso clínico similar al producido por la influenza. La enfermedad se caracteriza por lesiones vesiculares en el epitelio de la mucosa oral, la lengua, las bandas coronarias de los cascos y los espacios interdigitales. En hembras bovinas en producción la ubre, y particularmente los pezones, se pueden ver severamente afectados. Los síntomas descritos coinciden ampliamente con los observados en la fiebre aftosa y como en ella, los casos fatales son raros, siendo la recuperación usualmente rápida y completa. La presencia del virus de la estomatitis vesicular (VEV), parece limitada al hemisferio occidental, especialmente a países que bordean el mar Caribe como México, Costa Rica, Colombia y Venezuela.
Desde el punto de vista etiológico, la EV es originada por virus de la familia Rhabdoviridae, del género vesiculovirus, de los que se reconocen dos serotipos distintos conocidos como New Jersey (NJ) e Indiana (I), de acuerdo con el lugar de origen de los primeros aislamientos caracterizados inmunológicamente. Dentro del serotipo Indiana se han encontrado tres subtipos con características antigénicas diferentes, l1 o Clásica, 12 o Cocal e I3 o Alagoas. Las cepas de los virus I2 e I3 son menos patogénicas para bovinos, equinos, porcinos, ovinos y caprinos que las del subtipo I1 (Levy, J. A., et al. 1994).
En Colombia la EV fue diagnosticada por primera vez en 1929 durante un brote ocurrido en el departamento del Huila (Laserna, 1966, citado por González et al. 1979): para 1950 fueron detectados dos brotes y en 1975 el número ascendió a 109, con lo cual se estableció la alta distribución del proceso en la ganadería nacional. Para el período comprendido entre 1989 y 1994 se presentaron un promedio de 380 focos por año, con dos picos epidémicos de 375 y 340 focos durante 1991 para los serotipos I y NJ respectivamente (Arbeláez et al., 1995). Entre 1994 y mayo de 1998 se han confirmado 1465 focos, de los cuales 1045 corresponden al serotipo New Jersey y los 420 restantes al Indiana (Laboratorio Nacional de Enfermedades Vesiculares. ICA). De otra parte la fiebre aftosa ha comenzado a descender de manera dramática en cuanto a presentación de focos, lo que ha permitido que la EV comience a ser evaluada individualmente y no, como se ha hecho tradicionalmente, por su valor relativo dentro de los programas de control de la fiebre aftosa.
De otra parte, en virología los estudios de microscopía electrónica permiten entre otras cosas, llevar a cabo procedimientos especializados de diagnóstico, comprobar la presencia del virus después de la implementación de métodos de purificación, realizar análisis morfológicos y, cuando se emplean métodos de marcación inmunológica, hacer el seguimiento de los antígenos respectivos, tanto virales como celulares.
En el presente trabajo se empleó un protocolo de purificación del VEV utilizando gradientes de densidad de sacarosa y se comprobó su presencia por microscopía electrónica de transmisión (TEM) utilizando tinción negativa en suspensiones virales, y además, se desarrolló un protocolo de comprobación de producción de VEV por células de la línea VERO.
Materiales y Métodos
El virus fue cultivado en células de la línea VERO, cosechado 48 horas después de la infección, concentrado con PEG al 7% y NaCl al 2,3% y purificado en gradiente de densidad contínuo de sacarosa (70 al 15%), en buffer TEN (Tris HCl 50 mM, EDTA 1mM, NaCl 0,15 M y pH 7,5), de acuerdo con metodologías previamente descritas (Manual de técnicas de laboratorio de enfermedades vesiculares, Instituto Colombiano Agropecuario, ICA, 1997).
Las suspensiones purificadas fueron contrastadas utilizando la técnica de tinción negativa. Para esto, una gota de la suspensión se colocó sobre papel parafinado (ParafilmÒ ) y luego una rejilla de níquel, previamente recubierta con una película de FomvarÒ se dejó flotar sobre la gota durante cinco minutos. El exceso de líquido se retiró colocando papel de filtro en los bordes. Posteriormente se realizó la tinción negativa con una solución de fosfotungstato de potasio al 2% y pH 6,8. Para ello se colocó una gota del contrastante sobre el papel parafinado y luego la rejilla con la muestra se dejó flotar sobre ella durante cinco minutos. Las rejillas se observaron en un microscopio electrónico de transmisión Phillips-CM 10.
Para la observación del botonamiento de partículas virales, se empleó: una caja de plaqueo, a partir de la cual una porción de agar, localizada sobre una placa en la monocapa de células, fue retirada y fijada con glutaraldehido al 2% en buffer fosfato pH 7,4 y posfijada con tetraoxido de osmio al 1%. Después del proceso de deshidratación en concentraciones ascendentes de etanol, las muestras fueron incluidas en resina LR-WhiteÒ . Se realizaron cortes ultrafinos de 40 nm. que fueron contrastados con acetato de uranilo y citrato de plomo para su posterior observación en el microscopio electrónico de transmisión.
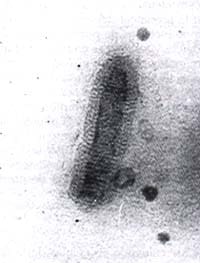
Figura nº1: comprobación por met de la purificación del vev por precipitación
con peg y ultracentrifugacion en gradiente continuo de sacarosa.
Figuras nº 2 y 3: las flechas señalan partículas virales botonando desde las membranas
de las células de la linea vero. 100.000 x.

Figura nº4. Partículas virales en medio extracelular del cultivo de células vero. 100.000 x.
Bibliografia
• Arbeláez, G. Pineda, A. Quintero, M. y Sánchez, C. Estomatitis vesicular en Colombia. 1989-1994. Revista Acovez. Vo1.20. N.2:22-25. 1995.
• González, G. y Torres, M. Arbovirus en Colombia. Revisión de literatura. Revista Colombiana de ciencias pecuarias. Vol 1. I, No. 3, 165-179.1979.
• Levy, J. A., Fraenkel-Conrat. H. y Owen, A.R. Virology. Third Edition. Prentice Hall, Englewood Cliffs, New Jersey 07632. 77-85. 1994.
• Orjuela, J. Pineda, L. A., Quintero, M. Sánchez, C. y Valbuena, R.M. Manual de técnicas del Laboratorio de enfermedades vesiculares. Instituto Colombiano Agropecuario, ICA. 1997.