Estudio experimental en conejos
Yolanda Restrepo Renjifo*
* Profesora asociada a la Unidad Especializada de Ortopedia,
Universidad Nacional de Colombia, Facultad de Medicina Unidad
de Ortopedia Hospital San Juan de Dios.
Resumen
En el nervio ciático de 48 conejos machos, se comparó la regeneración anatómica y funcional de un injerto nervioso convencional con un tubo perineural vacío vascularizado, de 30 mm de longitud, con un injerto de las mismas características con el pedículo vascular seccionado.
Los animales se sacrificaron por grupos 1 a 16 semanas después del procedimiento. Se efectuaron microangiogramas para analizar la revascularización de los injertos identificando los vasos epineurales, endoneurales y perineurales.
Para los estudios histológicos se hicieron cortes en el extremo distal del nervio y a través del tubo perineural vacío. Troncos nerviosos multifasciculares regeneraron hasta el extremo distal del nervio. Para la estimación cualitativa se tomaron en cuenta: el espesor de la vaina de mielina y la regeneración axonal. Los resultados cuantitativos obtenidos se trataron con histogramas y métodos matemáticos en porcentajes.
Estudios histoquímicos musculares con succinil dehidrogenasa mostraron regeneración de las fibras tipo I y II en ambos grupos. A las mismas 4 y 16 semanas la actividad muscular y los potenciales evocados fueron registradas, observándose reinervación.
Introducción
Los nervios periféricos requieren una suplencia local de energía para mantener sus funciones. Esta energía depende del flujo axoplásmico y del sistema vascular intraneural, que a su vez está reforzado por los vasos segementarios provenientes del sistema vascular extrínseco9, 10, 19.
Interferencias con la vascularización del nervio dan lugar a una alteración compleja de la energía del nervio, seguida por la interrupción de la propagación del impulso nervioso. Sin embargo, cuando el flujo intraneural se recupera rápidamente, los cambios producidos por el déficit en la energía nerviosa son indetectables.
Al contrario, cuando un nervio se secciona, la isquemia se produce inmediatamente, in terrumpiendo la suplencia de energía del nervio por completo llevándolo al deterioro de la función.
Después de la reparación, la regeneración nerviosa depende, en parte, de la rápida revascu-larización. Existen dos posibles caminos para esta revascularización: a partir de vasos que tienen origen en los extremos seccionados del nervio que se anastomosan con vasos provenientes del injerto, o bien, a partir de vasos provenientes de los tejidos circundantes que se anastomosan con los vasos del injerto19.
De acuerdo con Weiss y Taylor, para garantizar la supervivencia de un injerto, la circulación debe restablecerse en pocos días37.
Han sido informados numerosos estudios experimentales sobre la importancia de la vascularización12, 13, 14, 25, 27. Algunos autores sostienen que la formación de anastomosis vasculares (revascularización) entre los extremos del nervio y el injerto, se inicia en los injertos con pedículo vascular a las 72 horas, mientras que los injertos no vascularizados o libres, tardan seis o más días en iniciar el proceso1, 16, 24, 31.
De otro lado, ha sido demostrado que los nervios periféricos pueden regenerar a través de diferentes clases de tubos o conductos20, 26, 28 y numerosos estudios han utilizado diferentes materiales como injertos en los nervios periféricos, con resultados variables en cuanto a la regeneración26, 28.
En el presente estudio, se creó un modelo experimental para evaluar si la preservación del pedículo vascular (sistema extrínseco) de los injertos de perineurio vacío se asocia a una revascularización precoz y a una regeneración nerviosa más temprana.
Hipótesis
La utilización de un tubo perineural vacío vascularizado para reparar una pérdida nerviosa, puede lograr la misma o mejor regeneración que la obtenida con un autoinjerto no vascularizado de las mismas características.
Materiales y métodos
El nervio ciático de 48 conejos machos de peso entre 2.0 y 2.8 kg. fue utilizado para comparar el resultado morfológico y funcional, de un injerto de un tubo perineural vacío vascularizado, con un injerto no vascularizado de las mismas características, efectuado en el lado contralateral.
En cada extremidad del animal, el nervio ciático se resecó en una longitud total de 30 mm.
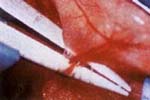
En el lado derecho, el injerto vascularizado se preparó con la siguiente técnica: después de identificar el pedículo vascular en el lado proximal del nervio (Figura 1); éste fue seccionado proximal y distalmente al pedículo sin retirarlo de su sitio en una longitud de 30 mm.
La permeabilidad del pedículo y la viabilidad del injerto se establecieron comprobando el sangrado en los extremos del nervio seccionado. Una vez identificados los fascículos, se extrajo el contenido intraneural del perineurio mediante una tracción suave ejercida en el lado proximal, retirando parcialmente los fascículos del primer grupo fascicular (Figura 2).
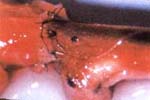
Para facilitar la identificación del perineurio que se encuentra colapsado, se instiló una gota de azul de metileno en el extremo distal. La primera sutura guía fue colocada en la pared posterior del extremo distal efectuando una sutura epiperineural entre el tubo vacío y el fascículo del extremo distal del nervio.
La sutura se efectuó siguiendo el método de triangulación. (Figura 3). La primera sutura guía fue colocada en el lado proximal entre el tubo perineural y un grupo fascicular del extremo del nervio seccionado (Figura 4) y posteriormente se terminó de retirar el fascículo para completar la sutura. (Figura 5).
 |
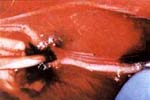 |
| Fig 1. Identificación del pedículo vascular | Fig 2. Extracción del contenido intraneural |
 |
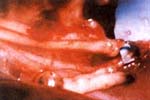 |
| Fig 3. Sutura del tubo perineural con el extremo distal | Fig 4. Sutura de la pared posterior en el extremo proximal |
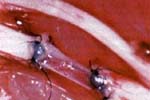
Fig 5. Sutura del primer tubo perineural
y los extremos nerviosos
Los otros dos fascículos fueron retirados y suturados en la misma forma. Fue mandatorio efectuar un cierre hermético interponiendo los puntos necesarios para evitar el escape de los axones en crecimiento y la formación de un neuroma lateral. (Figura 6).

Fig 6. Sutura terminada de todos los
En el lado izquierdo, el injerto se preparó en la misma forma: se identificó el pedículo proximal y se seccionó, suprimiendo la vascularización del injerto; posteriormente se efectuó un injerto perineural vacío con la misma técnica que en el lado contralateral.
La piel se cerró y no se dejó ninguna inmovilización externa. Los animales fueron dejados en libertad rodeados por una cerca de ladrillo, para evitar las úlceras infectadas que se producen en las patas al estar en jaulas debido al déficit sensitivo.
La revascularización fue evaluada mediante estudios angiográficos, la rege neración nerviosa con registros electromiogáficos y posteriormente los nervios preparados para las tinciones histológicas. Estudios histoquímicos del músculo tibial anterior, permitieron diferenciar la denervación y la reinervación de las fibras musculares.
Los estudios electromiográficos fueron hechos desde la cuarta semana después de la operación hasta la semana dieciséis. El estudio de la actividad muscular voluntaria se verificó en el gastrocnemius y en el tibialis cranialis con una aguja electrodo concéntrica de 0.45 mm. de diámetro colocada en la parte posterior de la pata. La respuesta evocada se obtuvo en el gastrocnemius con una aguja electrodo bipolar, por medio de estimulación trascutánea de 75 V y con una duración de 0.2 ms.
Para los estudios angiográficos, histológicos e histoquímicos los animales fueron sacrificados en grupos 1 a 16 semanas después de la intervención.
Antes del sacrificio, se aplicaron 500 UI/kg. de peso de heparina intravenosa y el sistema vascular del nervio ciático fue preparado por infusión de sulfato de bario en la aorta según el método descrito por Edshage en 19649 y otros autores2, 9, 18. Microangiogramas de alta resolución fueron elaborados y fotografiados como lo describen los mismos autores. Los vasos epineurales, perineurales y endoneurales fueron identificados y registrados.
A partir de la cuarta semana, el músculo tibial anterior se disecó al mismo tiempo que se tomaron los nervios para la histología. Este músculo está compuesto de diferentes tipos de fibras musculares y con métodos histoquímicos para la succinil dehidrogenasa [SDH] pueden diferenciarse las fibras tipo I y tipo II. Sin embargo, es difícil identificar las fibras de tipo intermedio, las cuales no se tomaron en cuenta en este estudio.
Los nervios ciáticos se fijaron en Gluta-raldehido en una solución buffer de cacodilato. Los segmentos se colocaron en Epon y se colorearon con Azur II. Se efectuaron secciones trasversales del nervio de 1 micrón de espesor a lo largo del injerto y 3 mm. distales al sitio de sutura, tanto en el grupo experimental como en el control.
Las secciones fueron examinadas al microscopio de luz y se hizo una estimación cuantitativa del espesor de la vaina de mielina y del numero de fibras.
Se efectuó un análisis univariado haciendo una estimación cuantitativa del diámetro de las fibras, midiendo el espesor de la vaina de mielina y considerando ésta como única variable. Esta estimación se calculó en porcentajes y cada valor promedio entre cero y 16 micrones se registró en el computador.
Las medidas se verificaron en un tektronix, (R) modelo 4050, que está equipado a su vez con una tabla numérica. El número de fibras se midió a través de una ventana inspección estándar para todas las observaciones.
El nivel de mielinización se determinó como el porcentaje promedio entre el eje mayor y menor de la fibra de mielina. Una vez hechas todas las mediciones, se agruparon por tiempo (semanas) y en cada grupo de datos se obtuvo la media aritmética y la varianza.
Se estableció la distribución de frecuencia de las distintas fibras midiendo el espesor de la vaina de mielina, la estimación de la media y la varianza.
Posteriormente se efectuó un análisis de diferencia de las varianzas a partir de la homologación de las distribuciones «t» de Student y F de Fischer, con un nivel de significancia = 0.005.
Para comparar las medidas de los dos grupos se utilizó un histograma, en el cual, el número de fibras (eje X) se comparó con el diámetro de las mismas (eje Y). Se analizaron las láminas histológicas de la parte media y de la porción distal de los injertos nerviosos con tubos de perineurio vacío tanto de los vascularizados como de los no vascularizados.
