Enrique Ardila Ardila
Profesor Asociado de Medicina Interna y Endocrinología
Facultad de Medicina – Universidad Nacional
Santafé de Bogotá
Anormalidades en la remodelación ósea ocurren en la mayoría de las patologías que afectan los seres humanos. La pérdida ósea relacionada con la edad y sus consecuencias a nivel de salud pública en la sociedad occidental compromete aproximadamente el 25% de las mujeres y del 5 al 10% de los hombres.
Otras patologías que comprometen la remodelación ósea, tales como las enfermedades malignas, el hiperparatiroidismo primario y la enfermedad de Paget se presentan con frecuencia en la población de más edad.
Esta última afecta aproximadamente el 3% de la población por encima de los 40 años en muchas regiones del mundo occidental, siendo raro este diagnóstico en nuestro medio muy posiblemente por falta de familiaridad con su cuadro clínico.
El hiperparatiroidismo primario ha aumentado su aparición (1/1000 en adultos en los Estados Unidos) debido a la dosificación sistemática de los niveles de calcio en sangre.
A medida que la sociedad se ha ido envejeciendo, las enfermedades crónicas y degenerativas han ido apareciendo y tomando importancia, entre las cuales se encuentra la osteoporosis.
Sabemos que en 1995 en el mundo había 1.4 billones de mujeres por encima de los 49 años, aumento que ha sido más importante en los países en vía de desarrollo y sabiendo que una cuarta parte de éstas potencialmente podrían presentar osteoporosis, la cantidad se vuelve inimaginable. En Colombia y según el censo de 1993 existen 2.5 millones de mujeres por encima de los 50 años, lo cual coloca a la osteoporosis en nuestro medio como un problema importante de salud pública.
En los Estados Unidos se producen 1.200.000 fracturas anuales relacionadas con osteoporosis:
Representando aproximadamente la mitad en columna, y el resto en cadera y antebrazo. A nivel mundial un cálculo aproximativo de las de cadera era 1.660 millones en 1990 y 6.260 millones serán para el año 2050.
En Inglaterra la fractura de cadera representa el costo más importante en relación cama-día, cuando se compara con otras entidades como la diabetes mellitus, el infarto del miocardio o la enfermedad pulmonar obstructiva crónica.
Además de los costos económicos están los sociales y psicológicos de los pacientes que presentan una fractura relacionada con la osteoporosis.
Sabemos que sólo el 30% de los pacientes que presentan una fractura de cadera se reintegran a sus actividades laborales y sociales, y de un 15 a un 35% tendrán una pérdida de su autonomía, necesitando asistencia, ya sea en la casa o en el hospital, además que la supervivencia está disminuida en relación con la población normal.
Sabemos que estos desórdenes son comunes y causan problemas importantes, pero en la mayoría de los casos poco se conoce sobre las alteraciones que están causando el transtorno en la remodelación ósea.
Sin embargo nuevas técnicas para su estudio a nivel celular han ido apareciendo, disponibilidad de moléculas recombinantes y pruebas complementarias con DNA, experimentos con el gene “knockout”, como también exámenes diagnósticos con aplicación clínica (nuevas medidas de la masa ósea con mejores valores predictivos y reproducibilidad), lo mismo que marcadores tanto para la resorción como para su formación, ayudan a entender este complicado e interesante mundo del hueso, que hasta hace muy poco se consideraba solamente como un tejido “inerte de sostén”.
Sabemos que la masa ósea alcanza su máximo pico:
Aproximadamente 10 años después que se ha terminado su crecimiento lineal, inicia su caída alrededor de los 40 años y alcanza su máximo pico de disminución alrededor de los 80 años.
El pico de masa ósea máximo se alcanza alrededor de los 30 años y es menor en las mujeres que en los hombres y de éstos más bajo en las personas de raza blanca, presentando una fase acelerada de pérdida entre los primeros 5 a 10 años después de la menopausia, siendo más rápida en las que han presentado una menopausia precoz, tanto en forma espontánea como inducida.
Se ha estimado que las mujeres perderán el 35% de su hueso cortical y el 50% del trabecular, mientras que los hombres solamente dos tercios de estos valores.
La mitad de estas pérdidas de hueso trabecular estaría relacionado con la menopausia y el resto con factores inherentes al mismo proceso de envejecimiento. Aún permanece controvertido identificar el momento en el cual se inicia la pérdida ósea, siendo similar para los dos tipos de hueso.
El esqueleto del ser humano adulto está compuesto en su totalidad de dos tipos de hueso: trabecular y cortical. Existen evidencias que éstos presentan alteraciones en la misma forma, su explicación más posible es que existen diferencias en su “microambiente”.
La superficie de remodelación ósea en el hueso cortical está en íntima relación con células de la cavidad de la médula ósea la cual produce una serie de citokinas osteotrópicas, mientras que el cortical está un poco más lejano de estas influencias y estaría más en relación con hormonas tales como la PTH y la vitamina D3.
La proporción en su distribución en el esqueleto es diferente dependiendo de su región:
Lo cual podría predisponer a diferentes tipos de fracturas. La columna lumbar el hueso trabecular representa más del 60% de su totalidad. En la región intertrocanterea del fémur, su composición está distribuida en partes iguales, mientras en la región del cuello del fémur el cortical representa el 75%. Contraste la región media del radio contiene un 95% de hueso cortical.
Características del hueso cortical y trabecular
El hueso cortical es denso y compacto, representa el 85% del hueso corporal y es más abundante en los huesos largos.
Su volumen está regulado por la formación de hueso periosteal, remodelación dentro del sistema haversiano y resorción ósea endosteal. Es removido principalmente por resorción endosteal y resorción dentro de los canales haversianos.
Esto último lleva a presentar cierto grado de porosidad, pero la formación ósea periosteal ayuda a aumentar el diámetro de la cortical durante toda la vida.
La pérdida del hueso cortical se inicia después de los 40 años, presentando una aceleración importante 5 a 10 años después de la menopausia, la cual dura aproximadamente unos 15 años, para luego presentarse en forma más lenta.
Existe evidencia clara que la terapia de reemplazo estrogénica después de la menopausia ayuda a preservar éstas pérdidas.
Su disminución está en relación con un aumento importante de fracturas de cadera. Además en caso de hiperparatiroidismo primario su resorción estaría aumentada.
El hueso trabecular representa el 15% del esqueleto:
Sus cambios se producen después de los 30 años, lo cual podría llegar a presentar algunas manifestaciones de osteoporosis.
La mayoría de los estudios han demostrado que su disminución empieza en la vida adulta temprana y no en el momento en que se termina la función ovárica, presentando su mayor disminución en el momento de la menopausia.
La pérdida de hueso trabecular se ve con frecuencia en pacientes que padecen enfermedades malignas con metástasis óseas, caso en el cual la cavidad celular medular produce factores locales que estimularían los osteoclastos adyacentes de las placas trabeculares.
Su pérdida relacionada con la edad se debe a perforación y fragmentación de algunas trabéculas, más que a adelgazamiento de los discos óseos.
Debido a que recubre una amplia superficie, su resorción puede estar modulada tanto por factores locales, como por factores hormonales.
Remodelamiento óseo
Este proceso nos permite entender los fenómenos involucrados en su control, relación no solamente con factores locales de los osteoclastos y osteoblastos, sino con cambios que ocurren relacionados con la edad.
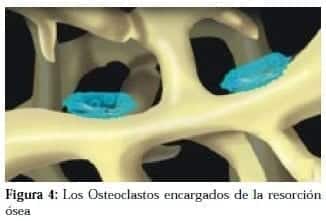
El esqueleto adulto representa un estado dinámico, estando continuamente “destruyéndose” y “contruyéndose” por acción de los osteoclastos y osteoblastos en las superficies trabeculares y en el sistema haversiano.
Este “turnover” o redoblamiento ocurre en “paquetes” pequeños en todo el esqueleto. El redoblamiento de cada paquete dura un período determinado de tiempo aproximadamente de 3 a 4 meses.
La remodelación que ocurre en cada paquete (llamada unidad de remodelamiento por Frost en 1964) está anatómica y cronológicamente separado uno de otro, lo cual sugeriría que el estímulo para esta serie de eventos a nivel celular estaría localmente controlado, posiblemente por mecanismos de autoregulación, seguramente por factores autocrinos o paracrinos generados en el microambiente óseo.
La secuencia es siempre la misma: resorción ósea osteoclástica, seguida por formación ósea osteoblástica, que llevaría a reparar el defecto.
El nuevo hueso así formado se ha llamado unidad ósea estructural (BSU).
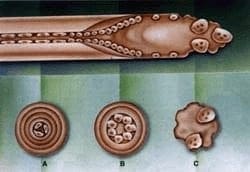
La activación osteoclástica es el paso inicial.
Los osteoclastos son activados por factores aún no completamente aclarados. Su activación podría ocurrir debido a interacciones entre proteínas de la membrana celular osteoclástica (integrinas) y proteínas de la matriz ósea que contenga RGD (arginina, glicina, asparagina) que representa una secuencia determinada de aminoácidos (tales como la osteopontina).
La activación de los osteoclastos se debe también a señales de estímulo producidas por células locales en el mismo ambiente del osteoclasto.
El proceso mismo de la remodelación se ha estimado que gasta aproximadamente 10 días. El siguiente período de reparación se lleva a cabo por un grupo de osteoblastos, los cuales son atraídos al sitio de resorción.
Esto último toma aproximadamente 3 meses. El evento inicial de la fase de formación es una migración unidireccional (quemotaxis) de los precursores de los osteoblastos al sitio del defecto, seguido por aumento de la proliferación celular.
La interleukina-1 (y posiblemente la 4 y 6) se ha demostrado que es responsable en la fase inicial estimuladora de la resorción osteoclástica, reacción que es mediada en parte por prostaglandinas.
El mecanismo involucrado en la fase estimuladora de los osteoblastos no es aún completamente claro, en el caso de que aún exista un estímulo con interleukina-1 esta fase se altera.
Una explicación razonable consiste en que existen factores locales, los cuales son producidos como resultado de la resorción estimulada por interleukina-1, que a su vez comprometen la terapia siguiente relacionada con la formación de hueso nuevo.
En los pacientes viejos con osteoporosis:
Existe una disminución en el espesor de la pared, que reflejan posiblemente la imposibilidad de los osteoblastos a reparar adecuadamente los defectos resortivos llevada a cabo durante la resorción osteoclástica normal.
Se deberá también tener en cuenta que la pérdida progresiva de hueso, iniciándose alrededor de los 35 años (dependiendo de cada hueso) ocurre en todos los seres humanos, y es indicador de un desequilibrio “fisiológico” entre la resorción y la formación.
Acontecimientos celulares comprometidos en la fase de formación
Los acontecimientos comprometidos en la fase de formación osteoblástica son la quemotaxis, proliferación y diferenciación, seguido por mineralización del hueso y finalización de la actividad osteoblástica.
El evento inicial consiste en la atracción quemotáxica de los osteoblastos o sus precursores al sitio en donde existe el defecto de resorción, listo es mediado por factores locales que se producen durante el proceso, como el TGFbeta (transforming growth factor B) y el PDGF (platelet-derived growth factor).
La siguiente fase consiste en la proliferación de precursores de los osteoblastos, la cual tiene lugar durante el proceso de resorción. Factores autocrinos y paracrinos están involucrados, incluyendo miembros de la superfamilia de los TGFbeta (I y II) y PDGF, IGF (insulin like growth factors) y FGF (heparin-binding fibroblast growth factors).
El tercer evento consiste en la diferenciación del precursor del osteoblasto en célula madura. Varios factoes de crecimiento óseos podrían estar comprometidos, como la actividad de la fosfatasa alcalina, el colágeno tipo I y la síntesis de ostecalcina.
La fase final consiste en frenar la actividad osteoblástica. Las lagunas de resorción son usualmente reparadas, de nuevo las TGFbeta intervienen para finalizar el proceso de formación.
Cuando estos ciclos se alteran, aumento de la resorción o disminución en la formación, el balance neto sería una pérdida de hueso y llevaría a los que conocemos como osteoporosis.
Ultimamente se le ha dado importancia al papel potencial de la interleukina-1 y 6 en la pérdida ósea asociada con la menopausia.
Algunos autores han demostrado que monocitos circulantes producen un aumento de los niveles de interleukina-1 in vitro, en el período postmenopáusico y que podría ser revertido mediante la administración de estrógenos.
La administración de interleukina-1, como mediador en ausencia de estrógenos ha suministrado una información muy valiosa, puesto que antagonistas de los receptores de interleukina-1 podrían ser usados potencialmente en el tratamiento de la pérdida ósea de la menopausia.
Factores de riesgo
Sabemos que para que se presente la osteoporosis existe de una parte un componente genético importante y de otra un componente ambiental representado por una serie de factores de riesgo.
Dentro de estos están los llamados establecidos tales como:
Mujeres de raza blanca, edad avanzada, menopausia temprana, ooforectomía premenopáusica, amenorrea premenopáusica, uso crónico de corticoides y reposo prolongado en cama.
Otro tipo de factores de riesgo son los llamados probables como: baja relación peso/altura, antecedentes positivos de osteoporosis en la familia, alto consumo de alcohol, bajo consumo de calcio, hábito de fumar, alto consumo de proteínas/fosfatos y alto consumo de cafeína.
También existen otros igualmente bien conocidos como son ciertas patologías, hipertiroidismo, mieloma múltiple o la administración de medicamentos como los anticonvulsivantes derivados del diphenilhidantoinato sódico, el metrotrexate y la heparina.
Bibliografía
- 1. Frost HM. Dynamics of bone remodeling. In: bone biodynamics (Little, Brown: Boston) 1964; 345.
- 2. Ronald NM, Canalis E and Patridge NC: invited review of a workshop: Anabolic hormones in bone: Basic research and Therapeutic potential. J Clin Endocrinol Metabol 1996; 81(3): 872877.
- 3. Riggs Bi, Melton LJ III: Involutional osteoporosis. N Engl J Med 1986; 314: 1676-1685.
- 4. Marcelli C, Yates AJP and Mundy GR. In vivo effects of human recombinant trasnforming growth factor beta on bone turnover in normal mice. J Bone Miner Res 1990; 5: 1087-1096.
- 5. Mundy GR. Bone remodeling. In: Bone remodeling and its disorders (Martín Dunitz, London) 1995; 1-11.
- 6. Ardila E, Martínez de Hoyo, Iglesias A. Osteoporosis: Aspectos clínicos y fisiopatológicos. Médicas UIS 1994; 8(3): 135-141.
- 7. Edwin A, Brugge JS. Integrins and signal transduccion pathways: The road taken. Science 1995; 268: 233-239.
- 8. Kassem M, Khosla S, Spelsberg TC et al. Cytokine production in bone marrow microenvironment: failure to demostrate estrogen regulation in early postmenopausal women. J Clin Endocrinol Metabol 1996; 81(2): 513-518.
- 9. Nicolas V, Prewett A, Bettica P et al. Age-related decreases in Insuline-lilke Grow Factor-1 and Transforming Growth Fcator-B in femoral cortical bone from both men and women: implications for bone loss with aging. J Clin Endocrinol Metabol 1994; 78(5): 1011-1016.
- 10. Mantilla RD, Ardila E. Factores de riesgo en fracturas usualmente asociadas con osteoporosis en el Hospital San Juan de Dios de Santafé de Bogotá. Rev Col Ortop 1992; 6: 249-254.