Papel de los gestágenos en el estudio WHI
Javier Haya Palazuelos*, Juan Enrique Blümel Méndez**, Camilo Castelo-Branco Flores***
* Hospital Universitario Santa Cristina, Madrid.
** Facultad de Medicina, Universidad de Chile.
*** Hospital Clínica de Barcelona.
Resumen
Los gestágenos son sustancias químicas que inducen una transformación secretora del endometrio. De la testosterona derivaron fármacos con propiedades progestácionales, los 19- norderivados (levonorgestrel, noretisterona, dexogestrel, etc). De la progesterona se obtuvieron los pregnanos (medroxiprogesterona, megestrol, ciproterona, etc). En los últimos años se ha logrado producir progesterona natural oral. La medroxiprogesterona se ha usado ampliamente en anticoncepción y terapia de reemplazo hormonal (TRH). El estudio WHI ha sugerido que la medroxiprogesterona podría ser responsable de algunos efectos negativos de la TRH. Algunas investigaciones sugieren que la medroxiprogesterona de depósito aumenta ligeramente el riesgo de cáncer de mama; su uso en postmenopáusicas se asocia a mayor densidad mamográfica, un conocido factor de riesgo, y en cultivos celulares tiene un efecto proliferativo; además, se ha descrito un mayor riesgo en hormonoterapia que incluye gestágenos. Desde el punto de vista cardiovascular, aunque en dosis bajas la medroxiprogesterona no modifica sustancialmente el perfil lipídico, sí altera la función endotelial, no afecta la coagulación, pero puede aumentar los receptores de trombina. No hay estudios claros que permitan identificar con seguridad si la medroxiprogesterona tiene efectos deletereos. Sin embargo, algunas observaciones sugieren cautela en pacientes con riesgo elevado de cáncer de mama o de enfermedad cardiovascular.
Palabras clave: Progestágenos, MPA, cáncer de seno, HRT, estudio del WHI.
Abstract
Gestagens are chemical substances capable of inducing secretory changes in the endometrium. Derived from testosterone are compo unds with progestational properties such as the 19-norderivatives levonogestrel, no retisterone and dexogestel Progesterone grave origin to pregnanes like medroxiprogesterona acetate (MPA). Magestrol and cyproterone. In recent years natural progesterone has been obtained. Meanwhile, MPA has been wid ely used for contraception and Hormonal Replacement therapy. (HRT). The WHI study suggested that this compound could be responsible for some negative side effects of HRT. Some studies also suggest that MPA slightly increases the risk for breast cancer. Its use in postmenopausal women increases mammographic density, a risk factor for breasst cancer. In cultured cells, it has a proliferative affect. Furthemore, a greater risk for this disease has been described among women under HRT including gestagens. In relation to cardiovascular affects, even if at low doses MPA does substantially modify the lipid profile, it does alter the endothelial function. Coagulation is not altered by MPA, but it may increase thrombin receptors.
Key words: Progestagens. MPA, breast cancer, HRT, The WHI Study.
Análisis general de la acción de los Gestágenos
Los gestágenos son moléculas de acción hormonal que se caracterizan, como su nombre indica, por favorecer el desarrollo del embarazo en los mamíferos. En general, podemos definir como gestágeno a cualquier sustancia que transforme hacia secretor el endometrio estimulado por los estrógenos.
Es muy difícil efectuar un análisis general de la acción de los gestágenos, ya que, como veremos más adelante, forman una familia muy heterogénea y existen grandes diferencias entre ellos. Sin embargo, tomando como ejemplo la progesterona, hormona natural de la mujer, podemos señalar varias acciones fisiológicas de ésta:
• En el endometrio, previamente desarrollado por el estradiol, la progesterona estimula el desarrollo y la actividad del endometrio secretor; pero, si éste no estuviera previamente estrogenizado provocaría una atrofia glandular. Por otro lado, la disminución de los niveles de progesterona produce de manera fisiológica el desprendimiento de la mucosa. De hecho, el descenso de la progesterona o de los gestágenos sintéticos, constituye el medio más eficaz de inducir sangrados.
• En el útero gestante, la progesterona deprime su excitabilidad y de este modo, reduce la contractilidad.
• En las glándulas endocervicales, la secreción acuosa producida por los estrógenos se transforma en secreción viscosa.
• En el epitelio vaginal, impide la cornificación celular que provocan los estrógenos.
• En la trompa, reduce la secreción de las células caliciformes y aumenta la actividad de las células ciliares, facilitando así el paso del óvulo.
• En el tejido mamario, la progesterona, sinérgicamente con el estradiol, facilita el desarrollo de los acinos glandulares.
Diferencias específicas entre Gestágenos
Los gestágenos pueden clasificarse en naturales y sintéticos. Existe un único gestágeno natural con acción biológica significativa: la progesterona. Por el contrario, contamos con un gran número de gestágenos sintéticos, cada uno con sus propias peculiaridades. Aunque se ha clasificado a los gestágenos sintéticos en tres grupos (pregnanos, estranos y gonanos), en la actualidad se prefiere agruparlos en dos categorías: los derivados de la 19-nortestosterona y los derivados de la 17-hidroxiprogesterona (figura 1).
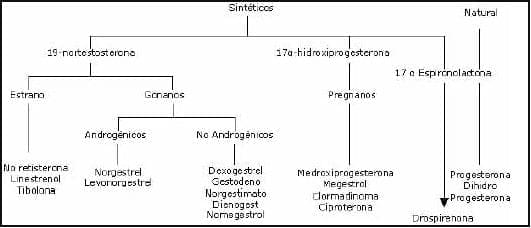
Figura 1. Clasificación de los Gestágenos
Cuando se descubrió la estructura química de la progesterona se comprobó que, en la forma aislada en ese momento, sólo tenía actividad clínica si era administrada por vía parenteral. Esto llevó a los investigadores a buscar compuestos activos por vía oral, que permitieran una administración más cómoda. Gestágenos derivados de la testosterona.
Al conseguirse, en 1938, el primer estrógeno de síntesis con actividad tras su administración oral, mediante la introducción de un grupo etinilo en el carbono “17”, se intentó extrapolar este principio a otras hormonas esteroides, entre ellas la testosterona. Así se obtuvo la etinil-testosterona o etisterona, con un grupo etinilo en el carbono “17”, el cual sorprendentemente presentaba propiedades progestacionales, las cuales se mantenían después de su administración por vía oral.
Este fue el primer gestágeno de la historia activo por vía oral, pero que desgraciadamente mantenía una intensa acción androgénica, con lo que esto supone de efectos secundarios (aumento de peso, hirsutismo, alteración del perfil lipídico, etc. ). Así como la adición del grupo etinilo en el carbono “17” resulta decisiva para la adquisición de la actividad progestacional por vía oral, la eliminación del grupo metilo “C-19” del carbono “10”, potencia aún más la actividad gestagénica de la molécula y elimina una gran parte de la actividad androgénica.
La primera molécula obtenida mediante esta estrategia fue la noretisterona (o noretindrona). Mediante la modificación de la molécula de noretisterona se obtienen una gran cantidad de gestágenos. Todos ellos se conocen con el nombre genérico de 19-norderivados y tienen en común la adición del grupo etinilo en el carbono 17 y la falta del carbono 19. Las primeras modificaciones efectuadas en la noretisterona consistieron en la adición de diversos radicales a esta molécula.
Se obtuvieron así los 19-norderivados de primera generación o estranos. En este grupo encontramos, además de la noretisterona, el noretinodrel, el linestrenol, la tibolona, etc. La denominación de estranos hace referencia a que todos los miembros de este grupo tienen una cierta acción estrogénica, variable según el tipo de molécula. Así encontramos que los estranos tienen acción androgénica (recuerdo de su procedencia de la testosterona), gestagénica y estrogénica. Posteriormente, buscando disminuir la actividad androgénica de estos primeros 19-norderivados, se realizó la sustitución del radical metilo del carbono “13” por otros radicales.
Ello dio lugar a una nueva familia de 19-norderivados: los gonanos. Se caracterizan por tener una actividad gestagénica muy intensa, mayor que la de los estranos, lo que les hará ideales para su uso en anticoncepción oral. Sin embargo, algunos de ellos conservan actividad androgénica, por lo que desde el punto de vista clínico resulta útil dividir los gonanos en dos grupos: androgénicos y no androgénicos o también llamados 19-norderivados de segunda y tercera generación, respectivamente. Dentro de los gonanos con acción androgénica encontramos el norgestrel y su isómero activo, el levonorgestrel. En el grupo de los gonanos no androgénicos se encuentran el norgestimato, el desogestrel, el gestodeno, el dienogest y el nomegestrol.
Gestágenos derivados de la Progesterona
Los gestágenos sintéticos que tienen su origen en la molécula de progesterona, conocidos generalmente con el nombre de pregnanos, se obtienen mediante la adición de un grupo acetilo en el carbono “17”. También se conocen con el nombre de 17-acetoxi-progestágenos. En este grupo encontramos la medroxiprogesterona, la ciproterona, el nomegestrol y la clormadinona. En conjunto, se caracterizan por tener una actividad gestagénica más potente que la de la progesterona, pero menor que la de los 19-norderivados.
Progesterona
El último grupo de gestágenos disponibles está formado por la misma progesterona. Actualmente está disponible en forma micronizada, lo que la hace útil por vía oral. También disponemos de un isómero de la progesterona: la retroprogesterona. Ambas moléculas tienen efectos metabólicos neutros, sin ninguna acción androgénica, lo cual es ventajoso con respecto a la mayoría de los gestágenos sintéticos. Siendo un magnífico gestágeno, la principal desventaja de la progesterona es que su potencia gestagénica es pequeña, por lo que se requieren dosis altas para conseguir un efecto progestacional significativo, lo cual le resta cierta utilidad en la clínica.
Gestágenos derivados de la 17a Espironolactona
Recientemente se ha lanzado una nueva familia de progestágenos derivados de la espironolactona, que se llama drospirenona, compuesto que aparece mezclado con el etinil-estradiol como anticonceptivo oral.
Este compuesto tiene la peculiaridad de tener además de su acción progestacional, acción antiandrogénica la cual equivale a un tercio del efecto del acetato de ciproterona y además, tiene efecto antimineralocorticode como lo es la progesterona natural, evitando así la retención de agua; no tiene efecto antiglucocoticoide.
Heterogeneidad de los Gestágenos
Viendo el dispar origen de los diversos gestágenos, se comprende fácilmente su heterogeneidad. Así, dentro de las moléculas con acción gestagénica, nos encontramos que las hay con acción estrogénica y antiestrogénica, androgénica y antiandrogénica, mineralocorticoidea y antimineralocorticoidea, glucocortidea
y antiglucorticoidea. Así pues, asumiendo que todos los gestágenos han de tener actividad gestagénica, las demás acciones son imprevisibles, no dependiendo exclusivamente de su familia, sino de cada molécula en concreto. Por ello, los efectos de un gestágeno en concreto no se pueden generalizar a todos los demás, ni tan siquiera a los del mismo grupo. Así pues, por ejemplo, los efectos de la medroxiprogesterona no se pueden equiparar a los de la ciproterona o viceversa, a pesar de que ambos son 17-acetoxi-derivados de la progesterona.
El estudio WHI sugiere riesgos del acetato de medroxiprogesterona
En el estudio WHI (Tabla 1) se aprecia un aumento del riesgo relativo de sufrir infarto de miocardio, accidente cerebro-vascular, cáncer de mama y episodios tromboembólicos 1. Aparentemente, hasta ahora el aumento del riesgo sólo se ha demostrado en la rama del estudio que recibía estrógenos conjugados equinos más acetato de medroxiprogesterona y no en las mujeres que recibían estrógenos solos. Cabe preguntarse ¿hasta qué punto es responsable el componente gestagénico de esta circunstancia? Para responder a este pregunta y juzgar el posible papel de la medroxiprogesterona en los incrementos de riesgo mencionados, será interesante repasar qué conocemos de ésta en relación con sus efectos en las mamas, territorio
cardiovascular y riesgo de trombosis. Esta revisión se refiere fundamentalmente a la medroxiprogesterona; en Europa el gestágeno más utilizado en la THS es la progesterona micronizada, en parte por resultados del estudio PEPI, el cual manifiesta que la progesterona natural micronizada produce un perfil lipídico más favorable que la medroxiprogesterona, de amplio uso en Estados Unidos.
Efectos de la medroxiprogesterona sobre el riesgo de Cáncer de mama
El acetato de medroxiprogesterona, administrado continuamente y en altas dosis, produce fácilmente tumores mamarios en perros de la raza Beagle2, 3. Este ha sido un dato muy extendido entre la población científica y ha condicionado la conducta de organismos como la FDA norteamericana durante muchos años. Sin embargo, hoy sabemos que este dato no es en absoluto extrapolable a la población humana. De hecho, este efecto de la medroxiprogesterona se observa exclusivamente en perros, quizá porque en ellos los progestágenos estimulan la secreción de hormona del crecimiento, que se sabe que es un agente mamotrófico en ellos4. Este efecto tan evidente de desarrollo de tumores mamarios no se observa en ningún otro animal, ni por supuesto en las mujeres, aunque se utilicen tratamientos prolongados y a altas dosis.
Tabla 1. Riesgos y Beneficios de la Terapia Hormonal de reemplazo. Estudio WHI
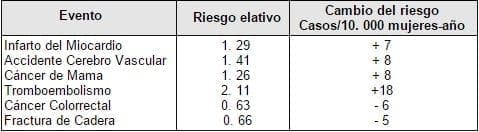
Sin embargo, últimamente se ha implicado a la medroxiprogesterona, usada como anticonceptivo, en el desarrollo de cánceres mamarios en la especie humana. Ello es debido fundamentalmente a dos estudios tipo caso-control. Uno realizado en Costa Rica, incluyó sólo diecinueve casos, por lo que su valor es relativamente escaso5. El otro, realizado en Nueva Zelanda no halló aumento global del riesgo relativo en mujeres tratadas con medroxiprogesterona, pero sí evidenció un pequeño incremento del riesgo en los primeros años de tratamiento y únicamente en las pacientes jóvenes (menores de 25 años)6. Más recientemente la Organización Mundial de la Salud (OMS), realizó un estudio tipo caso-control, basado en poblaciones intrahospitalarias, llevado a cabo durante nueve años en 3 países en desarrollo (Kenia, Méjico y Tailandia)7. En este trabajo se comprobó que la exposición a la medroxiprogesterona de depósito aumentó ligeramente el riesgo de diagnosticar un cáncer de mama en los primeros cuatro años de uso, especialmente en las menores de 35 años (riesgo relativo 1,21), pero no hubo evidencias de aumento del riesgo con la prolongación del tratamiento más allá de este período.
Un análisis combinado y más profundo de los datos de la OMS y del estudio de Nueva Zelanda, concluyó que el mayor riesgo de detección de un cáncer de mama observado en los primeros años de tratamiento era debido, bien a un mejor uso de las técnicas diagnósticas (las pacientes participantes en el estudio estaban mejor controladas que el resto de la población), o bien a la aceleración del crecimiento de tumores preexistentes8. Esto explicaría porqué tras el incremento inicial del riesgo, en los primeros años de tratamiento, posteriormente éste se iguala con la población no tratada con medroxiprogesterona. Por ello, en este estudio se señala que los médicos deben informar a las pacientes que utilicen medroxiprogesterona, que ésta puede acelerar el crecimiento de un cáncer oculto preexistente.
En relación con la TRH, pese a que no existe una demostración absoluta, en general se considera que un tratamiento prolongado (cinco años o más) incrementa ligeramente el riesgo de presentar cáncer de mama9. El incremento del riesgo se estima entre un 20 y un 30% (riesgo relativo 1, 2-1, 3) y es especialmente manifiesto en pacientes no obesas 10. En la TRH, siempre se había relacionado al uso de estrógenos con mayor riesgo de cáncer de mama. Incluso se consideraba que, al igual que ocurre en el endometrio, el gestágeno actuaría de manera protectora sobre la mama. Sin embargo, esta idea parece ser errónea. Los primeros datos en este sentido provienen del estudio PEPI (“Postmenopausal Estrogen/Progestin Interventions”). En éste, se observó un incremento de la densidad mamográfica mucho mayor en las pacientes quienes recibían gestágenos para proteger su endometrio, que en aquéllas quienes únicamente tomaban estrógenos11. Si admitimos que la mayor densidad mamaria puede suponer un mayor riesgo de padecer un cáncer de mama, esta observación publicada va a favor de la influencia negativa de los gestágenos. Más valor tienen, sin embargo, estudios publicados posteriormente. Son ya varios los trabajos dados a conocer a la comunidad científica en los cuales se destaca el hecho de que la adición de gestágenos al tratamiento estrogénico, no sólo no protege del cáncer de mama, sino que, bien al contrario, supone un incremento de riesgo con relación al tratamiento estrogénico aislado12, 13.
En un estudio caso-control, con 1897 casos de cáncer de mama y 1637 controles, con mujeres entre 55 y 72 años, se llega incluso a precisar que el riesgo es mayor en las formas en las cuales el gestágeno se administra de manera secuencial que en pautas continuas14. Según estos autores, el riesgo de diagnosticar un cáncer de mama es un 10% más alto (riesgo relativo 1, 1) por cada cinco años de uso de THS con estrógenos solos, llegando al 38% de riesgo (riesgo relativo 1, 38) cuando se emplea THS con gestágenos de manera secuencial.
Similares resultados se obtuvieron en un estudio de cohortes en el cual participaron 46. 355 mujeres postmenopáusicas. En este caso, se observó que las pacientes de mayor peso (BMI > 24. 4 kg/m2) no sufrían de este incremento de riesgo15, lo cual coincide con las observaciones previas acerca del mayor riesgo de las pacientes no obesas, en relación con el uso de TRH. Desgraciadamente, todos estos estudios han evaluado a mujeres quienes reciben gestágenos en general, sin que se haya estudiado de manera particular la medroxiprogesterona. En esta línea únicamente se ha publicado un artículo, el cual está efectuado en cultivos de células mamarias.
En él, se comprueba que la adición al medio de cultivo de estrógenos más acetato de medroxiprogesterona se asocia con mayor proliferación celular que cuando se agregan sólo estrógenos. Esta respuesta proliferativa afecta especialmente a la porción terminal de la unidad ducto-lobulillar, sitio donde se desarrollan más frecuentemente la mayoría de los cánceres mamarios16. En resumen, el uso de medroxiprogesterona y quizás de todos los gestágenos, pudiera estar relacionados con un mayor riesgo de cáncer de mama.
Efectos de la medroxiprogesterona sobre el riesgo cardiovascular
No existen datos directos de aumento de riesgo vascular arterial con el uso de la medroxiprogesterona, por lo que deberemos manejar los factores de riesgo subrogado, tales como el perfil lipídico o la función endotelial. El impacto de la medroxiprogesterona sobre el perfil lipídico cuando se administra sola, parece ser negativo. Prácticamente en todos los trabajos se ha encontrado una disminución del colesterol HDL y un aumento del colesterol total y del LDL17. En un ensayo multicéntrico realizado por la OMS con medroxiprogesterona como anticonceptivo, se encontró un efecto adverso transitorio sólo en las primeras semanas posteriores a la inyección, cuando los niveles sanguíneos de este esteroide eran altos18. No están las cosas tan claras cuando la medroxiprogesterona se administra junto con estrógenos, como TRH. Existen trabajos en los cuales no se observa un efecto deletéreo de esté gestágeno sobre el perfil lipídico19-21. Por el contrario, otros autores afirman que a dosis bajas (2,5 mg/día) no tiene repercusión negativa, pero sí con dosis de 5 mg/día o más altas22, 23. En cultivos de células procedentes de las arterias coronarias, antagoniza la acción antiesclerótica de los estrógenos24.
La función endotelial está cada día más investigada y valorada. En esta línea, las cosas están más claras que con respecto al perfil lipídico, ya que todos los estudios son coincidentes: la medroxiprogesterona parece influir negativamente en la función endotelial. Así se ha visto que disminuye la vasodilatación inducida por los estrógenos25, 26 y que atenúa la producción de ÓXIDO NÍTRICO inducida por ellos27. Desde el punto de vista cardiaco, la medroxiprogesterona aumenta la masa muscular del ventrículo izquierdo, en parte por el aumento del “insulin-like growth factor-1” (IGF-1)2828, aunque probablemente intervengan otros factores aún no esclarecidos. El aumento del ventrículo izquierdo incrementa de manera paralela sus necesidades metabólicas, por lo cual se hace más susceptible a la isquemia. La progesterona natural, pero no la medroxiprogesterona, mejora el efecto beneficioso de los estrógenos sobre la isquemia inducida por el ejercicio en las mujeres postmenopáusicas29. En resumen, los diferentes estudios parecen indicar que la medroxiprogesterona pudiera ejercer una influencia negativa sobre el árbol arterial y el corazón.
Efectos de la medroxiprogesterona sobre el riesgo trombótico
Los accidentes tromboembólicos suceden en el árbol vascular venoso y se relacionan fundamentalmente con alteraciones en el sistema de coagulación/anticoagulación. Se ha comprobado que la medroxiprogesterona a altas dosis puede inducir pequeños cambios en los factores de coagulación y de anticoagulación, pero estos permanecen dentro de márgenes normales y además se compensan entre sí30. Por ello podríamos concluir que la medroxiprogesterona no modifica los factores de coagulación. Sin embargo, por aumentar los receptores de trombina podría aumentar el riesgo trombótico31.
Conclusiones
Podríamos señalar que la investigación publicada a la fecha no es concluyente sobre los efectos deletéreos que pudiera tener la medroxiprogesterona. A ello contribuye el hecho de que en los diferentes estudios se han empleado dosis variables y pautas diferentes de medroxiprogesterona. Además, los datos provienen tanto del mundo de la anticoncepción como de la menopausia. Sin embargo, sí podemos concretar que mientras que los estudios más pesimistas hablan de un incremento del riesgo de patología vascular o de cáncer de mama, lo que permitiría culpar a la medroxiprogesterona de los resultados del WHI, los más optimistas únicamente pueden descartar el incremento del riesgo, pero en ningún caso protección alguna.
Referencias
1. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative random ized controlled trial. JAMA 2002; 288: 321-33.
2. Concannon PW, Spraker TR, Casey HW, Hansel W. Gross and histopathologic effects of medroxyprogesterone acetate and progesterone on the mammary glands of adult beagle bitches. Fertil Steril 1980; 36: 373-87.
3. El Etreby MF, Graf KJ, Beier S, Elger W, Gunzel P, Neumann F. Suitability of the beagle dog as a test model for the tumorigenic potential of contraceptive steroids. “A short review”. Contraception 1979; 20: 237-56.
4. Rutteman GR, Stolp R, Rijnberk A, Loeffler S, Bakker JA, Bevers MM, Meulenberg PM, Eigenmann JE. Medroxy-progesterone acetate administration to ovariohysterectomized, oestradiol-primed beagle bitches. Effect on secretion of growth hormone, prolactin and cortisol. Acta Endocrinol 1987; 114: 275-82.
5. Lee NC, Rosero-Bixby L, Oberle MW, Grimaldo C, Whatley AS, Rovira EZ. A case-control study of breast cancer and hormonal contraception in Costa Rica. J Natl Cancer Inst 1987; 79: 1247-54.
6. Paul C, Skegg DC, Spears GF. Depot medroxyprogesterone (Depo-Provera) and risk of breast cancer. BMJ 1989; 299: 759-62.
7. WHO Collaborative Study of Neoplasia and Steroid Contraceptives. Breast cancer and depot-medroxyprogesterone acetate: a multinational study. Lancet 1991; 338: 833-8.
8. Skegg DC, Noonan EA, Paul C, Spears GF, Meirik O, Thomas DB. Depot medroxyprogesterone acetate and breast cancer. A pooled analysis of the World Health Organization and New Zealand studies. JAMA 1995; 273: 799-804.
9. Persson I, Weiderpass E, Bergkvist L, Bergstrom R, Schairer C. Risks of breast and endometrial cancer after estrogen and estrogen-progestin replacement. Cancer Causes Control 1999; 10: 253-60.
10. Magnusson C, Baron JA, Correia N, Bergstrom R, Adami HO, Persson I. Breast-cancer risk following long-term oestrogen and oestrogen-progestin-replacement therapy. Int J Cancer 1999; 81: 339-44.
11. Greendale GA, Reboussin BA, Sie A, Singh HR, Olson LK, Gatewood O, Bassett LW, Wasilauskas C, Bush T, Barrett-Connor E. Effects of estrogen and estrogen-progestin on mammographic parenchymal density. Postmenopausal Estrogen/Progestin Interventions (PEPI) Investigators. Ann Intern Med 1999; 130: 262-9.
12. Stephens MB. Estrogen-progestin increases breast cancer risk. J Fam Pract 2000; 49: 301-2.
13. Miller JL. Breast-cancer risk: higher with estrogen-progestin than estrogen alone. Am J Health Syst Pharm 2000; 57: 635-6.
14. Ross RK, Paganini-Hill A, Wan PC, Pike MC. Effect of hormone replacement therapy on breast cancer risk: estrogen versus estrogen plus progestin. J Natl Cancer Inst 2000; 92: 328-32.
15. Schairer C, Lubin J, Troisi R, Sturgeon S, Brinton L, Hoover R. Menopausal estrogen and estrogen-progestin replacement therapy and breast cancer risk. JAMA 2000; 283: 485-91.
16. Hofseth LJ, Raafat AM, Osuch JR, Pathak DR, Slomski CA, Haslam SZ. Hormone replacement therapy with estrogen or estrogen plus medroxyprogesterone acetate is associated with increased epithelial proliferation in the normal postmenopausal breast. J Clin Endocrinol Metab 1999; 84: 4559-65.
17. Enk L, Landgren BM, Lindberg UB, Silfverstolpe G, Crona N. A prospective, one-year study on the effects of two long acting injectable contraceptives (depot-medroxyprogesterone acetate and norethisterone oenanthate) on serum and lipoprotein lipids. Horm Metab Res 1992; 24: 85-9. 7
18. World Health Organization WHO. Special Programme of Research, Development and Research Training in Human Reproduction. Task Force on Long-Acting Systemic Agents for Fertility Regulation. A multicentre comparative study of serum lipids and apolipoproteins in long-term users of DMPA and a control group of IUD users. Contraception 1993; 47: 177-91.
19. Luciano AA, Miller BE, Schoenenfeld MJ, Schaser RJ. Ogen/Provera Study Group. Effects of estrone sulfate alone or with medroxyprogesterone acetate on serum lipoprotein levels in postmenopausal women. Obstet Gynecol 2001; 97: 101-8.
20. Alwers R, Urdinola J, Onatra W, Sanchez F, Posso H. Changes in normal lipid profile of menopausal women with combined hormone replacement therapy. Comparative clinical trial of two hormonal combinations (conjugated estrogens/medroxyprogesterone acetate versus estradiol valerate/cyproterone acetate). Maturitas 1999; 32: 41-50.
21. Bhathena RK, Anklesaria BS, Ganatra AM, Pinto R. The influence of transdermal oestradiol replacement therapy and medroxyprogesterone acetate on serum lipids and lipoproteins. Br J Clin Pharmacol 1998; 45: 170-2.
22. Aygen EM, Basbug M, Tayyar M, Kaya E. The effects of different doses of medroxyprogesterone acetate on serum lipids, lipoprotein levels and atherogenic index in the menopausal period. Gynecol Endocrinol 1998; 12: 267-72.
23. Wakatsuki A, Sagara Y. Effects of continuous medroxyprogesterone acetate on lipoprotein metabolism in postmenopausal women receiving estrogen. Maturitas 1996; 25: 35-44.
24. Seeger H, Wallwiener D, Mueck AO. Effect of medroxyprogesterone acetate and norethisterone on serum-stimulated and estradiol-inhibited proliferation of human coronary artery smooth muscle cells. Menopause 2001; 8: 5-9.
25. Wakatsuki A, Okatani Y, Ikenoue N, Fukaya T. Effect of medroxyprogesterone acetate on endothelium-dependent vasodilation in postmenopausal women receiving estrogen. Circulation 2001; 104: 1773-8.
26. Kawano H, Motoyama T, Hirai N, Yoshimura T, Kugiyama K, Ogawa H, Okamura H, Yasue H. Effect of medroxyprogesterone acetate plus estradiol on endothelium-dependent vasodilation in postmenopausal women. Am J Cardiol 2001; 87: 238-40.
27. Imthurn B, Rosselli M, Jaeger AW, Keller PJ, Dubey RK. Differential effects of hormone-replacement therapy on endogenous NITRIC OXIDE (nitrite/nitrate) levels in postmenopausal women substituted with 17 beta-estradiol valerate and cyproterone acetate or medroxyprogesterone acetate. J Clin Endocrinol Metab 1997; 82: 388-94.
28. Sites CK, Tischler MD, Rosen CJ, O’Connell M, Niggel J, Ashikaga T. Effect of short-term medroxyprogesterone acetate on left ventricular mass: role of insulin-like growth factor-1. Metabolism 1999; 48: 1328-31.
29. Rosano GM, Webb CM, Chierchia S, Morgani GL, Gabraele M, Sarrel PM, de Ziegler D, Collins P. Natural progesterone, but not medroxyprogesterone acetate, enhances the beneficial effect of estrogen on exercise-induced myocardial ischemia in postmenopausal women. J Am Coll Cardiol 2000; 36: 2154-9.
30. Abe O, Asaishi K, Izuo M, Enomoto K, Koyama H, Tominaga T, Nomura Y, Ohshima A, Aoki N, Tsukada T. Effects of medroxyprogesterone acetate therapy on advanced or recurrent breast cancer and its influences on blood coagulation and the fibrinolytic system. Surg Today 1995; 25: 701-10.
31. Herkert O, Kuhl H, Sandow J, Busse R, Schini-Kerth VB. Sex steroids used in hormonal treatment increase vascular procoagulant activity by inducing thrombin receptor (PAR-1) expression: role of the glucocorticoid receptor. Circulation 2001; 104: 2826-31.
